替米沙坦氢氯噻嗪片的溶出度研究
郭 焱
(盐城市药品检验所,江苏盐城224000)
替米沙坦氢氯噻嗪片的溶出度研究
郭 焱
(盐城市药品检验所,江苏盐城224000)
目的考察替米沙坦氢氯噻嗪片中替米沙坦和氢氯噻嗪在四种不同介质中的溶出行为。方法参照日本《医疗用药品品质情报集》中的溶出度试验条件,并根据替米沙坦氢氯噻嗪片处方成分的理化性质对溶出介质进行选择,分别考察了替米沙坦氢氯噻嗪片在pH 1.2的人工胃液(含0.5%十二烷基硫酸钠溶液)、pH 4.0醋酸盐缓冲液(含0.5%十二烷基硫酸钠溶液)、pH 6.8磷酸盐缓冲液(含0.25%十二烷基硫酸钠溶液)及水(含0.25%十二烷基硫酸钠溶液)中的体外溶出行为,采用高效液相色谱法测定替米沙坦氢氯噻嗪片中替米沙坦和氢氯噻嗪的溶出度,并通过相似因子(f2)法对两种成分的溶出度曲线进行相似性比较。结果替米沙坦和氢氯噻嗪的线性范围分别为20~50μg·L-1和6~20μg·L-1;在以上四种介质中,以替米沙坦为参比,替米沙坦氢氯噻嗪片中氢氯噻嗪的f2大于50。结论该方法简便、准确,重复性好,可用于该片剂的溶出度测定;替米沙坦氢氯噻嗪片中替米沙坦和氢氯噻嗪具有相似的溶出特点。
替米沙坦氢氯噻嗪片;溶出曲线;高效液相色谱法;相似因子
替米沙坦氢氯噻嗪片为血管紧张素ⅡAT1受体拮抗剂替米沙坦和利尿剂氢氯噻嗪所组成的复方降压制剂。替米沙坦和氢氯噻嗪的联合应用能减少药物的不良反应,增强降压效果。替米沙坦氢氯噻嗪片中的两主药替米沙坦和氢氯噻嗪均为难溶性药物,考察两药的溶出度有助于控制制剂的质量。本实验参考日本“药品品质再评价”工程在溶出度研究中所拟定的模拟人体消化道内体液的4种介质及相关文献[1~4],并根据替米沙坦氢氯噻嗪片主成分的理化性质对溶出介质进行适当调整,建立了适宜的溶出系统,并采用高效液相色谱法测定替米沙坦氢氯噻嗪片中两主药成分的体外溶出度,为评价和控制替米沙坦氢氯噻嗪片的质量提供了依据。
1 仪器与试药
1.1 仪器 Waters 2695高效液相色谱仪(美国waters公司);Waters 2996二级管阵列检测器;Empower色谱工作站;Capcell PAK C18柱(4.6 mm×250 mm,5μm,日本资生堂公司);ZRS-8G智能溶出仪(天津天大天发科技有限公司);AG-135型电子天平(梅特勒-托利多公司)。
1.2 试药 替米沙坦对照品(中国食品药品检定研究院,批号:100629-201202);氢氯噻嗪对照品(中国食品药品检定研究院,批号:100309-201103);替米沙坦氢氯噻嗪片[远大医药(中国)有限公司,批号:20131005、20140101、20140307];其他试剂均为国产分析纯,水为超纯水。
2 方法与结果
2.1 溶出介质的选择[1]水:纯净水;pH 1.2的人工胃液:取氯化钠2.0 g,加水适量溶解后,加盐酸7 mL,再加水稀释至1 000 mL,混匀,即得;pH 4.0醋酸盐缓冲液:将0.05mol·L-1醋酸溶液与0.05mol·L-1醋酸钠溶液按16.4∶3.6的比例混合,即得;pH 6.8磷酸盐缓冲液:取磷酸二氢钾1.7 g和无水磷酸氢二钠1.775 g,加水溶解并定容至1 000 mL,即得。
由于该制剂中的替米沙坦和氢氯噻嗪均为亲水性较差的化合物,所以本实验选择采用十二烷基硫酸钠为表面活性剂,分别采用含有1%,0.5%,0.25%十二烷基硫酸钠溶液[5]的四种溶出介质(pH 1.2、pH 4.0、pH 6.8和水)1 000 mL进行实验。
根据实验结果及国家药典委员会对国家药品标准中溶出度及释放度应用指导原则的修改建议指南,最终选择pH 1.2的人工胃液(含0.5%十二烷基硫酸钠溶液)、pH 4.0醋酸盐缓冲液(含0.5%十二烷基硫酸钠溶液)、pH 6.8磷酸盐缓冲液(含0.25%十二烷基硫酸钠溶液)及水(含0.25%十二烷基硫酸钠溶液)1 000 mL作为替米沙坦氢氯噻嗪片的溶出度考察介质。
2.2 溶出度方法的选择 分别按溶出度测定法(《中国药典》2010年版附录ⅩC篮法和桨法)测定[7],取样品6片,依法测定,精密量取续滤液20 μL,注入液相色谱仪,记录峰面积,计算两主成分溶出百分率。结果表明,当采用篮法,经45 min取样测定,替米沙坦和氢氯噻嗪的溶出度均超过了80%,且溶出均匀,而采用桨法测定,溶出度都只有70%左右,且溶出均一性较差,故选择篮法作为样品溶出度的测定方法。
2.3 取样时间的选择 经实验,经45 min时,替米沙坦氢氯噻嗪片中两主成分在四种不同溶出介质中的溶出率均超过了80%,因此,取样时间确定为45 min。
2.4 转速的选择 取同批次的替米沙坦氢氯噻嗪片样品6片,分别在转速为50、75和100 rpm时,经45 min时取样分别测定溶出度,替米沙坦和氢氯噻嗪在四种介质中的溶出程度均以100 rpm时最完全,故采用转速100 rpm。
经过上述实验筛选,确定最终的溶出试验条件:以上述四种不同溶出介质为溶媒,采用篮法,转速为100 rpm,取样时间为45 min。
2.5 溶出度测定方法的建立
2.5.1 色谱条件[2,6]Capcell PAK C18色谱柱(4.6 mm×250 mm,5μm),流动相:乙腈-氢氧化四丁铵磷酸盐缓冲溶液(取磷酸二氢铵0.43 g,10%氢氧化四丁铵溶液5 mL,加水至1 000 mL,用磷酸调节至pH 2.26)(22∶78),流速为1.0 mL·min-1,检测波长为230 nm,柱温:30℃,进样体积为20μL。在此色谱条件下测定对照品、替米沙坦氢氯噻嗪片供试品及阴性样品,结果显示,阴性样品无干扰,两主成分峰与其他成分峰分离度良好,供试品溶液色谱图见图1。

图1 供试品溶液高效液相色谱图
2.5.2 线性实验 分别精密称取替米沙坦和氢氯噻嗪对照品约40 mg和12.5mg,置100mL量瓶中,用以上四种溶出介质溶解并稀释至刻度,即得对照品储备液,精密量取对照品储备液适量,用溶出介质稀释制成浓度为20、30、40、45、50μg·mL-1和6、8、12.5、15、20μg·mL-1的溶液,精密量取上述溶液各20μL,分别进样分析。记录色谱图,以替米沙坦和氢氯噻嗪的浓度(C)为横坐标,以相应的峰面积(A)为纵坐标,进行线性回归,替米沙坦和氢氯噻嗪在20~50μg·mL-1和6~20μg·mL-1的浓度范围内线性关系均良好。
2.5.3 回收率试验 取相当于1/2片的阴性样本量,置500 mL量瓶中,精密加入替米沙坦和氢氯噻嗪对照品适量,分别用以上四种溶出介质溶解制成相当于标示量80%(替米沙坦:32μg·mL-1,氢氯噻嗪:10μg·mL-1),100%(替米沙坦:40μg·mL-1,氢氯噻嗪:12.5μg·mL-1),120%(替米沙坦:48 μg·mL-1,氢氯噻嗪:15μg·mL-1)的溶液,每个浓度各3份,摇匀,用0.45μm的微孔滤膜滤过,精密量取各续滤液20μL进样分析,计算分别为按外标法以峰面积计算替米沙坦和氢氯噻嗪的平均回收率,结果表明,各溶出介质中回收率试验结果均良好,两主成分峰的平均回收率均在99.5%以上,RSD均小于1.0%。
2.5.4 精密度试验 量取用以上四种溶出介质稀释制成的40μg·mL-1的替米沙坦、12.5μg·mL-1的氢氯噻嗪对照品溶液分别连续进样6次,每次20 μL,记录色谱图,计算各组峰面积的RSD,替米沙坦和氢氯噻嗪在四种介质(pH 1.2、pH 4.0、pH 6.8和水)中的峰面积RSD分别为0.3%和0.5%、0.5%和0.7%、0.9%和0.8%、0.7%和0.9%,表明本方法精密度良好。
2.5.5 稳定性试验 取精密度试验中浓度为40μg· mL-1的替米沙坦对照品溶液和浓度为12.5μg·mL-1的氢氯噻嗪对照品溶液,室温放置,分别在0、2、4、6、8、24 h进样20μL,记录色谱峰面积,替米沙坦、氢氯噻嗪在四种介质(pH 1.2、pH 4.0、pH 6.8,水)中的峰面积RSD分别为1.2%和1.0%、1.3%和1.1%、1.2%和1.5%、1.1%和1.3%,表明替米沙坦和氢氯噻嗪在各溶出介质中24 h内基本稳定。
2.5.6 滤膜的干扰试验 取替米沙坦、氢氯噻嗪对照品溶液,考察经滤膜(0.45μm)过滤前后的峰面积变化情况,结果表明滤膜没有干扰。
2.5.7 阴性干扰试验 按替米沙坦氢氯噻嗪片工艺方法制备缺替米沙坦、氢氯噻嗪的替米沙坦氢氯噻嗪阴性片,分别加以上四种溶出介质1 000mL,在37℃水浴中超声(200 W,45 kHz)15 min,放冷,用0.45μm的微孔滤膜滤过,取续滤液20μL进样分析,记录色谱图,结果表明,各溶出介质条件下阴性样本均不干扰本品溶出度的测定。
2.5.8 溶出曲线的均一性 取替米沙坦氢氯噻嗪片样品6片,照上述溶出度试验方法进行试验,考察溶出均一性。计算累计替米沙坦、氢氯噻嗪溶出量与时间的溶出曲线,结果在四种溶出介质中,6片样本中的两种主成分溶出度RSD均小于2%,表明样品溶出度的均一性良好。
2.5.9 样品溶出度检测 取3批样品进行溶出度试验(批号:131005、140101、140307),两种成分在四种不同的溶出介质中的累计溶出数据(平均值)见表1。
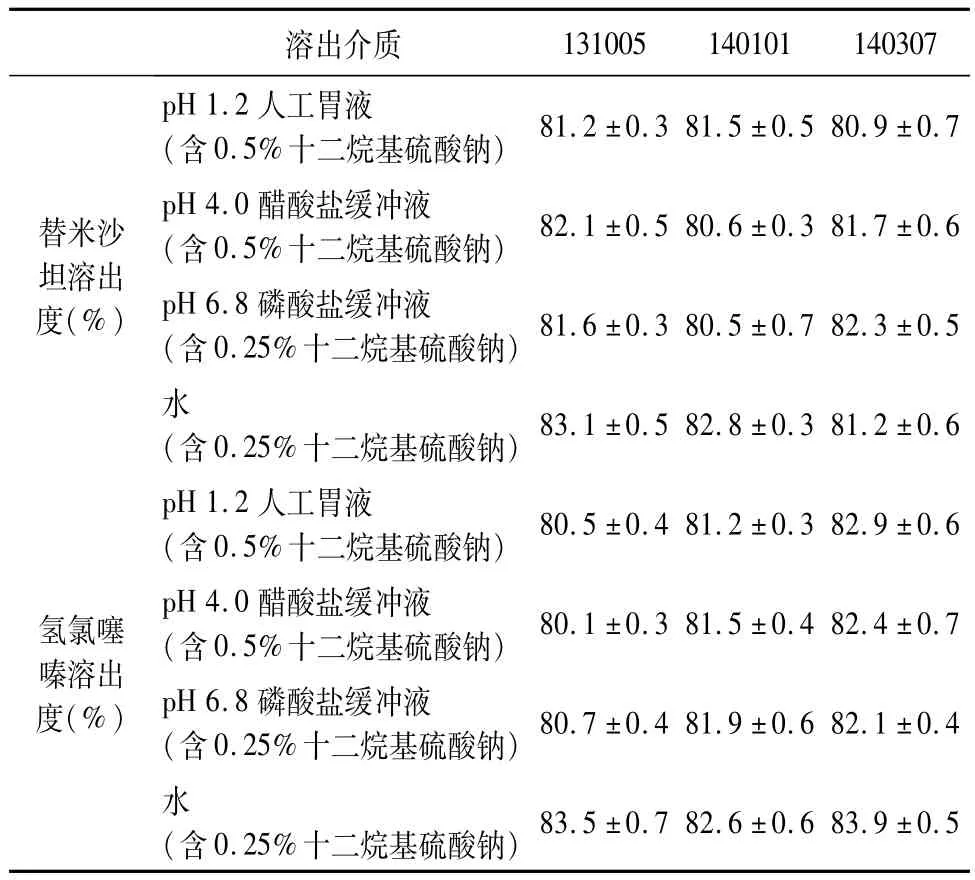
表1 供试品在四种不同的溶出介质中的累计溶出量(%)
2.5.10 两主药成分溶出行为的相似度比较 按“2.5.1”项下色谱条件测定替米沙坦氢氯噻嗪片中替米沙坦、氢氯噻嗪含量,计算两种成分在四种不同介质中的体外溶出度,绘制溶出曲线,如图2~5所示。

图2 两者在pH 1.2介质中的溶出曲线
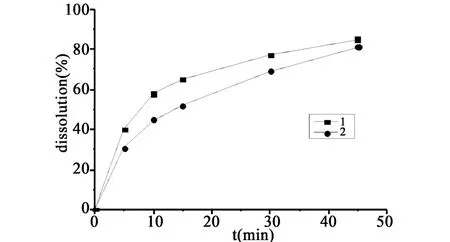
图3 两者在pH 4.0介质中的溶出曲线
采用相似因子(f2)法评价替米沙坦氢氯噻嗪片中替米沙坦、氢氯噻嗪的溶出度差异。f2值在50~100时两种制剂释放度相似,f2值越接近100相似程度越大。
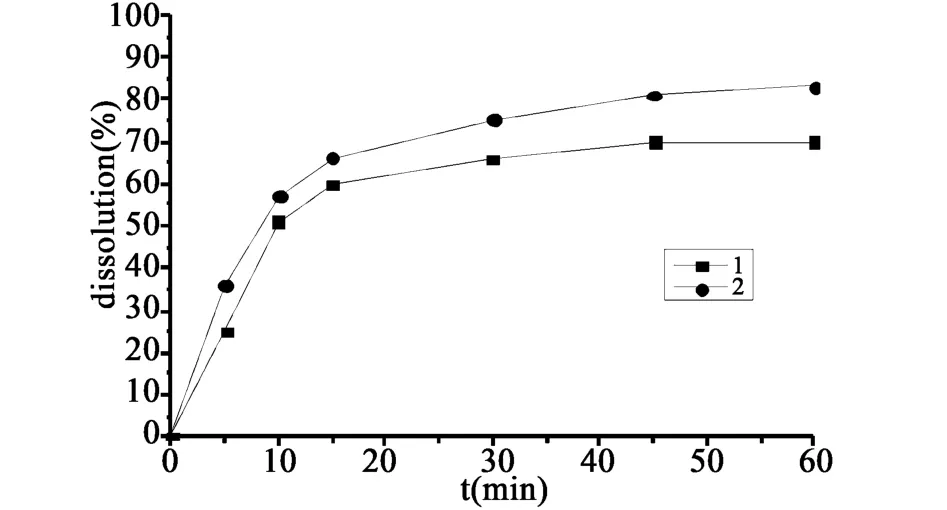
图4 两者在pH 6.8介质中的溶出曲线
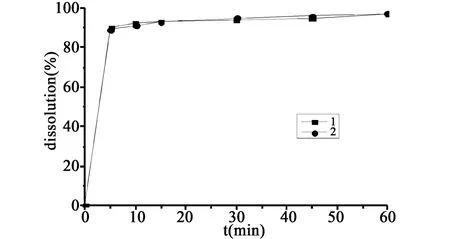
图5 两者在介质水中的溶出曲线
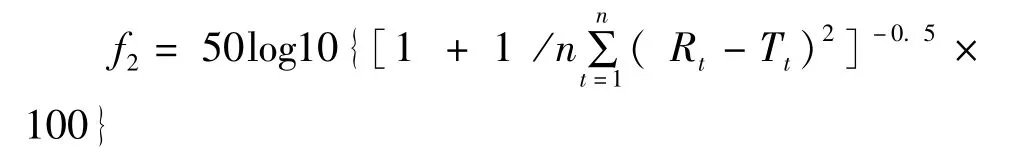
其中Rt为对照制剂t时间的累积释药率,Tt为试验制剂t时间的累积释药率,n为释放度试验的取样次数。结果以替米沙坦为参比,在四种介质(pH 1.2,pH 4.0,pH 6.8,水)中氢氯噻嗪的f2分别为51.27,52.02,52.75和52.83,表明替米沙坦、氢氯噻嗪两种有效成分的溶出具有相似性。
3 讨论
3.1 替米沙坦氢氯噻嗪片为降压类复方制剂,其溶出度测定方法之前虽有报道,但未报道其在四种溶出介质中的溶出情况,且未对其中两主药成分进行过溶出度差异比较分析,本文参照日本《医疗用药品品质情报集》中的溶出度试验条件,并根据替米沙坦氢氯噻嗪片处方成分的理化性质对溶出介质进行选择,分别考察了替米沙坦氢氯噻嗪片在pH 1.2的人工胃液、pH 4.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液及水中的体外溶出行为,采用高效液相色谱法,参考文献中含量测定项下的色谱条件测定替米沙坦氢氯噻嗪片中替米沙坦和氢氯噻嗪的溶出度,两主成分峰与制剂中其他成分峰分离度符合规定;并通过相似因子(f2)法对两主成分的溶出度曲线进行相似性比较,整个方法简单、结果准确,可适用于替米沙坦氢氯噻嗪片的溶出度测定及质量控制。
3.2 本实验开始采用日本《医疗用药品品质情报集》中的溶出度试验条件,转速为100 rpm,考察了替米沙坦氢氯噻嗪片在pH 1.2的人工胃液、pH 4.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液及水中的溶出情况,分别于5、10、15、20、30、45、60 min时取样,研究发现替米沙坦氢氯噻嗪片中的两主成分替米沙坦和氢氯噻嗪的溶出情况均不理想,60 min时的溶出百分率均未超过65%。考虑到替米沙坦和氢氯噻嗪均为亲水性较差的化合物,故实验采取了在溶出介质中加入表面活性剂的方法,结果证明方法可行,可用于控制替米沙坦氢氯噻嗪片的质量。
[1]谢沐风.溶出曲线相似性的评价方法[J].中国医药工业杂志,2009,40(4):308-311.
[2]石巧娟,陈琴华,王佩贤,等.复方替米沙坦胶囊中替米沙坦和氢氯噻嗪的HPLC测定[J].中国医药工业杂志,2005,36(3):165-166.
[3]周卫,温跃兰,丁逸梅,等.复方替米沙坦片在不同介质中的溶出度比较[J].华西药学杂志,2012,27(6):627-630.
[4]王宁馨,施翼麟.HPLC法测定复方替米沙坦片的溶出度[J].江苏药学与临床研究,2005,13(6):23-25.
[5]张锦,龚士学,董晓蓉.环扁桃酯胶囊溶出度测定方法的研究[J].药物分析杂志,2011,31(10):2001-2004.
[6]吴善霞,刘延凤.HPLC法同时测定缬沙坦氢氯噻嗪片中两组分的含量[J].药学研究,2013,32(3):153-154,161.
[7]国家药典委员会.中华人民共和国药典2010年版(二部)[S].北京:中国医药科技出版社,2010:附录85.
Study on dissolution test of Telm isartan and Hydrochlorothiazide Tablets
GUO Yan
(Yancheng Institute for Drug Control,Yancheng 224000,China)
ObjectiveTo study the dissolution behavior of telmisartan and hydrochlorothiazide in Telmisartan and Hydrochlorothiazide Tablets in four differentdissolutionmedia.M ethodsAccording to the dissolution test conditions in Japans"quality ofmedical drugs information set"andmake choice of the dissolutionmedium in accordance with the physicochemical properties of Telmisartan and Hydrochlorothiazide Tablets,different Telmisartan and Hydrochlorothiazide Tablets were inspected in pH 1.2 solution(containing 0.5%twelve sodium dodecyl sulfate),pH 4.0 acetate buffer(containing 0.5%twelve sodium dodecyl sulfate),pH 6.8 phosphate buffer(containing 0.25%twelve sodium dodecyl sulfate)and water(containing 0.25%twelve sodium dodecyl sulfate)by HPLC,and the resemblance of release curves were compared with similarity factors(f2)method.ResultsThe assay displayed a good linearity over the concentration range of 20~50μg· L-1,6~20μg·L-1for telmisartan and hydrochlorothiazide;In 4 different dissolutionmedia,compared with telmisartan,f2of hydrochlorothiazide was greater than 50.ConclusionThemethod was simple,accurate and reproducible for the dissolution determination of this tablet;The dissolution of telmisartan had similar characteristicswith hydrochlorothiazide in Telmisartan and Hydrochlorothiazide Tablets.
Telmisartan and Hydrochlorothiazide Tablets;Dissolution curves;HPLC;Similarity factor
R927.11
A
2095-5375(2014)12-0707-004
郭焱,男,主管药师,研究方向:药品检验,E-mail:7661685@qq.com

