褐牙鲆、夏鲆及其杂交子代核型与DAPI带型分析
隋 娟, 马道远, 肖志忠, 徐世宏, 肖永双,, 武宁宁, 刘清华, 李 军
(1. 中国科学院 海洋研究所, 山东 青岛, 266071; 2. 中国科学院 海洋研究所(南通)海洋科学与技术研究发展中心, 江苏 南通, 226000; 3. 青岛市渔业技术推广站, 山东 青岛, 266071)
褐牙鲆、夏鲆及其杂交子代核型与DAPI带型分析
隋 娟1, 马道远1, 肖志忠1, 徐世宏1, 肖永双1,2, 武宁宁3, 刘清华1, 李 军1
(1. 中国科学院 海洋研究所, 山东 青岛, 266071; 2. 中国科学院 海洋研究所(南通)海洋科学与技术研究发展中心, 江苏 南通, 226000; 3. 青岛市渔业技术推广站, 山东 青岛, 266071)
为了深入剖析褐牙鲆与夏鲆杂交后代的染色体结构, 本研究利用秋水仙素-低渗-空气干燥法制备胚胎染色体和 DAPI (4’, 6’-diamidino-2-phenylindole) 荧光染色的方法, 对褐牙鲆(Paralichthys olivaceus)、夏鲆(Paralichthys dentatus)及其正反交子代胚胎细胞的染色体组型和染色质的分布进行了研究。结果表明, 褐牙鲆、夏鲆及其正交子代(褐牙鲆♀ × 夏鲆♂)染色体组均含有48条端部着丝粒染色体, 染色体组型公式均为2n=48t, 组内染色体长度分布连续, 三者核型相似。反交子代(夏鲆♀ × 褐牙鲆♂)为46条端部着丝粒染色体, 比亲本及正交子代少了两条染色体。DAPI荧光染色显示, 褐牙鲆1号染色体中的一条染色体有较明显的次缢痕, 夏鲆及正反交子代染色体中未见明显次缢痕。褐牙鲆与正交子代染色体着色较为均一, 而夏鲆与反交子代着丝粒区域亮度明显增强。
褐牙鲆(Paralichthys olivaceus); 夏鲆(Paralichthys dentatus); 杂交; 核型; DAPI带型
褐牙鲆(Paralichthys olivaceu)与夏鲆(Paralichthys dentatus)同属于牙鲆科(Paralichthidae)牙鲆属(Paralichthys)。褐牙鲆是优良的海水养殖种之一,在中国、韩国、日本沿海均有大规模养殖。褐牙鲆最适生长温度较低, 夏季养殖水温超过24℃易造成停食和死亡现象, 影响了褐牙鲆养殖业的发展; 夏鲆又称夏牙鲆、大西洋牙鲆、犬齿牙鲆等, 主要分布于北美洲大西洋沿岸, 具有生长快、产量高、肉质好、耐高温等优点。中国2002年引种成功, 但夏鲆最适生长温度较高, 在北方不易越冬[1]。杂交育种技术是新品种开发的有效途径, 也是鱼类抗逆品种选育的有效方法。鉴于两种鱼类经济性状互补,通过远缘杂交有可能筛选出综合双亲优势的后代,为中国牙鲆养殖品种的改良提供新的途径。目前,褐牙鲆和夏鲆杂交后代的受精细胞学[2]、早期发育[3-5]、DNA 遗传特征[6]等方面的研究成果已相继报道。细胞遗传学相关研究也已展开, 结果显示褐牙鲆、夏鲆及其正交子代(褐牙鲆♀ × 夏鲆♂)染色体均为端部着丝粒染色体, 核型为 2n=48t[6], 染色体相对长度[7-8]及褐牙鲆DAPI带型[9]也有相关报道,但至今仍未见夏鲆及正反交子代DAPI带型的相关研究。
核型分析具有直观、形象的优势, 是杂交后代遗传分析的常用方法[10]。带型是对染色体形态结构进行精细分析的研究, 能精确地辨认染色体地结构变化。荧光染料DAPI 可揭示染色体上AT富含的区域, 经 DAPI 等染料染色后染色体上会显示明显不同的深染区和浅染区, 可以特异性地显示不同生物体中异染色质的存在区域[11]。迄今, DAPI带型在大麦(Hordeum vulgareL.)[12]、蕹菜(Ipomoea aquanticaForsk)[13]等植物以及濑鱼(Steindachneridionsp.,Rhamdia quelen)[14]、河豚(Tetraodon fluviatilis)[15]、鳙鱼(Aristichthys nobilis)[16]、栉孔扇贝(Chlamys farreri)[17]等动物染色体研究中进行了相关报道, 在细胞遗传学研究中显示出重要的意义。
本研究拟对褐牙鲆、夏鲆及其杂交子代的染色体组型及 DAPI带型展开研究, 为剖析褐牙鲆与夏鲆及其杂交后代的染色体结构提供细胞遗传学证据, 从而为更合理、有效地开发利用杂种优势奠定基础。
1 材料与方法
1.1 实验材料
实验所用褐牙鲆、夏鲆、正交子代(褐牙鲆♀ ×夏鲆♂, Fo)及反交子代(夏鲆♀ × 褐牙鲆♂, Fr)取自青岛薛家岛养殖场。各组合进行受精后, 取受精率大于 80%的受精卵进行染色体制片。先后3批次取出囊胚、原肠时期的受精卵1000粒, 每批次中再取出优质受精卵100~200粒进行实验。
1.2 实验方法
1.2.1 鱼类胚胎染色体的制备
使用海水配制的 0.02%秋水仙素处理 30 min, 0.075 mol/L KCl进行低渗, 时间1 h。新配制的卡诺固定液(甲醇∶冰醋酸=3∶1)进行固定, 每 15 min更换一次固定液, 共3次, -20℃冰箱中保存。用一次性滴管吸取少许固定好的胚胎放到离心管中, 加50%的醋酸溶液解离细胞20~30 min。由于受精卵卵壳坚韧, 用宽头镊子将卵膜打破, 将胚胎细胞和卵黄挤出, 再用吸管吹吸, 使胚胎细胞充分分散成悬液, 热滴片。空气干燥法干燥后, 用 15%吉姆萨染液染色10 min, 流水冲洗多余的吉姆萨染液后进行镜检, 每种样品计数分裂相100个。
1.2.2 核型分析方法
取有丝分裂中期分裂相, 测量染色体的相对长度, 计算臂比率(长臂/短臂)。染色体的编号及类型的确定按 Levan等[18]报道的方法进行。以字母M表示中部着丝粒染色体, SM表示亚中部染色体, ST为亚端部着丝粒染色体, T为端部染色体。
1.2.3 DAPI荧光染色及观察
在暗室内按每张30 μL DAPI(0.15 μg/mL)滴在镜检过的染色体制片上, 盖上盖玻片, Nicon 50i荧光显微镜观察。
2 结果
2.1 褐牙鲆、夏鲆及正反交子代染色体计数及核型分析
褐牙鲆、夏鲆及正交子代Fo的染色体众数为48,反交子代Fr的染色体众数为46, 与亲本相比, 缺失了两条染色体(表1)。
按 Levan等的标准对褐牙鲆、夏鲆及正交子代的染色体进行排列、编号, 它们的核型公式为 K(2n)= 48t。48条染色体长度分布均匀、形态相似, 彼此很难区别(表2)。

表1 褐牙鲆、夏鲆及正反交子代染色体数目统计结果Tab. 1 Chromosome count results in the P. olivaceus, P. denlalus and their hybrids
2.2 DAPI染色的观察结果
图1~图4显示, 褐牙鲆、夏鲆及其正反交子代的染色体上, 明亮区域主要集中在着丝粒部位, 几乎所有的染色体着丝粒区域显示 DAPI带, 未发现在末端区和中间区。但褐牙鲆与正交鲆在着丝粒区的亮度增强不明显, 而夏鲆与反交鲆的染色体在着丝粒区的亮度有明显增强。
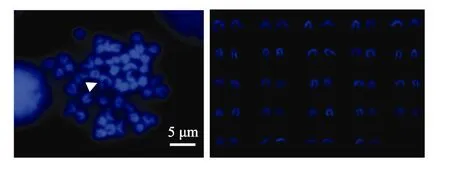
图1 褐牙鲆DAPI带型(箭头所示为1号染色体)Fig. 1 DAPI karyotype of P. olivaceus (Arrow indicates chromosome 1)
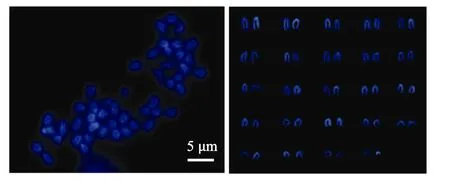
图2 夏鲆DAPI带型Fig. 2 DAPI karyotype of P. dentatus

图3 正交鲆DAPI带型Fig. 3 DAPI karyotype of the original hybrids (P. olivaceus♀× P. dentatus ♂)
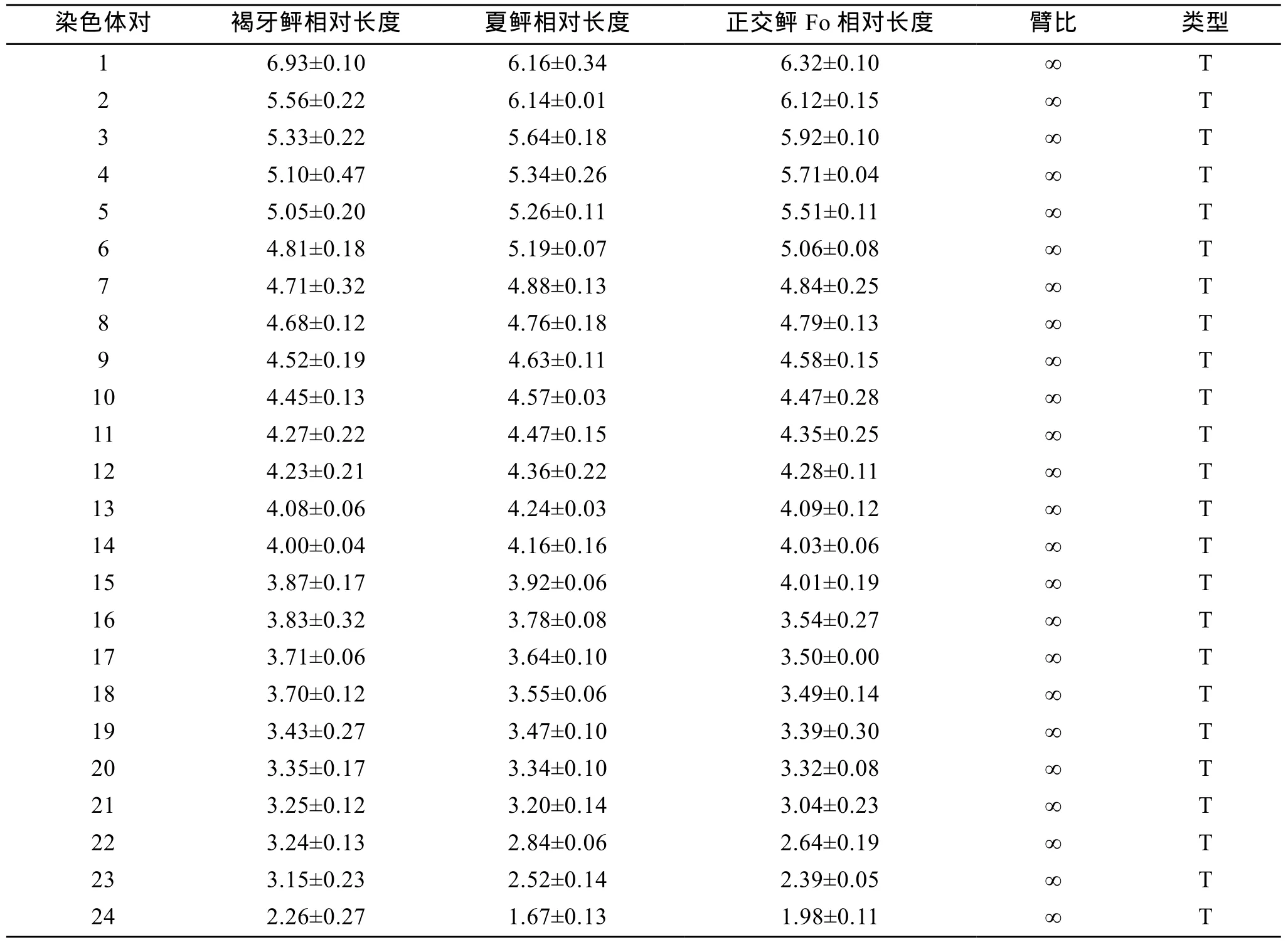
表2 褐牙鲆、夏鲆及正交鲆核型分析结果Tab. 2 Karyotype analysis of P. olivaceus, P. dentatus and the original hybrids of P. olivaceus ♀× P. dentatus♂ (Fo)

图4 反交鲆的DAPI带型Fig. 4 DAPI karyotype of the reciprocal hybrids (P. dentatus♀× P. olivaceus ♂)
3 讨论
3.1 褐牙鲆、夏鲆及正反交子代的染色体组型
关于褐牙鲆染色体数量和组型已有许多研究报道[7-9,19]。Fujiwara等[9]通过不同染色方法发现, 褐牙鲆1号染色体距着丝粒一端1/3处有较明显的次缢痕,本研究只在 1号同源染色体中的一条染色体距着丝粒一端 1/3处发现有较明显的次缢痕, 尚需结合银染、CMA3等染色方法做进一步验证。次缢痕是染色体上的一个缢缩部位, 由于此处部分的 DNA松懈,形成核仁组织区, 故此变细。它的数量、位置和大小是染色体的重要形态特征。
核型类似是近缘物种间能够杂交的基础, 本研究中的褐牙鲆和夏鲆核型均为 2n=48t。如果染色体数目或核型相差太大, 有可能导致精核与卵核融合后染色体不能正常配对进行细胞分裂[20-21]。根据作者的实验结果, 正交组合可以得到活力正常的后代,而反交组合的后代在孵化后脊柱弯曲, 体态异常,几天内便全部死亡。染色体计数分析发现正交的染色体核型为 2n=48t, 与亲本的核型一致; 反交的染色体核型为2n=46t, 相比于亲本丢失了两条染色体。该结果与Xu等[6]的研究结果一致。
鱼类远缘杂交结果比较复杂, 杂交 F1中亲本染
色体可能部分或全部被排除, 也可能同时含有双亲完整基因组。鲢(Hypophthalmichthys molitrix)♀×鲤(Cyprinus carpio) ♂、鲢♀×鲫(Carassius auratus) ♂和鲢♀×白鲫(C. auratus cuvieri)♂的杂种胚胎中都出现染色体丢失的现象, 杂种基本上是非整倍体[22];马苏大麻哈鱼(Oncorhynchus masou)♀×虹鳟(O.mykiss) ♂杂交子代在发育过程中选择性丢失父本染色体[23]; 大黄鱼(Pseudosciaena crocea)♀× (Miichthys miiuy) ♂杂交子代为异精雌核发育个体[24]。许多研究者认为染色体丢失是由于细胞核和细胞质的不相容引起的: 母体卵细胞质控制杂种胚胎基因表达的迟滞或加速。如果卵子的细胞质不能与精子的核 DNA正常协调(不相容), 就会阻滞或加速基因的表达[20-22]。受精细胞学证据显示, 夏鲆卵子与褐牙鲆精子受精后, 精卵原核的融合时间比亲本组合及正交组合有明显的延长, 暗示夏鲆卵子与褐牙鲆精子存在某种程度的不融合现象[2]。由于褐牙鲆、夏鲆及其杂交子代的染色体结构及组型差异不明显, 根据核型以及 DAPI带型分析结果没有找到可以区别两亲本的细胞遗传学标志。要研究反交鲆丢失的染色体为随机丢失还是选择性丢失, 需要采用更精细的分析方法。
3.2 褐牙鲆、夏鲆及正反交子代染色体上异染色质的分布
核型类型的相似性, 反映了褐牙鲆和夏鲆在进化上的趋同性和变异性, 同时也表明细胞水平的核型还是不能充分反映不同的物种的差异, 需要进一步通过带型分析来进行区分。DAPI是一种双链DNA 特异的染料, 与 DNA作用至少有两种不同的机制[25], 在AT碱基对富有区域, DAPI与DNA双链的小沟结合, 其结合量大而发出较强的荧光, 而在GC 富有区域, DAPI则插入双链的碱基之间而产生较弱的荧光或不发荧光, 而富含AT碱基对的区域也就是重复顺序含量高的异染色质区域[26]。作者的实验结果表明, 褐牙鲆、夏鲆及其正反交子代染色体上明亮区域主要集中在着丝粒部位, 除着丝粒区域外,不同染色体的荧光强度无明显差别, 与褐牙鲆[18]及鳙鱼[12]中的DAPI结果类似, 但鳙鱼中第1和第4染色体的短臂上也发现有高亮区域, 可能体现了不同种间染色体结构的差别。
在染色体的观察中作者也发现褐牙鲆与正交鲆在着丝粒区的亮度增强不明显, 而夏鲆与反交鲆的染色体在着丝粒区的亮度有明显增强, 可以推测褐牙鲆与正交鲆染色体着丝粒上富含 AT 碱基对的区域相对可能较少, AT碱基可能是散布的, 而夏鲆与反交鲆染色体着丝粒上富含 AT 碱基对的区域相对可能较多, AT碱基可能是呈簇分布的。褐牙鲆与正交鲆以及夏鲆与反交鲆在 DAPI带型上的相似性具有较强的偏母遗传特征。是否富含AT碱基对的异染色质区域遵守母性遗传仍有待进一步研究验证。
[1] 田永胜, 陈松林, 刘本伟, 等. 大西洋牙鲆冷冻精子×褐牙鲆卵杂交胚胎的发育及胚后发育[J]. 水产学报, 2006, 30(4): 433-443.
[2] Sui J, Ma D Y, Liu Q H, et al. Germ cells and fertilization differences among Japanese flounderParalichthys olivaceus, summer flounderParalichthys dentatusand their first and second generations [J]. J Fish Biol, 2012, 80(3): 473-485.
[3] 于道德, 肖志忠, 徐世宏, 等. 杂交鲆(牙鲆♀×夏鲆♂)胚胎发育的初步观察[J]. 海洋科学, 2007, 31(2): 55-60.
[4] 关键, 柳学周, 蔡文超, 等. 褐牙鲆(♀) × 犬齿牙鲆(♂)杂交子一代胚胎发育及仔稚鱼形态学观察[J]. 中国水产科学, 2007, 14(4): 644-653.
[5] Sui J, Liu Q H, Xiao Z Z, et al. The viability, melanophore and embryo genesis of first- and secondgeneration hybrids betweenParalichthys olivaceusandP. dentatus[J]. Mar Biol Res, 2013, 9(2): 220-226.
[6] Xu D D, You F, Wu Z H, et al. Genetic characterization of asymmetric reciprocal hybridization between the flatfishesParalichthys olivaceusandParalichthys dentatus[J]. Genetica, 2009, 137(2): 151-158.
[7] 刘静. 牙鲆染色体组型的研究[J]. 海洋科学, 1995, 19(2): 65-67.
[8] 尤锋, 徐世宏, 许建和, 徐冬冬, 马道远, 张培军,李军. 夏牙鲆(♂)与牙鲆(♀)人工杂交的细胞遗传学初步研究[J]. 海洋科学, 2006, 30(3): 51-55.
[9] Fujiwara A, Fujiwara M, Nishida-Umehara C, et al. Characterization of Japanese flounder karyotype by chromosome bandings and fluorescencein situhybridization with DNA markers[J]. Genetica, 2007, 131(3): 267-274.
[10] 蔡明夷, 刘贤德, 翁朝红, 等. 大黄鱼与黄姑鱼杂交F1及其双亲的核型分析[J]. 集美大学学报(自然科学版), 2012, 17(5): 321-326.
[11] Belonogova N M, Karamysheva T V. Identification of all pachytene bivalents in the common shrew using DAPI staining of synaptonemal complex spreads[J]. Chromosome Res, 2006, 14(6): 673-679.
[12] Liu J Y, She C W, Hu L Z, et al. A new chromosome fluorescence banding technique combining DAPI staining with image analysis in plants [J]. Chromosoma, 2004, 113(7): 16-21.
[13] 刁英, 陈思. 蕹菜的DAPI显带核型[J] . 氨基酸和生物资源, 2005, 27(1): 32-34.
[14] Ana C S, Alberto S F, Marta M C, et al. Analysis of heterochromatin by combination of C-banding and CMA3 and DAPI staining in two fish species (Pimelodida siluriformes)[J]. Genetica, 2003, 119(1): 87-92.
[15] Mandrioli M, Manicardi G C. Cytogenetic and molecular analysis of the pufferfishTetraodon fluviatilis(Osteichthyes) [J]. Genetica, 2001, 111(1-3): 433-438.
[16] 孔庆亮, 李宗芸, 傅美丽, 等. 鳙鱼染色体的 DAPI核型分析[J]. 四川动物, 2006, 25(1): 64-68.
[17] 徐俊, 包振民, 任晓亮, 等. 栉孔扇贝 DAPI带型和PI带型研究[J]. 中国海洋大学学报, 2011, 41(4): 77-80.
[18] Levan A, Fredga A, Sanderberg A A.Nomenclature for centromeric position on chromosomes [J].Hereditas, 1964, 52(2): 201-220.
[19] 喻子牛, 孔晓瑜, 谢宗墉. 山东近海 21种经济鱼类的核型研究[J]. 中国水产科学, 1995, 2 (2): 1-6.
[20] Arai K. Developmental genetic studies on salmonids: morphogenesis, isozyme phenotypes and chromosomes in hybrid embryos[J]. Mem Fac Fish Hokkaido Univ, 1984, 31: 1-94.
[21] 楼允东, 李小勤. 中国鱼类远缘杂交研究及其在水产养殖上的应用[J]. 中国水产科学, 2006, 13(1): 151-158.
[22] 桂建芳, 梁绍昌. 鱼类远缘杂交正反交杂种胚胎发育差异的细胞遗传学分析[J]. 动物学研究, 1993, 14(2): 171-177.
[23] Fujiwara A, Abe S, Yamaha E, et a1.Uniparental chromosome elimination in the early embryogenesis of the inviable salmonid hybrids between masu salmon and rainbow trout male[J].Chromosoma, 1997, 106(1): 44-52.
[24] 王晓清, 王志勇, 谢中国, 等. 大黄鱼(♀)与 (♂)杂交的遗传分析[J].水产学报, 2008, 32(1): 51-57.
[25] Kapuscinski J. DAPI: a DNA-specific fluorescent probe [J]. Biotech Histochem, 1995, 70 (5): 220-233.
[26] Parolin C, Zanotti G, Palu G. A model for the sequence dependent DNA binding of 4’, 6-diamidino-2-phenylindole (DAPI) [J]. Biochem Bioph Res Co, 1995, 208(1): 332-338.
(本文编辑: 谭雪静)
Karyotypes and DAPI staining ofParalichthys olivaceus,Paralichthys dentatusand their hybrids
SUI Juan1, MA Dao-yuan1, XIAO Zhi-zhong1, XU Shi-hong1, XIAO Yong-shuang1,2, WU Ning-ning3, LIU Qing-hua1, LI Jun1
(1. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Nantong Branch, Institute of Oceanology, Chinese Academy of Sciences, Marine Science and Technology Research and Development Center, Nantong 226000, China; 3. Qingdao Fishery Technique Promotion Station, Qingdao 266071, China )
Aug., 14, 2013
Paralichthys olivaceus;Paralichthys dentatus; hybridization; karyotype; DAPI banding
In order to study the chromosomal structure of the interspecific hybrids betweenP. olivaceusandP. dentatus, the chromosomes were obtained from the embryos ofParalichthys olivaceus,Paralichthys dentatusand their reciprocal crosses were prepared using Colchine-hypotonic-air drying methods and stained with gluorescence dye DAPI (4’, 6’-diamidino-2-phenylindole). The results showed thatP. olivaceus,P. dentatusand the original hybrids (P. olivaceus♀ ×P. dentatus♂, Fo) were consisted of 48 telocentromerie chromosomes and their karyotype formula was 2n= 48t, with continuous length intragenomes and similar karyotype. Two chromosomes were missing in the reciprocal hybrids (P. dentatus♀ ×P. olivaceus♂, Fr). The DAPI banding patterns showed that the distinctive secondary constriction was assigned to one homologue of chromosome 1 inP. olivaceus. The chromosomes were all uniformly stained inP. olivaceusand Fo, except strongly positive staining at the centromere of all chromosomes inP. dentatusand Fr.
S917
A
1000-3096(2014)03-0069-06
10.11759/hykx20130814004
2013-08-14;
2013-11-26
国家鲆鲽类产业技术体系资助项目(nycytx-50); 中国科学院创新项目(KSC2-EW-B-3); 中国科学院重点部署项目(KSCX2-EW-B-14); 山东省科技发展计划资助项目(2011GHY11530); 江苏省自然科学基金资助项目(BK2012222); 青岛市科技计划资助项目(12-4-1-51-hy); 青岛市科技计划基础研究项目(12-1-4-8(6)-jch)
隋娟(1984-), 女, 博士, 主要从事海洋动物遗传育种学研究, E-mail: suijuan0313@126.com; 李军, 通信作者, 研究员, E-mail: junli@ qdio.ac.cn; 刘清华, 通信作者, 副研究员, E-mail: qinghualiu@qdio.ac.cn

