诺丽茎段的离体再生1)
潘晓晴 吴 田 蓝增全 吴腾超 陶燕蓝
(西南林业大学,昆明,650224)
诺丽(Morinda citrifolia Linn.)属巴戟天属茜草科,灌木至小乔木[1],生长于温暖潮湿的热带、亚热带地区,在国外主要分布于美国夏威夷、澳大利亚、印度、印度尼西亚等国,在我国主要生长于云南省西双版纳、海南及台湾南部地区[2-4]。诺丽含有多种必需氨基酸、维生素、微量元素及其他多种生物碱、多醣体、多种酵素等极具医学价值的成分[5-6]。据实验观察,诺丽果汁对于小鼠的血压、血脂的下降具有显著效果。近年来还发现,诺丽果汁对不同原因的肝损伤有肝保护作用[7-8]。
贺红等[9]对同属巴戟天属的药用植物巴戟天做了带腋芽的茎节的离体培养,吴田[10]对诺丽进行过带腋芽的茎段的离体培养,均建立了高效的离体快速繁殖体系。此外,谢江[4]以诺丽的根作为外植体,进行了诺丽的离体再生培养的研究。本研究拟以诺丽不带腋芽的茎段为外植体,进行离体再生研究,为建立诺丽的高效转基因体系与进行基因改良奠定基础。
1 材料与方法
所用材料为西南林业大学园林学院组培室的诺丽无菌试管苗。试管苗每80 d 左右继代一次,所用培养基为3% MS+0.2 mg/L NAA。
1.1 培养基成分与培养条件
基本培养基为3% MS;愈伤组织诱导培养基中添加不同浓度的6-BA 及NAA,并设置质量浓度梯度,为表1中1 ~12 号培养基;分化培养基有2 种,一种为芽分化培养基,分别添加2.0、3.0、4.0 mg/L 6-BA 的3% MS 培养基,另一种为根分化培养基,分别添加0.02、0.05、0.1 mg/L NAA 的3% MS 培养基。所用培养基的pH 值均为5.8,琼脂0.6%,蔗糖3%,121 ℃灭菌20 min。培养条件均为光照1 500 lx、12 h/d、(28 ±2)℃。
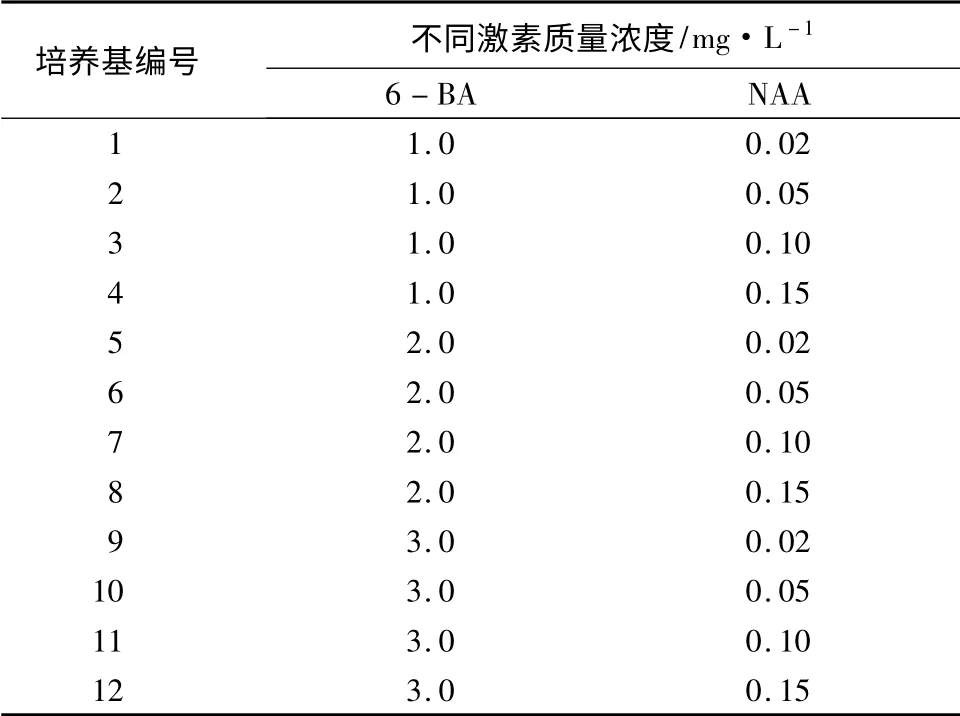
表1 愈伤组织诱导培养基
1.2 茎薄片愈伤组织诱导
将诺丽的无菌苗取出,剪去叶片,留下茎尖以下两节带芽茎段。去除茎段两端腋芽,取茎段中间部分切成1 ~2 mm 的薄片,平放于愈伤组织诱导培养基上(图1),每天观察,做形态及颜色记录。

图1 诺丽茎薄片的切取与摆放
1.3 离体再生
1.3.1 模式Ⅰ:先诱导分化不定芽后诱导分化不定根分别将培养于愈伤组织诱导培养基12、18、24 d的茎薄片转移到芽分化培养基中,45 d 后统计不定芽分化率((出芽的愈伤数/总愈伤数)×100%)。待不定芽生长至1 cm 左右时,从基部切下,置于生根培养基(分别添加0.05、0.1、0.2、0.3 mg/L NAA 的3% MS培养基)中,观察开始生根的时间,并统计30 d 时的生根率((生根的不定芽数/总不定芽数)×100%)。
1.3.2 模式Ⅱ:先诱导分化不定根后诱导分化不定芽分别将培养于愈伤组织诱导培养基12、24、36 d 的茎薄片转移到根分化培养基中,60 d 后统计分化率。
2 结果与分析
2.1 不同激素对茎薄片愈伤组织诱导的影响
茎薄片在不同的愈伤组织培养基中均可以在10 d 左右开始膨大,并陆续出现愈伤组织。当6-BA 的质量浓度为1.0 mg/L,NAA 的质量浓度为0.05 和0.10 mg/L 时(表2),茎薄片能够生出嫩绿色的愈伤组织(图2a),状态较好,而NAA 的质量浓度为0.02 和0.15 mg/L 时,愈伤组织的颜色为黄褐色(图2b),且状态较差;当6-BA 的质量浓度为2.0和3.0 mg/L,NAA 在实验所设置的4 个质量浓度梯度下,茎薄片均生出黄褐色且状态较差的愈伤组织。因此,诱导诺丽茎薄片产生愈伤组织的最优培养基为3% MS+1.0 mg/L 6-BA+0.05 mg/L NAA。
2.2 芽分化培养基中不同质量浓度的6-BA 及愈伤组织幼嫩程度对诱导不定芽的影响
将培养于愈伤组织诱导培养基相同时间(12、18、24 d)的茎薄片转移到芽分化培养基中,当6-BA 的质量浓度为2.0 mg/L 时,第12 天的愈伤组织的不定芽的分化率最低,为33.3%,第24 天的愈伤组织的不定芽的分化率最高,为50%;当6-BA 的质量浓度为3.0 mg/L 时,3 种培养时间的愈伤组织的不定芽的分化率均能达到50%以上,其中,第18天的愈伤组织的不定芽的分化率最高,为55.6%;当6-BA 的质量浓度为4.0 mg/L 时,3 种培养时间的愈伤组织的不定芽的分化率均在50%以下(表3)。能够分化出不定芽的愈伤组织,均能生出1 ~4棵不定芽(图3)。因此,诱导诺丽茎薄片愈伤组织分化不定芽的最适材料为培养18 d 的愈伤组织,最优培养基为3% MS+3.0 mg/L 6-BA。

表2 不同激素种类及质量浓度对茎薄片愈伤组织诱导的影响

表3 6-BA 与愈伤组织的培养时间对愈伤组织分化出不定芽的影响
2.3 NAA 质量浓度对不定芽诱导生根的影响
当不定芽生长至1 cm 以上时,由基部将其剪下,转移至含有的NAA 的生根培养基中,发现当NAA 质量浓度为0.2 mg/L 时,最早生根,为转移至生根培养基中的第17 天,当NAA 质量浓度为0.05和0.3 mg/L 时,生根均较晚;当不定芽转移至NAA质量浓度为0.1 和0.2 mg/L 的生根培养基,第30天时的生根率均为100%(表4)。因此,诱导不定芽生根的最优培养基为3% MS+0.2 mg/L NAA(图4)。

表4 NAA 质量浓度对不定芽诱导生根的影响

图2 诺丽茎薄片诱导出的愈伤组织

图3 愈伤组织诱导分化出的不定芽

图4 不定芽诱导分化出不定根
2.4 根分化培养基中不同质量浓度的NAA 及愈伤组织幼嫩程度对诱导不定根、丛生芽的影响
将培养于愈伤组织诱导培养基相同时间(12、24、36 d)的茎薄片转移到芽分化培养基中,当NAA的质量浓度为0.02 mg/L 时,3 种培养时间的愈伤组织的不定根的分化率均在80.6%以下;当NAA质量浓度为0.05 和0.1 mg/L 时,3 种培养时间的愈伤组织的不定根分化率均能达到80%以上,其中,NAA 质量浓度为0.05 mg/L、第36 天的愈伤组织的不定根分化率最高,为93.8%(表5)。不定根诱导后无须经过更换培养基,一周内均可以出现丛生芽(图5)。因此,诱导诺丽茎薄片的愈伤组织先分化不定根再分化出不定芽途径的最适材料为培养36 d的愈伤组织,最优培养基为3% MS+0.05 mg/L NAA。

表5 NAA 的质量浓度与愈伤组织的培养时间对诱导不定根与产生丛生芽的影响

图5 愈伤组织在根分化培养基中诱导出根与丛生芽
3 结论与讨论
本试验以诺丽不含腋芽的茎段薄片为外植体,建立了两种离体再生模式(模式Ⅰ为先诱导不定芽后诱导不定根;模式Ⅱ为先诱导不定根后诱导不定芽)。用于模式Ⅰ和模式Ⅱ的愈伤组织的诱导时间分别为12、18、24 d 和12、24、36 d,两种模式使用的诱导时间差异较大主要是因为在诱导后续分化时,茎的诱导时间为36 d 时,不定芽的出芽率极低,并且茎的诱导愈伤时间越短,出芽时间越早。在模式Ⅱ中,随着茎的诱导愈伤的时间的增加,根的分化率也相应升高,但是当诱导时间过长时,愈伤组织逐渐变黑死亡。
在模式Ⅱ的再分化模式中,不同的NAA 质量浓度下,愈伤组织的生根能力都比较强,且培养时间越长的愈伤组织的生根率越高,表明在诺丽茎段脱分化的过程中伴随了促进生根的物质产生,配合外源添加的NAA 达到了较好的生根效果。在原培养基中,已经生根的愈伤组织能够继续分化出不定芽,说明根的生出能够促进愈伤组织的再分化能力,可能原因为根能够从培养基中吸取营养物质,或者是根本身能够产生促进分化的化学物质。
在诱导不定芽生根的试验中,当NAA 质量浓度为0.1 和0.2 mg/L 时,能够显著缩短生根时间且能提高生根率,当NAA 质量浓度为0.05 和0.3 mg/L时,开始生根的时间分别为第50 天和第60 天,说明适量质量浓度的NAA 使不定芽的切口处形成微量的愈伤组织保持疏松状态,有利于水分、养分的吸收[11],且有较好的促进生根的作用。
选取诺丽的茎的薄切片为外植体,一节不带腋芽的茎段就能够提供若干份培养材料,这在实际生产中能够大量的节约生产材料。在取外植体时,一般仅剪取诺丽植株枝条的前两节幼嫩茎段,对植株的生长无迫害作用,反而能够促使母株抽出更多的枝条。
组织培养褐变是酚类物质被氧化产生深色物质的结果[12],这些物质会对外植体材料产生毒害作用,使之死亡[13]。植物组培试验中,不同激素的共同作用,会对外植体的生长、分化产生显著的调节作用,使用了合适的激素组合时,能够抑制外植体的褐化,并且能够促使外植体进一步的生长、分化。在培养基中加入生长调节物质可以改变和影响外植体的内源激素水平,从而导致外植体在附加不同植物生长调节剂的培养基中进行离体培养时,不定芽的诱导频率差异很大[14]。适当添加外源激素可以提高诺丽离体再生的频率进而节省培养时间[10]。本试验中,使用了相对廉价的6-BA 和NAA,这在实际大规模生产中能够大量节省生产成本。
在模式Ⅰ里,愈伤组织的质地较紧实,颜色为嫩绿色,很多研究表明,结构致密的绿色或浅绿色愈伤组织的分化潜力大[15-17],不定芽从茎薄片愈伤的边缘和中间位置均有生出。在模式Ⅱ里,诱导不同时间的愈伤组织接入诱导生根的培养基中后,能够迅速的分化出新的黄色的愈伤组织,进而分化出不定根和丛生芽。使用这两种模式产生离体再生植株各有特点,模式Ⅰ产生单株再生苗的速度要快于模式Ⅱ,而模式Ⅱ由于能够产生丛生芽,因此能够一次收获若干株再生苗。在实际生产生活中可以根据需要选择相应的再生模式。
[1] 中国科学院中国植物志编辑委员会.中国植物志:71 卷[M].北京:科学出版社,1999.
[2] 黄骐,何文锦,叶冰莹,等.诺丽(Morinda citrifolia L.)离体快速繁殖研究[J].福建师范大学学报:自然科学版,2007,23(1):87-90.
[3] 中国科学院植物研究所.中国高等植物图鉴:第4 册[M].北京:科学出版社,1975.
[4] 谢江,吴田,张婷婷,等.海滨木巴戟愈伤组织诱导及植株再生[J].江苏农业科学,2012,40(6):47-48,130.
[5] 许国平,张春妮.诺丽作用机制的研究进展[J].医学研究生学报,2007,20(9):974-977.
[6] 李法营,蓝增全,刘昌芬,等.诺丽研究进展(一):国内外研究进展[J].安徽农业科学,2009,37(32):15819-15821.
[7] 谢文利,朱江,晋玉章.诺丽果汁对D-半乳糖胺致肝损伤的保护作用[J].食品研究与开发,2008,29(9):17-19.
[8] 刘印忠,马德禄,高建华,等.诺丽果汁对四氯化碳引起肝损伤小鼠的肝保护作用[J].天津药学,2008,20(2):6-8.
[9] 贺红,肖省娥,冼建春,等.巴戟天离体培养及植株再生的研究[J].广州中医药大学学报,2000,17(4):353-354.
[10] 吴田,蓝增全.诺丽离体培养研究[J].山东农业大学学报,2011,42(2):179-182.
[11] 朱丽华,吴小芹,戴培培,等.赤松离体培养植株再生体系的建立[J].南京林业大学学报:自然科学版,2010,34(2):11-14.
[12] 姚洪军,罗晓芳,田砚亭.植物组织培养外植体褐变的研究进展[J].北京林业大学学报,1999,21(3):78-84.
[13] 董建华.几种热带水果的褐变与PPO[J].热带作物研究,1990(2):92-99.
[14] 蒋刚强,曾幼玲,张富春.灰绿藜幼嫩花序的组织培养及植株再生[J].武汉植物学研究,2007,25(4):413-416.
[15] 尚旭岚,徐锡增,方升佐.青钱柳离体胚的培养及快速繁殖[J].南京林业大学学报:自然科学版,2007,31(1):101-105.
[16] 康冰,王关平,张小红,等.欧美黑杨离体再生途径及影响因子的研究[J].西北植物学报,2004,24(12):2355-2358.
[17] 田敏,韩凝,边红武,等.草莓愈伤组织再生能力与活性氧代谢水平相关性研究[J].园艺学报,2004,31(3):372-374.

