芽变毛白杨插穗不定根发生的差异蛋白1)
周广麒 陆 晨 金 华 姜国斌 邹吉祥
(大连工业大学,大连,116034) (大连民族学院)
毛白杨(Populus tomentosa carr)是我国优良的速生树种之一,具有生长快、树干通直挺拔、冠形美等特点,是优良的绿化造林树种。但是毛白杨硬枝扦插不易生根,造成其育苗费时费力、成苗率低[1],一直是林业生产上急需解决的关键问题。芽变毛白杨(Populus tomentosa carr)是在毛白杨硬枝扦插过程中发现的一变异单株,其扦插生根容易,成活率高[2],研究其插穗不定根发生分子机理,对解决毛白杨扦插生根问题、缩短育种周期、改良遗传品质、推动毛白杨这一优良树种在林业生产中的应用具有重要意义。
突变体芽变毛白杨的获得,不仅用于杨树育种和硬枝扦插生根的研究,也为直接研究其不定根发生的分子机理提供了宝贵的材料。蛋白质组学技术是研究突变体和野生型之间差异性的强有力工具。Yang 等[3]以2,4-D 处理水稻,研究生长激素对水稻不定根发育的影响,认为高丰度的EF-1beta’蛋白对水稻不定根的形成和发育有着重要的影响。Sorin[4]在研究拟南芥突变体时,采用双向电泳技术找到了11 种与不定根原基数量相关的蛋白质。刘颖丽[5]对核桃成熟子叶不定根发生过程中的相关蛋白质进行了鉴定,发现在不定根分化期有44 个蛋白质上调表达,45 个蛋白质下调表达,108 个蛋白质基本不变。韩华[6]以杂种落叶松插穗茎段为研究材料,采用蛋白质组学相关技术,分析探讨了不同无性系不定根发生过程中表达的蛋白质,共鉴定了75个差异表达蛋白。刘桂丰等[7]利用双向电泳技术和质谱技术,对黑林1 号杨组培叶片不定根发生诱导阶段和根原基形成阶段的蛋白进行分析,推测环氧化物水解酶ATsEH 和RNA 依赖型RNA 聚合酶SDE1 可能与黑林1 号杨组培叶片不定根原基形成和分化有关。本文以突变体芽变毛白杨和野生型毛白杨为研究材料,利用荧光双向电泳技术和质谱技术,寻找与芽变毛白杨插穗不定根形成有关的蛋白质,探讨这些蛋白在芽变毛白杨不定根发生过程中表达水平的变化规律,以及在不定根形成和发育中的功能和作用,为培育出更多的易生根优良毛白杨奠定理论基础。
1 材料与方法
植物材料:芽变毛白杨和野生型毛白杨均采自大连大学。
主要试剂:尿素(Urea)、硫脲(Thiourea)、Tris 碱(Tris-Base)、十二烷基磺酸钠(SDS)、二硫苏糖醇(DTT)、碘乙酰胺(IAA)、固定相pH 干胶条(24 cm,pH值为3 ~11)、IPG 缓冲液(pH 值为3 ~11)、2D Clean-Up Kit、2D-Quant Kit、CyDye DIGE Fluor minimal labeling Kit 均购自GE Healthcare 公司,二甲基甲酰胺(DMF)、赖氨酸(L-lysine)购自Sigma-Aldrich 公司。
主要仪器:EttanTM等电聚焦电泳仪、EttanTM垂直板电泳仪、MultiTemP III 温控循环水浴系统、Typhoon 9400 多功能荧光扫描系统、Image Quant 图像分析软件、DeCyder 凝胶分析软件均为GE Healthcare 公司产品,4800 MALDI- TOF/TOF 质谱仪为Applied Biosystem 公司产品。
1.1 插穗处理
将4月份生长于室外的芽变毛白杨(突变体)和毛白杨(野生型)1年生枝条(粗细相近、长势一致)由基部开始剪成18 cm 的插穗[8],分3 种扦插处理。
A 组突变体诱导生根:将芽变毛白杨插穗插入培养床中,置于光照培养箱中培养,白天18 ℃,晚上12 ℃,光照12 h/d,相对湿度维持在85%左右,诱导插穗生根。
B 组突变体抑制生根:将芽变毛白杨插穗插入培养床中,置于冰箱中4 ℃培养1 ~3 d,然后置于光照培养箱中继续培养(消除低温胁迫的生理影响),其他同A 组。
C 组野生型诱导生根:将野生型毛白杨插穗插入培养床中,其他同A 组。
1.2 蛋白样品制备
采用三氯乙酸—丙酮沉淀法提取插穗蛋白:切取插穗培养12 d 后插穗下端0 ~3 cm 处(木质部以外)的皮部,在液氮中充分研磨成粉末,加入样品3倍体积的提取液(含10%三氯乙酸的丙酮溶液),混匀后在-20 ℃的条件下充分沉淀,分装于1.5 mL离心管中,4 ℃,15 000 r/min 离心30 min,弃去上清液,沉淀重悬浮于等体积的-20 ℃预冷的丙酮中,4 ℃,15 000 r/min 离心30 min,弃去上清液,重复洗涤离心,沉淀物真空干燥后,向蛋白干粉中加入500 μL 蛋白裂解液(7 mol/L 尿素,2 mol/L 硫脲,4% CHAPS,40 mmol/L Tris-Base),在室温下超声5 min,再4 ℃,15 000 r/min 离心15 min,取上清液至新的1.5 mL 离心管中,利用2D Clean-up Kit 纯化蛋白,利用2D-Quant Kit 进行蛋白定量。
1.3 荧光标记
蛋白样品分别使用3 种荧光染料Cy3、Cy5 和Cy2进行标记,按照CyDye DIGE Fluor minimal labeling Kit使用说明进行操作:分别取50 μg A 组、B 组、C 组和内标样品(内标样品为所有样品的等量混合物,见表1),加入1 μL 染料工作液,避光、置于冰上30 min,加入1 μL 10 mmol/L 赖氨酸进行淬灭标记反应,避光、置冰上10 min。荧光标记后的样品在-80 ℃条件下保存。

表1 2D-DIGE 实验设计
1.4 双向电泳和图像扫描
将用Cy2、Cy3 和Cy5 标记的样品混合后,加入等体积的2 ×sample buffer(2 mol/L Thiourea,7 mol/L Urea,2% pH 值为3 ~10 PharmalyteTMfor IEF,2%DTT,4% CHAPS),避光、冰上放置10 min。加入水化液(8M Urea,2% CHAPS,0.5% pH 值为3 ~11 PharmalyteTMfor IEF,0.002%溴酚蓝,1% DTT)至450 μL,混匀。将上述溶液加入Holder 中,小心置入pH 值为3 ~11、24 cm 胶条,上面覆盖一层覆盖油。IPG phor 设置参数如下:30 V、12 h;100 V、1 h;1 000 V、1 h;梯度升至8 000 V、2 h;8 000 V、2 h;500 V、终止。等点聚焦结束后的胶条先加入10 mL含1% DTT 的SDS 平衡液平衡15 min,再用10 mL含2.5%碘乙酰胺的SDS 平衡液平衡15 min,平衡后置于浓度为12.5%的SDS-PAGE 凝胶上方,再用含有少量溴酚蓝的琼脂糖溶液封胶,放入EttanTM垂直板电泳仪中电泳。电泳条件:每胶条3 W,45 min;每胶条17 W,至溴酚蓝到达凝胶底部时停止电泳。用Typhoon9400 荧光扫描仪扫描分析胶,所得图像用DeCyder 凝胶分析软件进行分析。
1.5 胶内酶解和质谱鉴定
制备胶用考马斯亮蓝染色,将制备胶和分析胶进行匹配,挖取差异蛋白点,经胶内酶解后,采用4800 MALDI-TOF/TOF 型号质谱仪进行蛋白质鉴定,应用MASCOT 软件对获得的质谱数据进行搜索,搜索数据库为Swiss Prot 或NCBInr 数据库。
2 结果与分析
2.1 荧光扫描
CyDyes 染料标记芽变毛白杨诱导生根组(A组)、芽变毛白杨抑制生根组(B 组)和野生型毛白杨诱导生根组(C 组)的插穗蛋白,分别用不同波长的激光对Cy2(488 nm)、Cy3(532 nm)、Cy5(633 nm)进行扫描,荧光图谱如图1所示。荧光图谱显示蛋白点独立清晰,质量较高。大部分蛋白点分布在分子质量20 ~110 ku、pH 值为4 ~10。
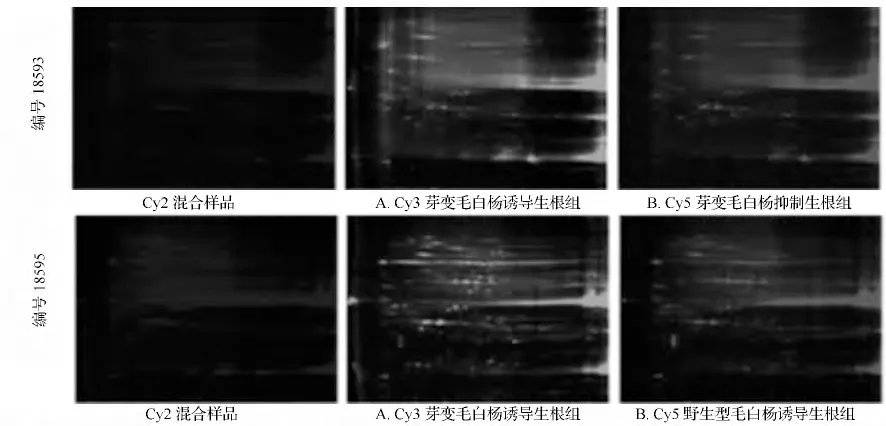
图1 双向差异凝胶电泳图谱
2.2 差异蛋白
采用DeCyder 软件的DIA 模块对芽变毛白杨抑制生根组(B 组)和诱导生根组(A 组),以及野生型毛白杨诱导生根组(C 组)和芽变毛白杨诱导生根组(A 组)进行胶内差异分析,在Gel 18593 中检测到2368 个蛋白点,在Gel 18595 中检测到1845 个蛋白点。通过背景消除、斑点检测、胶内匹配,分别以Cy5 标记的芽变毛白杨抑制生根组(B 组)和野生型毛白杨诱导生根组(C 组)作为Master 胶,计算胶中每个蛋白质点的相对表达量,共筛选出具有生物统计学意义(t 检验P <0.05 和相对表达量>1.5 倍)的差异蛋白点14 个(如图2)。由图2可知,对比芽变毛白杨抑制生根组(B 组)和诱导生根组(A 组),筛选出5 个差异蛋白点,其中2 个为下调蛋白,3 个为上调蛋白。而对比野生型毛白杨诱导生根组(C组)和芽变毛白杨诱导生根组(A 组),筛选出10 个差异蛋白点,其中2 个为下调蛋白,8 个为上调蛋白(如图3)。
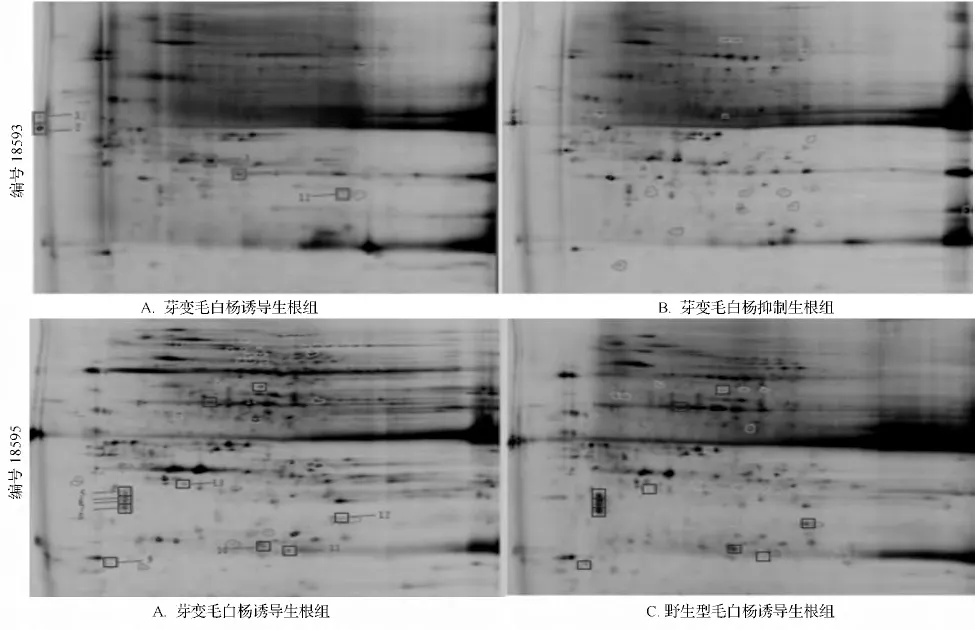
图2 差异蛋白表达图谱

图3 部分差异蛋白点的三维图谱
2.3 质谱鉴定
从制备胶上挖取14 个差异蛋白点,经胶内酶解和质谱鉴定,获得了14 张肽质量指纹图谱(如图4蛋白点3 的肽质量指纹图谱),通过MASCOT 搜索引擎检索14 个差异蛋白点,获得质谱检测报告(如表2蛋白点3 的质谱检测报告)。在NCBI 数据库上搜索上述蛋白的名称和功能,蛋白点2 是树皮贮藏蛋白,蛋白点3 是叶绿素a/b 结合蛋白,蛋白点9是60S 酸性核糖体蛋白P2(如表3和表4)。
3 结论与讨论
插穗不定根的发生与许多内外因素有关,采用蛋白质组学技术可以找到与不定根发生相关的蛋白质[9],进而分析蛋白质在不定根形成过程中的作用机制。比较芽变毛白杨抑制生根和诱导生根过程中的差异蛋白,以及毛白杨(野生型)和芽变毛白杨(突变体)诱导生根过程中的差异蛋白,认为芽变毛白杨插穗不定根的发生可能与如下几类蛋白有关。

表2 蛋白点3 的质谱报告结果

图4 蛋白点3 的肽质量指纹图谱

表3 芽变毛白杨抑制生根组(B 组)和诱导生根组(A 组)对比后的差异蛋白

表4 野生型毛白杨诱导生根组(C 组)和芽变毛白杨诱导生根组(A 组)对比后的差异蛋白
树皮贮藏蛋白,Sauter 等[10]发现在杨树的韧皮部薄壁组织和木射线中一种树皮贮藏蛋白(Bark Storage Protein ,BSP),是落叶树中与种子储藏蛋白类似的氮素储藏蛋白质。蒋浩等[11]认为,叶中蛋白分解为氨基酸转运到树皮中合成贮藏蛋白,再分解成氨基酸转运到新芽中。扦插生根需要一定的营养物质,主要利用贮藏在插穗中碳氮化合物,插穗生根与碳氮化合物的比率w(C)∶ w(N)有关,一般的木本嫩枝扦插,w(C)∶ w(N)比越高,生根率越高。在芽变毛白杨生根过程中,树皮贮藏蛋白持续下调表达,增大了碳氮化合物的比率,提高了生根率。
叶绿素a/b 结合蛋白,与色素结合形成色素蛋白复合体,能迅速将光能传递到光系统I 和II 的反应中心,引起光化学反应,是光合系统中重要的功能蛋白[12]。叶绿素a/b 结合蛋白持续上调表达,推测它的表达与不定根的分化形成有着密切关系,光合作用可能影响芽变毛白杨插穗不定根的发生和形成,有进一步研究的价值。
本试验发现蛋白点6 是与转录因子HY-5 相近的蛋白质。在HY-5 突变体幼苗中,形成的侧生根数目明显增多,并且形成速度较快,表明在HY-5 突变体幼苗中生长素的合成量不断增加[13-14]。HY-5 是隐花色素和细胞分裂素信号传递途径的集中点[15],能结合生长素途径、乙烯途径和赤霉素途径的很多靶基因[16]。转录因子HY-5 同源蛋白显著上调表达,说明激素信号传递可能影响芽变毛白杨插穗不定根的发生。此外,鉴定出蛋白点1 与WD- repeat 蛋白相近。WD-repeat 蛋白不仅参与信号传导、转录调控、细胞增殖等过程,而且在分生组织形成、幼苗发育、光信号传递和感知等方面具有重要的作用[17-18]。
60S 酸性核糖体蛋白P2,亦称为酸性核糖体蛋白[19],与酸性核糖体磷酸化蛋白P0、P1 共同组成一个独特的向外侧凸出的五聚体复合物核糖体茎区,与核糖体28SrRNA 的一个保守结构域共同形成一个GTPase 相关位点,并在蛋白质翻译延伸过程中起重要的作用[20]。本试验中60S 酸性核糖体蛋白P2显著上调表达,该蛋白可能参与或影响某些生根相关蛋白的合成。
在试验过程中还鉴定出很多未知功能的蛋白,通过相关蛋白数据库检索发现这些蛋白与大麦、拟南芥、毛果杨和云杉等有关,但是这些蛋白如何在芽变毛白杨生根过程中发挥作用,目前还尚不清楚,因此对这些蛋白的研究有助于进一步认识芽变毛白杨插穗不定根发生的机理。
[1] 于亚军,尚敏克,侯义龙,等.芽变毛白杨及其亲缘种扦插生根相关内源酶活性特征分析[J].辽宁林业科技,2005(6):4-6.
[2] 崔俊茹,左永忠,陈书明,等.毛白杨易生根芽变品种苗期生长与解剖观察[J].河北林果研究,2001,16(3):211-215.
[3] Yang Guangxiao,Inoue A,Takasaki H,et al.A proteomic approach to analyze auxin and zinc-responsive protein in rice[J].Journal of Proteome Research,2005,4(2):456-463.
[4] Sorin C,Negroni L,Balliau T,et al.Proteomic analysis of different mutant genotypes of Arabidopsis led to the identification of 11 proteins correlating with adventitious root development[J].Plant Physiology,2006,140(1):349-364.
[5] 刘颖丽.核桃不定根发生蛋白质组学研究[D].保定:河北农业大学,2005.
[6] 韩华.杂种落叶松扦插不定根发育过程中差异表达蛋白分析及功能探讨[D].北京:中国林业科学研究院,2010.
[7] 刘桂丰,冯昕,董京祥,等.黑林1 号杨组培叶片不定根发生相关蛋白质的肽质量指纹分析[J].东北林业大学学报,2005,33(2):1-3.
[8] 左永忠,李帅英,李坤霞,等.芽变毛白杨生根相关基因片段的克隆与序列分析[J].生物技术,2008,18(1):1-3.
[9] 甄艳,许淑萍,赵振洲,等.2D-DIGE 蛋白质组技术体系及其在植物研究中的应用[J].分子植物育种,2008,6(2):405-412.
[10] Ruckle M E,Larkin R M.Plastid signals that affect photomorphogenesis in Arabidopsis thaliana are dependent on genomes uncoupled and crypto chrome[J].New Phytol,2009,182(2):367-379.
[11] 蒋浩,秦红敏,田颖川,等.杨树皮储藏蛋白基因启动子的克隆和功能研究[J].林业科学,1999,35(5):46-50.
[12] 李雪平,彭镇华,高志民,等.绿竹光系统Ⅰ捕光叶绿素a/b结合蛋白基因的cDNA 全长克隆及分析[J].安徽农业大学学报,2010,37(4):643-648.
[13] Cluis C P,Mouchel C F,Hardtke C S.The Arabidopsis transcription factor HY5 integrates light and hormone signaling pathways[J].The Plant Journal,2004,46(2):332-347.
[14] 张荔,周波,李玉花.植物HY5 蛋白结构与功能的研究进展[J].植物生理学通讯,2010,46(10):985-990.
[15] Vanden B C,Habrico T Y,Condiff A S,et al.HY5 is a point of convergence between cryptochrome and cytokinin signalling pathways in Arabidopsis thaliana[J].The Plant Journal,2007,49(3):428-441.
[16] Lee J,He Kun,Stolc V,et al.Analysis of transcription factor HY5 genomic binding sites revealed its hierarchical role in light regulation of development[J].The Plant Cell,2007,19(3):731-749.
[17] LI D,Roberts R.D-repeat proteins:structure characteristics,biological function,and their involvement in human diseases[J].Cellular and Molecular Life Sciences,2001,58(14):2085-2097.
[18] 段红英,丁笑生.植物WD-repeat 蛋白的研究进展[J].河南农业科学,2007(5):11-13.
[19] Wahl M C,Moller W.Structure and function of the acidic ribosomal stalk proteins[J].Current Protein Peptide Science,2002,3(1):93-106.
[20] 吴海燕,唐圣松.酸性核糖体磷酸化蛋白P(0-2)的研究进展[J].南华大学学报:医学版,2006,34(5):634-637.

