基于醇胺吸收法的烟气脱碳特性研究
林晓巍,陈鸿伟,何骏鹏,李 航,周 乐
(1.华北电力大学,河北保定071000;2.哈尔滨理工大学,哈尔滨150080;3.电能(烟台)核电技术有限公司,山东烟台264000)
目前,温室效应导致的全球气候的极端变化对人类造成了极大的危害[1],其主要原因是温室气体CO2的大量排放。而火力发电厂CO2排放量约占全球主要温室气体CO2总排放量的30%,所以需要研究合适的捕集工艺捕集烟气中的CO2。由于醇胺吸收法脱碳存在缺陷(如吸收速率快的伯胺和仲胺,吸收容量很小,且再生消耗的能量高,对设备和管道的腐蚀性比较强等),对CO2不能达到最佳的吸收和解析效果[2]。因此,本文在现有化学吸收法的基础上,选择MEA、MDEA及MEA+MDEA混合胺作为吸收剂,研究不同配方的醇胺溶液对CO2吸收效果的影响;改进了传统的胺法捕集工艺,减小再生能耗,降低了胺法捕集工艺的捕集成本,为CO2的资源化利用提供了便利。
1 实验装置和分析方法
1.1 试验装置
实验材料为纯度99.9%的CO2和N2气体(保定北方气体公司生产)以及纯试剂一乙醇胺和甲基二乙醇胺(天津科密欧化学试剂公司生产),还有自制的蒸馏水。
实验压力为1个大气压,溶液总体积为250 mL。实验装置如图1所示。
本实验采用模拟烟气进行反应,用一个圆柱形玻璃瓶模拟真实反应器,内部放有反应试剂,上部有一根细管通入液面以下,混合气体通过这根细管与试剂鼓泡接触,以进一步发生反应。
打开减压阀,从氮气和二氧化碳气瓶中释放出气体,由转子流量计测定并控制各自的流量,通入混合瓶混合后进入反应容器;反应容器的温度由电磁搅拌水浴锅保持,从反应容器出来的气体再经过一个流量计测定总流量,经过干燥后进入气体分析仪测定其中的二氧化碳含量。
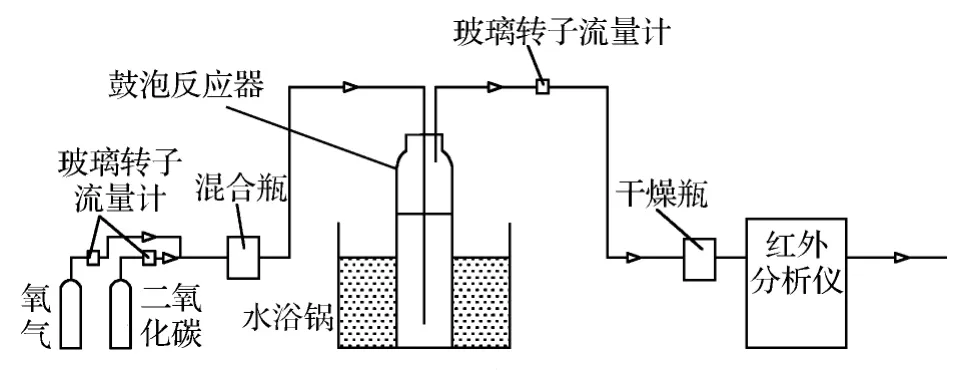
图1 醇胺吸收法捕集CO2实验装置Fig.1 CO2capture experiment device of alcohol amine absorption method
1.2 分析方法
实验中出口的二氧化碳含量由红外线二氧化碳分析仪测量。反应器内先放入的是蒸馏水,不吸收CO2,调节流量计使气体总流量为460 mL/min,CO2和N2的体积分数分别为15%和85%左右。待流量计和分析仪读数稳定后,将蒸馏水换成调配好的化学溶液,进行反应。读数间隔为1次/5min。反应器进出口CO2的比例差乘以其总流量就是溶液对CO2的吸收速率。
假设a为混合气体中初始二氧化碳百分含量,b为分析仪测出的二氧化碳百分含量,V1为进口气体平均流量,V2为出口气体平均流量,则二氧化碳吸收速率V计算公式为V=(V1×a-V2×b)/100。
2 单组分醇胺对CO2吸收影响
2.1 MEA浓度对CO2吸收影响
早期,工业使用MEA作为吸收剂对CO2进行脱除,其特点是化学反应活性好,能将原料气体中的H2S和CO2一起脱除。MEA溶液的缺点是在工业流程中易发泡,长期使用后会降解变质。同时,MEA的再生温度相对较高(约125℃),会导致再生系统的腐蚀比较严重,故工业中MEA溶液的质量含量一般是15%,最高也不超过20%;且溶液的吸收负荷也仅能达到 0.3 ~0.4 mol[3]。
分别取 0.5 mol/L、1.0 mol/L、1.5 mol/L 和2.0 mol/L浓度的MEA溶液250 mL放置于反应器中,反应温度都是25℃,反应压力为大气压,入口CO2体积含量是15%,气体总流量是460 mL/min,测得不同浓度的吸收曲线如图2所示。
由图2中曲线可知,不同浓度的MEA溶液的吸收速率都能迅速达到最大值。而且在5 min后,吸收速率都能迅速降低并逐渐趋于稳定,期间反应中间时刻吸收速率下降最快,反应速率最小和最大的时候下降速率最慢。同时MEA的初始浓度越高,相应的吸收速率也越快。
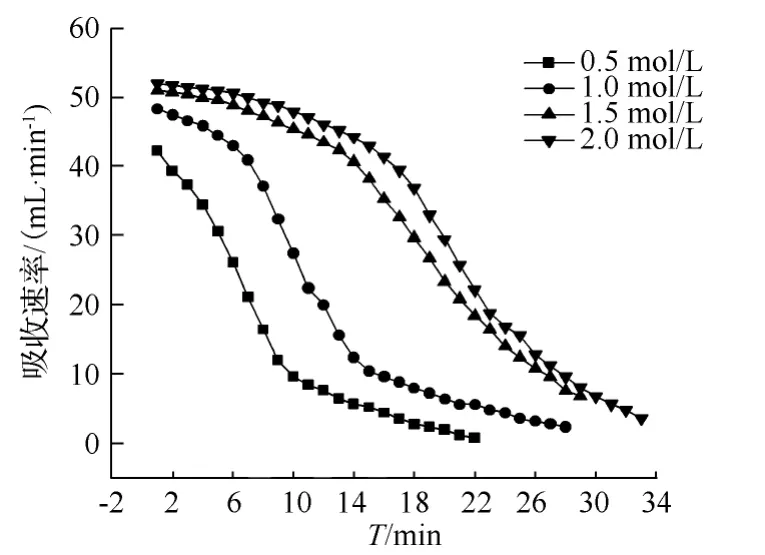
图2 MEA浓度对CO2的吸收速率影响Fig.2 MEA concentration effect on CO2absorption rate
吸收速率随时间的变化反映了溶液中吸收过程的变化。吸收反应刚开始,溶液中MEA直接与CO2反应,吸收速率较快;随着反应的继续和MEA的消耗,MEA有效浓度降低,吸收速率也随之迅速下降。随着反应的继续进行,溶液中的MEA大部分都已经与CO2反应完毕,此时溶液中反应以物理吸收为主,化学吸收只占很小的比例,所以吸收速率较慢,且吸收速率变化也趋于十分平缓。由此,从实验结果分析可知,溶液中MEA浓度越大,对CO2的吸收量越大,吸收效果越好。
2.2MDEA浓度对CO2吸收影响
分别取 0.5 mol/L、1.0 mol/L、1.5 mol/L 和2.0 mol/L浓度的MDEA溶液250 mL放置于反应器中,反应温度都是25℃,反应压力为大气压,入口CO2体积含量是15%,入口气体总流量是460 mL/min,测得不同浓度的吸收曲线如图 3所示。
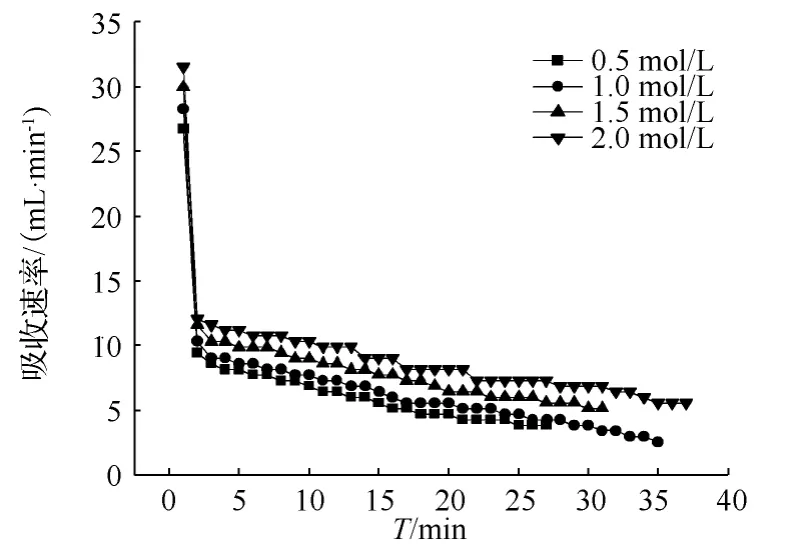
由于MDEA溶液与CO2的反应,既包含化学反应又有物理反应,但总体上以物理吸收为主[4],故其与CO2的反应相当于MDEA催化水解反应。因而MDEA同CO2的反应速率比较低,吸收速率变化也很缓慢。由图3可知,在实验的浓度范围内,MDEA的浓度越高,对CO2的初始吸收速率越大。吸收速率随着时间的进行逐渐降低。
3 混合试剂对CO2吸收的研究
3.1 混合溶液中MDEA浓度对CO2吸收影响
溶液总体积为 250 mL,MEA的浓度都是0.4 mol/L,MDEA 的 浓 度 分 别 是 0.5 mol/L、1 mol/L、1.5 mol/L、2 mol/L,反应温度都是 25 ℃,反应压力为大气压,入口CO2体积含量为15%,实验系统入口气体总流量为460 mL/min。实验结果如图4所示。

图4 混合溶液中MDEA浓度对CO2吸收影响Fig.4 Effect of MDEA concentration in mixed solution on CO2absorption
由图4中曲线可知,根据吸收速率随时间的变化曲线,混合溶液中MDEA的浓度越高,混合溶液对CO2的吸收速率反而越低,但图4中各曲线的差别不大,说明MDEA的浓度对吸收速率的影响不是很大。根据两性离子理论,MEA先和CO2反应生成两性离子,然后MDEA与MEA的两性离子进行质子交换反应,生成新的离子,从而消耗了MDEA,又还原了MEA,使其可以继续快速的与CO2反应[5]。
MEA充当固定CO2的载体,反复被反应还原;而MDEA则被逐渐消耗。溶液中MDEA浓度的增加,一方面有更多的MDEA分子与两性离子反应,还原MEA;另一方面,更高的MDEA浓度使溶液中离子扩散的阻力增加,离子间的反应更加困难。两方面因素的综合比较最终结果,决定了混合溶液对CO2的吸收速率大小。由于这里MDEA的浓度比MEA的浓度高,这就表示只有部分MDEA分子可以与两性离子反应,另一部分MDEA分子则充当了离子扩散的阻力介质。随着MDEA浓度的增加,这部分阻力介质浓度也升高,这就导致混合溶液总体对CO2的吸收速率逐渐减小。由于MDEA与两性离子的质子交换反应是瞬时完成的[6],因此CO2与MEA的反应才是速率的控制关键。而在这里MDEA的浓度仅仅影响溶液中离子的扩散系数,所以它对整个系统的反应速率影响比较小,即MDEA的浓度越高,混合溶液对CO2的吸收速率越小,但各个体系的吸收速率差别又不大。
3.2 混合溶液中MEA浓度对CO2吸收影响
溶液总体积为 250 mL,MDEA的浓度都是1 mol/L,MEA 的浓度分别是0.4 mol/L、0.8 mol/L、1.2 mol/L、1.6 mol/L,反应温度都是 25 ℃,反应压力为大气压,入口CO2体积含量是15%,实验系统入口气体总流量是460 mL/min。实验结果如图5所示。

图5 混合溶液中MEA浓度对CO2吸收影响Fig.5 Effect of MEA concentration in mixed solution on CO2absorption
由图5中曲线可知,根据吸收速率随时间的变化曲线,混合溶液中MEA的浓度越高,混合溶液对CO2的吸收速率越高,MEA的浓度对混合溶液和CO2的反应速率影响较大。在图5中,50 min内含有 0.4 mol/L、0.8 mol/L、1.2 mol/L、1.6 mol/L MEA的平均吸收速率分别是 12.09 mL/min、18.57 mL/min、25.72 mL/min 和 31.90 mL/min。
根据MDEA+MEA混合体系吸收CO2的机理,MEA和CO2反应生成两性离子的反应是速率控制步骤。本实验主要考察MEA和MDEA的混合溶液对CO2的吸收性能,包括吸收速率、吸收总量和吸收负荷,同时研究了混合溶液中不同的组分比例对吸收效果的影响。实验表明:向MDEA溶液中加入少量MEA,可显著提高对CO2的吸收速率。这是因为MEA+MDEA体系存在化学反应交互作用,在MDEA浓度保持不变的情况下,MEA的浓度越高,充当“载体”的离子越多,体系的反应速率越高。MEA的浓度变化很大,混合体系的反应速率变化也很大。
4 结论
根据实验结果分析,可以得出以下结论:
1)在常压下MEA对CO2的吸收速率比MDEA大。
2)MDEA+MEA混合体系对CO2的吸收速率比单独的MDEA溶液的吸收速率大。
3)MEA+MDEA混合体系吸收CO2时,由于MDEA在溶液中离子扩散过程中充当阻力角色,在MEA的浓度保持不变的情况下,MDEA的浓度越高,CO2吸收速率越低,吸收量和吸收负荷也越小;由于MEA是直接吸收固定CO2的介质,MDEA的浓度保持不变的情况下,MEA的浓度越高,CO2吸收速率越高,吸收量和吸收负荷也越大。
[1]王喜平,刘兴会,张锴,等.基于系统动力学的火电企业节能减排投资研究[J].黑龙江电力,2013,35(3):200-202.WANG Xiping,LIU Xinghui,ZHANG Kai,et al.Study on the investment on energy saving and emission reduction based on system dynamics for thermal power enterprises[J].Heilongjiang Electric Power,2013,35(3):200-202.
[2]黎四芳,任铮伟,李盘生.MDEA-MEA混合有机胺水溶液吸收CO2[J].化工学报,1994,45(6):698-703.LI Sifang,REN Zhengwei,LI Pansheng.Absorption of CO2by aqueous MDEA-MEA solution[J].Journal of Chemical Industry and Engineering,1994,45(6):698-703.
[3]钟战铁.有机胺溶液吸收二氧化碳基础研究[D].杭洲:浙江大学,2002.ZHONG Zhantie.Fundamental study on carbon dioxide absorption into amines[D].Hangzhou:Zhejiang University,2002.
[4]吴晓明,郑敏灵.MDEA法脱除二氧化碳的浅析[J].宁夏化工,1994(2):11-12.WU Xiaoming,ZHENG Minling.Study on removing carbon dioxide by MDEA[J].Ningxia Chemical Industry,1994(2):11-12.
[5]项菲,施耀,李伟.混合有机胺吸收烟道气中 CO2的实验研究[J].环境污染与防治,2003,25(4):206-208.XIANG Fei,SHI Yao,LI Wei.Study on absorption of CO2into aqueous blends of DETA/TETA and MDEA [J].Environmental Pollution and Control,2003,25(4):206-208.
[6]施耀,项菲,李伟.混合有机胺吸收烟道气中CO2的交互作用机理[J].中国环境科学,2003,23(2):201-205.SHI Yao,XIANG Fei,LI Wei.The mechanism of interaction effect of CO2 absorption from flue gas with mixed organic amines[J].China Environmental Science,2003,23(2):201-205.

