siRNA靶向抑制铜绿假单胞菌oprM基因表达
郑亚婷 张艳亮 向莉 王玉明 单斌段勇
·论著·
siRNA靶向抑制铜绿假单胞菌oprM基因表达
郑亚婷 张艳亮 向莉 王玉明 单斌★段勇★
目的探讨siRNA能否抑制铜绿假单胞菌(Pseudomonas aeruginosa,PA)主动外排系统oprM基因的表达。方法针对oprM基因序列设计合成3对siRNA片段,分别转化耐药PA,采用抗菌素药物敏感试验筛选出能抑制PA耐药的siRNA片段及其最佳转化剂量,再构建siRNA质粒表达载体,转化PA标准菌株,应用western blot技术检测OprM蛋白表达量的变化。结果筛选出一对能抑制PA耐药的siRNA片段,确定其最佳转化剂量为25 μL(20 μm/L)/100 μL PA菌液。成功构建了靶向oprM基因的siRNA质粒表达载体。Western Blot检测结果显示,转化siRNA质粒载体的PA其OprM蛋白的表达量明显降低。结论靶向oprM基因的siRNA能够抑制PA oprM基因的表达。
铜绿假单胞菌;oprM基因;OprM蛋白;siRNA
铜绿假单胞菌(Pseudomonas aeruginosa,PA)属假单胞菌属,广泛分布于自然界和正常人的皮肤、呼吸道和肠道等组织中,是院内感染的主要病原菌之一[1]。PA的耐药机制复杂,近年来的研究发现,PA内存在多种主动外排系统,是PA耐药的重要机制之一。其中,外排系统MexAB-OprM的外膜蛋白OprM是多种主动外排系统的重要组份,其表达上调可使PA产生获得性耐药[2]。RNA干扰(RNA interference,RNAi)是利用长度为21nt的微小双链RNA与靶mRNA互补结合导致靶mRNA降解,从而抑制靶基因的表达。在真核细胞中RNAi现象广泛存在,其作用机制已研究的比较清楚,但至今仍鲜见RNAi技术应用于原核生物基因表达的报道。本研究拟设计合成靶向PA oprM基因的小干扰RNA(small interfering RNA,siRNA),探讨siRNA能否抑制oprM基因的表达。
1 材料与方法
1.1材料
铜绿假单胞菌标准菌株ATCC27853(A3)购自卫生部临检中心。临床菌株:收集昆明医科大学第一附属医院临床分离出的3株耐药性较强的PA,分别称为PA-1、PA-2和PA-3。鼠抗OprM蛋白多克隆抗体由本课题组制备,鼠抗GAPDH单克隆抗体购自中杉金桥生物有限公司;HRP标记的羊抗鼠IgG抗体购自美国Invitrogen公司。
1.2方法
1.2.1oprM-siRNA片段的设计
根据Genebank公布的oprM基因序列(AB011381),设计并合成3对oprM-siRNA片段和1对对照siRNA片段,见表1。通过BLAST分析,3对oprM-siRNA片段与oprM基因序列完全互补,与其他基因无同源性。对照siRNA片段与oprM基因及其他基因无同源性。
1.2.2有效oprM-siRNA的筛选
用经典CaCl2法制备PA-1、PA-2和PA-3感受态细胞,将3对浓度为20 μm/L的oprM-siRNA片段分别以5 μL、10 μL、15 μL、20 μL、25 μL、30 μL、35 μL和40 μL 8个剂量转化100 μL PA-1、PA-2和PA-3感受态细胞,采用K-B法进行抗菌素药物敏感性试验,试验重复5次。比较转化前、后药敏试验的抑菌环面积的变化,进行配对秩和检验,应用SPSS 16.0统计软件进行统计分析,以α=0.05为检验水准,根据统计结果筛选有效片段。

表1 3对oprM-siRNA片段及对照siRNA片段Table 1Three pairs of siRNA sequences targeting oprM gene and control siRNA sequence
1.2.3pSilencer 2.1-oprM-shRNA的构建
筛选出有效oprM-siRNA片段后,设计、合成oprM-shRNA片段和shRNA对照片段,两端分别加入BamHⅠ和HindⅢ酶切位点。shRNA片段经变性、退火后,用BamHⅠ和HindⅢ进行双酶切。将质粒pSilencer 2.1用BamHⅠ和HindⅢ进行双酶切,琼脂糖凝胶回收大片段。将酶切后的oprM-shRNA片段和shRNA对照片段分别与酶切后的pSilencer 2.1进行连接,连接后的质粒表达载体分别称为pSilencer 2.1-oprM-shRNA和pSilencer 2.1-对照-shRNA。
1.2.4pSilencer 2.1-oprM-shRNA的鉴定
将pSilencer2.1-oprM-shRNA和pSilencer 2.1-对照-shRNA分别转化感受态细胞DH5а,分别涂布于含羧苄青霉素(终浓度为100 mg/ml)的LB平板上,37℃恒温箱培养过夜。挑选阳性克隆,增菌后提取质粒,进行SalⅠ酶切鉴定,并进一步测序鉴定重组质粒。
1.2.5pSilencer 2.1-oprM-shRNA抑制OprM蛋白表达
将成功转化pSilencer 2.1-oprM-shRNA和pSilencer 2.1-对照-shRNA的A3分别接种于含羧苄青霉素(终浓度为100 mg/mL)的LB培养基中,37℃恒温箱培养过夜,分别提取总蛋白,采用Bradford法定量;以GAPDH为对照,进行western blot检测,对OprM蛋白的表达变化进行半定量分析,试验重复3次。
2 结果
3对oprM-siRNA片段以不同剂量分别转化PA-1、PA-2和PA-3,抗菌素药物敏感性试验显示:以oprM-siRNA-3 25 μL转化PA-1、PA-2和PA-3前后,部分药物的抑菌环面积差异有统计学意义,如阿米卡星(t=-3.207,P=0.035),头孢他啶(t=-3.517,P=0.025),头孢吡肟(t=-3.166,P= 0.034),氨曲南(t=-3.202,P=0.033),哌拉西林/他唑巴坦(t=-3.250,P=0.031),见表2、图1,故确定oprM-siRNA-3为有效片段,25 μL为最佳转化剂量。
根据oprM-siRNA-3的序列设计出oprM-shRNA,其序列为:5′-GATCC AGATCAACGTCG CGCAGTATTCAAGAGATACTGCGCGACGTTGA TGTTTTTTTGTCGACAAGCT-3′,5′-AGCTTGTC GACAAAAAAACATCAACGTCGCGCAGTATCT CTTGAATACTGCGCGACGTTGATGTGGATC-3′。对照shRNA的序列为:5′-GATCCAGGGATCC ATACACTGATGTTCAAGAGACATCAGTGTATG GATCCCTTTTTTTGTCGACAAGCT-3′,5′-AGCT TGTCGACAAAAAAAGGGATCCATACACTGATG TCTCTTGAA CATCAGTGTATGGATCCCT GGA TC-3′。其中茎环结构为“TTCAAGAGA”,多个连续的T碱基为终止子。
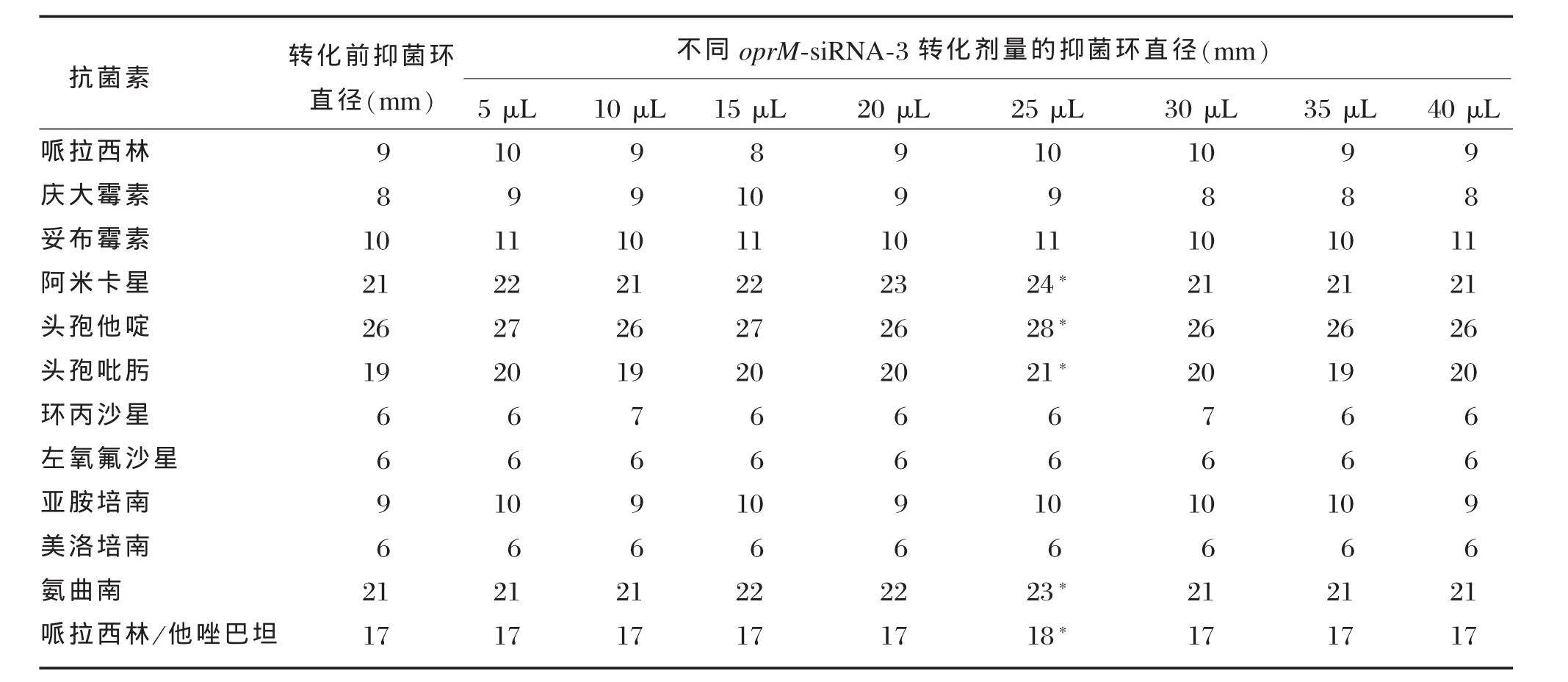
表2 oprM-siRNA-3转化PA-2前后抗菌素药物敏感试验结果Table 2Drug sensitive tests before and after PA-2 transformed with oprM-siRNA-3
经BamHⅠ,HindⅢ双酶切后的pSilencer 2.1及shRNA经T4连接酶进行相互连接,构建成pSilencer 2.1-oprM-shRNA和pSilencer 2.1-对照-shRNA。重组质粒经SalⅠ酶切后出现两条片段,小片段约400 bp(图2),提示重组质粒符合预期要求。测序结果显示oprM-shRNA和shRNA对照序列完全正确(图3),表明pSilencer 2.1-oprM-shRNA和pSilencer 2.1-对照-shRNA构建成功。
分别用pSilencer 2.1-oprM-shRNA和pSilencer 2.1-对照-shRNA转化A3后,western blot检测显示,与对照相比,转化pSilencer 2.1-oprM-shRNA后A3的OprM蛋白的表达量明显降低(图4,表3)。

图1 oprM-siRNA-3转化PA-2前后的药敏结果Figure 1Drug sensitive tests before and after PA-2 transformed with oprM-siRNA-3
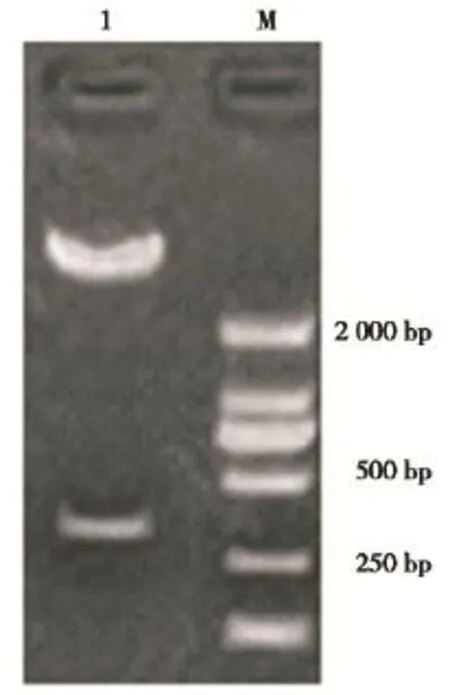
图2 pSilencer 2.1-oprM-shRNA的Sal I酶切产物电泳图Figure2TheelectrophoregramofpSilencer2.1-oprM-shRNA digested by SalⅠ
3 讨论
随着抗生素的广泛应用,PA对临床常用抗生素已呈现出明显的耐药,耐药率在15%~50%之间,耐药状况十分严重[2]。研究表明主动外排系统的存在是细菌产生耐药性及发生获得性多重耐药的主要原因[3]。OprM外膜蛋白是PA主动外排系统中的重要功能蛋白,是PA耐药性发生的重要原因,因此,抑制OprM的表达可能成为减慢或抑制PA耐药的有效方法。
RNAi是抑制基因表达的有效方法。在真核生物基因功能的研究方面,RNAi得到了广泛运用[4-5]。然而,在原核生物中是否存在RNAi目前尚未得到完全证实。近期有研究表明在原核生物中含有RNAi系统的类似功能结构,可通过siRNA调节细菌基因的表达[6]。此外,Greenfield等[7]研究报道siRNA可调节质粒的复制,并且通过沉默质粒特定基因可以杀死不含质粒的细菌。Cervantes等从毛霉菌中鉴定出3个参与内外源性RNAi的argonaute基因[8],并且新近的研究已揭示了真菌中RNAi介导的不同生物过程和小RNA生物合成途径[9]。因此,在原核生物中可能存在RNAi机制。
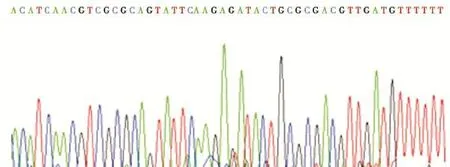
图3 pSilencer 2.1-oprM-shRNA中的shRNA的测序结果Figure 3The sequencing results of shRNA in pSilencer 2.1-oprM-shRNA
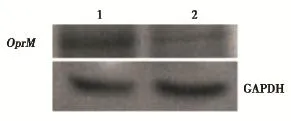
图4 分别转化目标质粒和对照质粒后A3的OprM蛋白的western blot检测结果.Figure4ThewesternblotresultsofOprMinA3 transformedwithtargetplasmidandcontrolplasmid,respectively
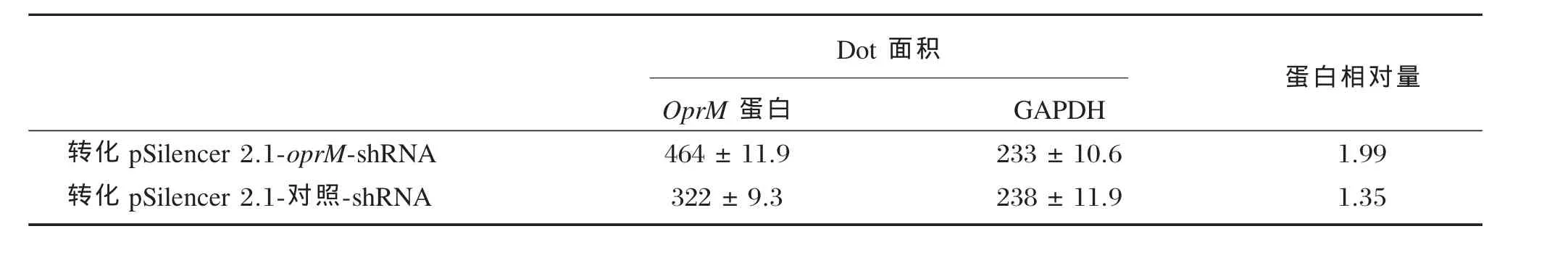
表3 分别用pSilencer 2.1-oprM-shRNA和pSilencer 2.1-对照-shRNA转化A3后OprM蛋白的表达变化比较Table 3The comparison of OprM expression in A3 transformed with pSilencer 2.1-oprM-shRNA and pSilencer 2.1-control-shRNA,respectively
本研究旨在应用RNAi技术,特异性地抑制PA oprM基因的表达,探讨原核生物中是否存在RNAi以及oprM基因表达受抑是否会降低PA的耐药性。本研究根据PUBMED数据库中公布的oprM基因核苷酸序列,设计合成了靶向oprM基因的3对siRNA片段,应用抗菌素药物敏感试验筛选出了抑制作用最明显的1对siRNA片段。药敏结果显示,直接转化此siRNA后,能够有效降低PA对部分抗菌素包括阿米卡星、头孢他啶、头孢吡肟、氨曲南、哌拉西林/他唑巴坦等的耐药性。根据此siRNA片段,我们设计合成了oprM-shRNA片段,并成功构建了相应的质粒表达载体pSilencer 2.1-oprM-shRNA。将pSilencer 2.1-oprM-shRNA和对照重组质粒分别转化铜绿假单胞菌质控标准菌株A3后,通过western blot检测发现与对照相比,转化pSilencer 2.1-oprM-shRNA的A3的OprM蛋白的表达量明显降低。
因此,我们的研究初步表明,原核生物中可能存在siRNA机制,且siRNA质粒表达载体也可能在原核生物中发挥siRNA作用,通过siRNA抑制原核生物重要的耐药基因可能有助于减缓或降低原核生物的耐药性。然而,原核生物中是否存在RNAi机制及其作用机制尚需进一步证实。
[1]Bowers D R,Tam V H.Pseudomonas aeruginosa treatment and transmission reduction[J].Expert Rev Anti Infect Ther,2013,11(8):831-837.
[2]Kollef M H,Chastre J,Fagon J Y,et al.Global prospective epidemiologic and surveillance study of ventilator-associated pneumonia due to Pseudomonas aeruginosa[J].Crit Care Med,2014.Doi:10.1097/ CCM.0000000000000510.[Epub ahead of print].
[3]Guénard S,Muller C,Monlezun L,et al.Multiple mutations lead to MexXY-OprM-dependent aminoglycoside resistance in clinical strains of Pseudomonas aeruginosa[J].Antimicrob Agents Chemother,2014,58(1): 221-228.
[4]Beronja S,Janki P,Heller E,et al.RNAi screens in mice identify physiological regulators of oncogenic growth[J].Nature,2013,501(7466):185-190.
[5]Svoboda P.Renaissance of mammalian endogenous RNAi[J].Febs Lett,2014,588(15):2550-2556.
[6]Pielage J F,Powell K R,Kalman D,et al.RNAi screen revealsanablkinase-dependenthostcellpathway involved in Pseudomonas aeruginosa internalization[J].PLoS Pathogens,2008,4(3):e1000031.
[7]Greenfield T J,Franch T,Gerdes K,et al.Antisense RNA regulation of the par post-segregational killing system:structural analysis and mechanism of binding of the antisense RNA,RNAII and its target,RNAI[J].Mol Microbiol,2001,42(2):527-537.
[8]Cervantes M,Vila A,Nicolás F E,et al.A single argonautegeneparticipatesinexogenousand endogenous RNAi and controls cellular functions in the basal fungus mucor circinelloides[J].PLoS One,2013, 8(7):e69283.
[9]Chang S S,Zhang Z,Liu Y.RNA interference pathways in fungi:mechanisms and functions[J].Annu Rev Microbiol,2012,66:305-323.
Suppressed expression of oprM by target siRNA in Pseudomonas Aeruginosa
ZHENG Yating,ZHANG Yanliang,XIANG Li,WANG Yuming,SHAN Bin★,DUAN Yong★
(Department of Laboratory,First Affiliated Hospital of Kunming Medical University,Kunming,Yunnan, China,650032)
ObjectiveTo investigate whether the expression of active efflux system oprM gene can be inhibited by target siRNA in pseudomonas aeruginosa(PA).MethodsThree pairs of siRNAs were designed and synthesized according to the reference sequence of oprM gene,and then transformed into the competent drug-resistance PAs respectively.The most effective siRNA and optimal transformation dosage were screened out by antimicrobial susceptibility test.The plasmid expression vector containing the effective siRNA fragment was constructed and then transformed into standard PA strain.The amount of protein expression levels of oprM was tested by western blot.ResultsAn effective siRNA was screened out and the optimal transformation dosage was ascertained to be 25 μL(20 μm/L)/100 μL PA.The oprM gene targeted siRNA-expression plasmid vector was successfully constructed.The results of western blot showed that the expression of OprM protein in PA transformed with siRNA-expression plasmid vector decreased significantly. ConclusionThe expression of the oprM gene in PA can be inhibited by oprM targeted siRNA.
Pseudomonas aeruginosa;oprM gene;OprM protein;siRNA
2014国家自然科学基金(81460322);2012年云南省内设研究机构科技计划(2012WS0022);2011年云南省内设研究机构科技计划(2011WS0048)
昆明医科大学第一附属医院医学检验科,云南,昆明650032
★通讯作者:单斌,E-mail:shanbin6@139.com;段勇,E-mail:duanyong7@139.com
注:单斌和段勇为共同通讯作者

