软骨发育不全植入前遗传学诊断的方法学研究
李荣毕博文沈晓婷郭源平蒋玮莹郭奕斌★
·论著·
软骨发育不全植入前遗传学诊断的方法学研究
李荣1毕博文2沈晓婷3郭源平4蒋玮莹1郭奕斌1★
目的针对软骨发育不全(ACH)高危家系的FGFR3基因的突变类型(c.1138G>A,p.G380R),建立多种快速特异、行之有效的植入前遗传学诊断(PGD)方法,为实施该ACH家系的PGD创造必要的前提条件。方法在确诊该ACH患者特定突变类型的基础上,首先用外周血建立各种PGD方法,包括:A.直接测序法;B.ARMS法;C.酶切鉴定法;D.ARMS/RE法。然后对单个卵裂球的全基因组扩增(WGA)产物进行相应方法学的研究。最后,对各种方法进行优化优选。结果A.直接测序法:正常对照c.1138为G纯合子,而患者为G/A杂合峰;B.ARMS法:正常对照扩增阴性,而患者有445 bp的特异扩增条带。C.酶切鉴定法:正常对照酶切后仍为513 bp,而患者酶切后产生205 bp、308 bp、513 bp三条带;D.ARMS/RE法:正常对照扩增阴性,无法做酶切鉴定。而患者有445 bp扩增产物,经SfcI酶切后可产生27 bp和418 bp两个片段。结论本研究已成功建立针对c.1138 G>A杂合错义突变的直接测序法、ARMS法、酶切鉴定法和ARMS/RE法。所建立的4种方法快速、特异,但各有利弊,同时使用可相互弥补,结合STR连锁分析可把误诊风险降到最低程度。在正常情况下,可在24 h内完成对ACH高危胚胎的PGD。
软骨发育不全(ACH);FGFR3基因;植入前遗传学诊断(PGD);全基因组扩增(WGA);突变特异性扩增系统(ARMS)
软骨发育不全(achondroplasia,ACH,MIM 100800)是人类侏儒症中最常见的一种短肢型遗传性骨病,为常染色体显性遗传(AD)[1-2],外显率高达100%[3],男女均可发病。以四肢粗短、身材矮小、头大、三叉手、前额突出、颅面骨畸形、腰椎前凸、臀部后突为主要特征,发病率为1/15 000~1/26 000[3]。该病是由于成纤维细胞生长因子受体3(fibroblast growth factor receptor3,FGFR3)基因突变所致,至今仍无切实有效的根治方法,对症治疗虽能取得一定疗效,但只能治标无法治本。因此,开展基因诊断进而实施产前基因诊断、防止患胎出生仍是目前最佳的应对策略。但自然受孕的再发风险非常高,而常规的产前诊断一旦确诊患胎,孕妇仍需进行流产或引产,而引产对母体的身心伤害很大。因此,通过常规的产前诊断而采取的防患措施仍存在很大的不足,而植入前遗传学诊断(preimplantation genetic diagnosis,PGD)是在胚胎着床前就对高危胚胎进行遗传学诊断(单基因病采用基因诊断或连锁分析,染色体病采用FISH检查或G带分析),一方面通过促排卵(可一次性排出数十个成熟卵子),可以增加正常卵细胞的几率,另一方面,即使查出患病的胚胎,由于它不会被植入子宫,因此孕妇不需面临流产/引产的风险,而且它能从根源上解决受孕胚胎的正常与否,故该法具有很大的优越性,特别受高危家系尤其是多次引产的高危孕妇的青睐。但该法也有局限性,因为可供检测的样品很少,只有1~2个卵裂球;可供检测的时间很短,只有24小时左右,因此检测难度很大,诊断风险很高,对技术人员及其所建立的诊断技术的要求也相当高。虽然现有全基因组扩增(whole geneome amplification,WGA)技术可以解决样本量少的问题,但目前国内外仍然无法解决等位基因脱扣(allelo drop out,ADO)的问题[4]。因此,建立多种快速特异又准确可靠的检测方法就显得尤为重要和必要,它们可以取长补短,可以互相验证,从而大大提高准确率,还可以在方法学上进行自主创新,其重要意义不言而喻,这正是本研究的意义之所在。
1 材料与方法
1.1研究对象和研究背景
临床资料:先证者,男性,27岁,已婚,身高122 cm,体重50 kg。体格检查:头大,前额圆凸;鼻梁下陷,面容粗犷,躯干正常,四肢长度不成比例缩短,特别是上臂及大腿过短,肢体皮肤皱褶较多,肘伸展受限,手指呈“三叉”状,膝外翻(也称O形腿),走路呈滚动步态,但智力发育正常。临床症状符合ACH,经FGFR3基因诊断后,确诊为ACH。该家庭通过自然受孕先后孕育2胎,在患者夫妇的迫切要求和知情同意下,对其实施了产前基因诊断,均确诊为ACH患胎。夫妇经慎重考虑后,决定采用第3代试婴技术即PGD进行人工受孕。本研究正是在这一背景下,针对这一高危家系的特定突变类型FGFR3(c.1138G>A,p.G380R),进行PGD前的方法学研究,以便在正式实施PGD时,能把误诊风险降到最低程度。本研究对于在胚胎植入前解决高危胚胎的诊断问题、有效防止ACH患胎的孕育、避免常规产前诊断查出患胎还要引产给孕妇造成的各种身心伤害等,都具有重要的理论和临床实践意义。
1.2外周血的PGD方法学研究
本项目首先对外周血样品进行方法学研究,逐一建立DNA直接测序、ARMS、酶切鉴定、ARMS/RE四种快速特异检测法。
1.2.1外周血基因组DNA提取
采用本室改进的微量快提法制备模板DNA:取EDTA抗凝血200 μL→纯净水溶血→打散混匀后放入-20℃5 min→离心,弃上清→再次加纯净水打散混匀→离心,弃上清→加STE、SDS、PK→混匀后于55℃水浴1.5 h→+ 1V酚氯仿异戊醇抽提一次→上清用无水乙醇沉淀→离心、弃上清→TE-4溶解→打匀后直接PCR。
1.2.2引物的设计合成和PCR扩增
普通引物参照文献[5]合成,上、下游引物序列分别为:5′-CTGCGAGACCCTCCAGACAAG-3′和5′-GAATGTTTCGTGCCCCAAAGTAC-3′。特异引物为自行设计,上、下游引物序列分别为FGFR(1138)A:5′-TGTGCCCAGTGTGGGGACAAAG-3′;FGFR(1138)B:5′-GATGAACAGGAAGAAG CCCAGCCT-3′。内对照引物为GALNS基因的第1外显子引物,因其扩增条件与FGFR(1138)引物的相同,扩增后具有稳定、清晰且容易辨别的扩增带。其引物序列为:E1A 5′-CGGGGCTCCGCGG CTCCCGTGGTTG-3′;E1B 5′-CTGCCCCGTCCC ACCGCCCGCACTC-3′。
就FGFR3基因下游引物来说,跟正常原始序列“5′-GATGAACAGGAAGAAGCCCACCCC-3′”相比,FGFR(1138)B的序列有两处是错配的,即3′端第1位碱基由“C”变为“T”,第4位碱基由“C”变为“G”,而对于患者来说,由于3′端第1位的碱基“C”已经突变为“T”(其互补链就是G>A,如摘要和文中所写的),所以相对于患者的序列“5′-GATGAACAGGAAGAAGCCCACCCT-3′”来说,FGFR(1138)B的序列就只有1个碱基即第4位的“C”是错配的。因此,在控制好PCR扩增条件的前提下,就可以让单错配的患者序列扩增阳性,而双错配的正常对照序列扩增阴性,从而达到将患者与正常对照及非c.1138 G>A突变的患者鉴别开来的目的。上述引物均由上海英骏公司合成。
PCR反应体系为30 μL,含10×Taq Buffer 3 μL,2 mmol/L dNTPs 3 μL,上、下游引物(10 μmol/L)各1 μL,DNA模板1.5 μL(约300 ng),Taq DNA聚合酶1.6 U(MBI公司,美国),补足超纯水至30 μL。在DNA Thermal Cycler(PE公司,美国)PCR仪上完成FGFR3(1138)基因片段的扩增。普通引物、特异引物和内对照引物的PCR扩增产物分别为513 bp、445 bp和174 bp。三种引物的扩增条件完全相同即:94℃预变性3 min,94℃40秒,65℃30秒,72℃40秒,36 cycles,72℃继续延伸5 min。以1.5%琼脂糖凝胶电泳检测扩增效果。
1.2.3DNA序列分析
将普通引物扩增的产物直接交上海英骏公司用ABI PRISM 3730型DNA序列自动分析仪(INVITROGEN英骏公司,中国)完成双向测序。
1.2.4SfcI酶切鉴定
SfcI限制性内切酶识别的位点是:5′-C↓T Pu Py A G-3′。其中Pu为嘌呤,Py为嘧啶。
取一消毒的0.5 mL Ep管→加入8.5 μL tH2O+2 μL NEB4 Buffer(10×)+2 μL BSA(10 ×)+7 μL PCR产物(≤1 μg)+0.5 μL SfcI(2 U/μL)→总体积20 μL→弹匀→Spin×2″→≤37℃×1 h→65℃下20 min使酶失活→小胶或微胶电泳,观察结果→记录、拍照。
RE鉴定法:用普通引物引物扩增后,将扩增产物(513 bp)再用SfcI进行酶切鉴定。
ARMS/RE法:用自己设计的ARMS引物扩增后,将扩增产物(445 bp)再用SfcI进行酶切鉴定。
1.3单卵裂球的PGD方法学研究
在外周血方法学研究基础上,对由生殖医学中心提供的单个卵裂球的WGA产物进行相应方法学研究。首先以WGA产物做模板,用普通引物和特异引物分别扩增FGFR3基因的E10,然后逐一建立:A.直接测序法;B.ARMS法;C.酶切鉴定法(用普通引物扩增后,再用SfcI酶切鉴定);D.ARMS/RE法(用下游双错配特异引物扩增,再结合SfcI酶切鉴定)。原理和步骤与外周血的相同。
2 结果
2.1PCR扩增结果
用普通引物FGFR E10扩,正常对照和患者都有特异扩增带,产物大小均为513 bp。用特异引物FGFR(1138)扩,正常对照无扩增产物,而杂合子患者有一445 bp的特异扩增带。所有泳道都有174 bp的内对照带。这些都与预期的结果完全吻合。如图1所示。
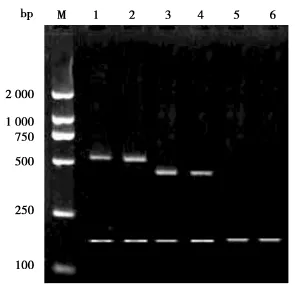
图1 用普通引物和特异引物扩增的电泳结果(均含有174 bp的内对照带)Figure 1Electrophoresis results of PCR products(contain mutation hot spot)amplified with ordinary primer and specific primer,respectively(all lanes contain a 174 bp internal control band)
2.2DNA测序结果
正常对照FGFR3基因c.1138 bp为正常的G(图2-①),而ACH患者该位点的G突变为A,为杂合突变,产生A/G杂合子(图2-②)。特异引物扩出的产物,除了c.1138 bp为A纯合子外,还在距其第4位的碱基产生错配的C(图2-③),这与我们设计的错配碱基是完全一致的。
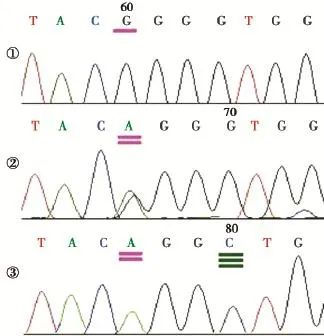
图2 用普通引物和特异引物扩增的产物的测序结果Figure 2Sequencing results of PCR products(contain mutation hot spot)amplified with ordinary primer and specific primer,respectively
2.3SfcI酶切结果
将普通引物扩增的产物(513 bp)分别用限制性内切酶SfcI酶切,正常对照没有切点,酶切后仍为513 bp一条带,而杂合子患者由于一条有切点,另一条没切点,故酶切后产生205 bp、308 bp、513 bp三条带;而将特异引物扩增的产物(445 bp,仅患者扩增阳性)用限制性内切酶SfcI酶切,则切出27 bp和418 bp两个片段(其中27 bp的小片段已跑出胶外),如图3所示。正常对照扩增阴性,无法做酶切鉴定。这一切都与预期的结果完全吻合。

图3 普通引物和特异引物的扩增产物的SfcI酶切鉴定结果Figure 3SfcI digested result of PCR products amplified with ordinary primer and specific primer,respectively
3 讨论
FGFR3突变基因是引起软骨发育不全、软骨发育低下(hypochondroplasis,HCH,MIM 146 000)、致死性侏儒症(thanatophoric dwarfism,TD,MIM 187600)等的致病基因[6],为常染色体显性遗传,外显率100%,即只要有病理性突变存在,就必然引起相应的症状。位于FGFR3基因第10外显子的cDNA 1138 G>A,p.G380R是引起ACH病的突变超热点,突变频率高达95%,有的文献甚至报道高达97%[3]。目前,检测该突变的方法有限制性片段长度多态性分析[7],也有变性高效液相色谱分析和DNA序列分析[8],还有高分辨解链分析以及基因芯片法[9],但至今未见ARMS特异引物直接鉴定法和ARMS结合RE法。因此,针对这一突变超热点设计特异、灵敏的ARMS引物,建立快速、简便、准确、经济的基因诊断方法,用于疑似ACH的软骨发育不良病的快速筛检(可排除97%的ACH[3]),进而用于本病的产前基因诊断[10,11]特别是PGD[12]无疑具有相当高的实用价值。
ARMS引物的PCR扩增结果显示:正常对照没有特异扩增条带,而杂合子突变有445 bp的条带。这与预期的结果完全一致,说明引物的设计思路是正确的。另外,在进行产前基因诊断时,为了保证结果的可靠性,还应加做SfcI酶切鉴定。因为当FGFR3基因第1 138 bp的G突变为A后,序列ctacgg就变为ctacag,正好可以产生SfcI酶切位点(SfcI识别位点为:5′-C↓TPuPyAG-3′)。只要ARMS特异引物有效扩增,就可同时用SfcI进行酶切鉴定(见图3)。这样即可在一天之内送报结果,达到快速产检的目的。当然,同时进行DNA序列分析,结果将更为可靠。
ACH至今仍无有效的药物治疗方法,生长激素治疗似乎也只能取得短期的疗效,且这些疗法都只能治标而无法治本,致病基因仍然会按遗传规律传给下一代。所以,开展基因诊断,查出病因和突变性质,继而实施产前特别是植入前诊断、防止患胎出生仍是目前的最佳应对策略。
PGD是产前诊断的最早期形式,但与常规的产前诊断不同,它是在妊娠发生之前进行的,因而避免了选择性流产以及伴随而来的道德观念方面的冲突。Rechitsky等2002年首次成功开展了软骨发育不全的PGD[13],但国内至今未见报道,加上软骨发育不全80%以上为散发病例,突变类型、突变性质都不尽相同,具体到某一家系、某一病例,其诊断技术、所用仪器试剂、检测成本、诊断费用也都各有差异,并且现已报道的PGD检测方法和诊断技术都很有限。因此,针对我们所接诊的病例,建立多种快速特异、有创新性的诊断技术,不仅具有重要理论意义,而且具有重要实用价值。本研究的特色和创新之处主要在于:所建立的ARMS以及ARMS/RE法为我们所独创,具有快速特异、稳定可靠、操作简单、成本低廉的优点,特别适用于PGD。另外,几种方法同时使用,可以取长补短,可以把风险尤其是ADO所导致的误诊率降到最低程度,从而为正式实施PGD打下坚实的技术基础。
由于实施PGD时,可供检测的样品只有1~2个卵裂球,可供检测的时间只有24小时左右,因此在正式实施之前,有必要把各种行之有效的、快速特异的检测方法建立好。本文首先通过建立外周血的4种检测方法,在证实可行后,又对单个卵裂球的WGA产物进行上述方法学的研究。结果表明,不论是用普通引物还是用特异引物扩增,也不论是扩增后直接做测序还是直接做酶切,结果都与外周血的完全一致,而且由于WGA产物是来自单个细胞,所以模板更纯,扩增产物和PCR产物的测序结果、酶切结果都更清晰纯净(由于篇幅所限,故用WGA产物建立的4种方法的结果图均未放入文中)。这为正式实施ACH的PGD无疑奠定了更坚实的基础。值得一提的是,近年来随着PGD技术的飞速发展,现在已经可用囊胚期的滋养外胚层细胞进行检测[14]。这样,不但可供检测的细胞数更多,而且可供检测的时间也更充裕,这对提高PGD的成功率无疑创造了更好的条件。
[1]李琳迪,蓝丹,杨湖,等.软骨发育不全与软骨发育低下的FGFR3基因突变分析[J].临床儿科杂志,2014,32 (4):384-387.
[2]Di R F,Duplan M B,Heuze Y,et al.FGFR3 mutation causes abnormal membranous ossification in achondroplasis[J].Hum Mol Genet,2014,23(11):2914-2925.
[3]麻宏伟,姜俊,吕峻峰,等.FGFR3基因突变分析在产前诊断及短肢畸形胎儿中的应用[J].中国实用儿科杂志,2005,20(4):242-243.
[4]孙燕,俞萍,金帆.植入前遗传学诊断技术发展现状[J].中国男科学杂志,2008,22(1):68-69.
[5]朱娜,王卫庆,姜蕾,等.先天性软骨发育不全一家系的基因诊断[J].中华内分泌代谢杂志,2004,20(5):441-443.
[6]Almeida M R,Campos-Xavier A B,Medeira A,et al.Clinicalandmoleculardiagnosisoftheskeletal dysplasiasassociatedwithmutationsinthegene encoding fibroblast growth factor receptor 3(FGFR3)in Portugal[J].Clin Genet,2009,75(2):150-156.
[7]HortonW A,Hall J G,Hecht J T.Achondroplasia[J].Lancet,2007,370(9582):162-172.
[8]张明,赵文双,高智文.FGFR3突变与软骨发育不全的研究进展[J].中国优生与遗传杂志,2010,18(5):1-2.
[9]Shiang R,Thompson L M,Zhu Y Z,et a1.Mutations in the transmembrahe domain of FGFR3 cause the most common genetic form of dwarfism,achondroplasia[J].Cell,1994,78(2):335-342.
[10]任秀莲,陈贵安.植入前遗传学诊断的方法及应用[J].中华临床医师杂志,2009,3(1):1-6.
[11]Handyside A H,Kontogianni E H,Hardy K,et al.Pregnanciesfrombiopsiedhumanpreimplantation embryos sexed by Y-specific DNA amplification[J].Nature,1990,344(6268):768-770.
[12]李亚里.妇产科学进展与发展设想[J].解放军医学杂志,2010,35(10):1170-1175.
[13]Rechitsky S,Verlinsky O,Amet T,et a1.Reliability of preimplantation diagnosis for single gene disorders[J].Molecular and Cellular Endocrinology,2002,183(9): S65-S68.
[14]陈智勤.植入前遗传学诊断的研究现状及展望[J].http: //www.haodf.com/zhuanjiaguandian/ptchen1_36227.htm.2009.
The methodological study of preimplantation genetic diagnosis for achondroplasia
LI Rong1,BI Bowen2,SHEN Xiaoting3,GUO Yuanping4,JIANG Weiying1,GUO Yibin1★
(1.Department of Medical Genetics,Sun Yat-sen Medical School,Sun Yat-sen University,Guangzhou, Guangdong,China,510080;2.Summer Team,Department of Medical Genetics,Sun Yat-sen University/ Clinical Medicine(Eight Year Program),Grade 2009,Guangzhou,Guangdong,China,510080;3.Reproduction Medical Center,the First Affiliated Hospital,Sun Yat-sen University,Guangzhou,Guangdong,China,510080;4.Amateur Team,Department of Medical Genetics,Sun Yat-sen University/Class 3,senior 2,the 16th Middle School,Guangzhou,Guangdong,China,510080)
ObjectiveTo establish quick,specific and effective methods for preimplantation genetic diagnosis(PGD)focusing on the gene mutation(c.1138G>A,p.G380R)of FGFR3 gene which causes the achondroplasia(ACH),as well as to provide a prerequisite for the implementation of PGD of the ACH family.MethodsBased on the confirmed diagnosis of the ACH specific gene mutation,four methods of PGD were established by using the peripheral blood,which including,Direct DNA sequencing,ARMS assay,restriction enzyme digestion assay and ARMS/RE assay.Then the methodology-based study on the whole genome amplification(WGA)product of a single blastomere was done for optimization.ResultsDirect DNA sequencing analysis:The normal control had a G homozygous peak at 1138th G base point in cDNA while the patient had a G/A heterozygous peak.ARMS assay:The normal control had no amplification products while the patient had a specific band at 445 bp.Restriction enzyme digestion identification assay:The normal control showed a 513 bp band after enzyme digestion,while the patient got three bands with 205 bp,308 bp and 513 bp,respectively.ARMS/RE assay:The normal control could not been done RE as it is negative amplification.On the contrary,the patient got a 445 bp amplification product, and two fragments of 27 bp and 418 bp were got after SfcI enzyme digestion.ConclusionThis study has successfully established the heterozygous missense mutation of c.1138 G>A by using direct DNA sequencing,ARMS assay,restriction enzyme digestion assay and ARMS/RE assay.Each of the four methods is rapid and specific,but each has its advantages and disadvantages.The combined use makes them complement each other and minimizes the risk of misdiagnosis,especially by combining with the STR linkage analysis.Under normal circumstances,the PGD for high-risk fetuses of ACH could be accomplished within 24 hours.
Achondroplasia(ACH);FGFR3 genes;Preimplantation genetic diagnosis(PGD); Whole genome amplification(WGA);Amplification refractory mutation system(ARMS)
闽粤横向科研项目(71010025)
1.中山大学中山医学院医学遗传学教研室,广东,广州510080 2.中山大学医学遗传室暑期科研小组/2009级临床医学专业(八年制),广东,广州510080 3.中山大学附一院生殖医学中心,广东,广州510080 4.中山大学医学遗传室业余科研小组/广州市第十六中学高二(3)班,广东,广州510080
★通讯作者:郭奕斌,E-mail:guoyibin@mail.sysu.edu.cn,aguoabin@qq.com
注:李荣和毕博文为并列第一作者

