还原法羽毛角蛋白再生材料二级结构的差异解析
李翔宇,杨雪霞,周美华,曹张军
(1.东华大学生态纺织教育部重点实验室,上海 201620;2.东华大学化学化工与生物工程学院,上海 201620;3.东华大学环境科学与工程学院,上海 201620)
还原法羽毛角蛋白再生材料二级结构的差异解析
李翔宇1,杨雪霞2,周美华2,曹张军3
(1.东华大学生态纺织教育部重点实验室,上海 201620;2.东华大学化学化工与生物工程学院,上海 201620;3.东华大学环境科学与工程学院,上海 201620)
建立一种解析还原法羽毛再生材料中蛋白质二级结构差异的方法。对降解所得不同形式角蛋白再生物进行傅里叶变换红外光谱的测试,通过对其酰胺III带的分析,确定在羽毛的再生过程中所得的两种不同形式的降解物(角蛋白溶液和角蛋白凝胶)的二级结构的差异。实验证明:在角蛋白溶液中,α-螺旋占优势,含量在β-折叠之上;而在角蛋白凝胶物中,β-折叠占优势,说明这种结构的角蛋白分子之间更容易生成氢键等物理交联,在一定的环境条件,促使形成致密的角蛋白交联物。该法快速、有效、稳定和敏感,适用于检测还原法羽毛角蛋白再生材料二级结构。
羽毛角蛋白;酰胺III带;α-螺旋;β-折叠
0 引 言
角蛋白是来源最丰富的蛋白之一,包括哺乳动物,爬行动物和鸟类的毛发、羽毛、指甲和角。全球每年产生的废弃角蛋白可达3亿吨,除少部分作为保暖填充材料外,绝大部分被废弃而没有得到充分利用;不仅引起严重的环境污染,而且造成了资源的浪费,同时对于角蛋白的处理涉及到了复杂的环境和经济问题。角蛋白再生材料具有很好的吸水性、柔韧性及生物相容性,在纤维、医药、离子吸附等领域具有很好应用前景。
角蛋白的再生利用与蛋白高级结构(三级及四级)有重要的关系,而蛋白三级及四级结构由二级结构决定。张益奇等[1]研究了汽爆处理对羽毛角蛋白二级结构的影响。Ping Sun等[2]利用1-丁基-3-甲基咪唑氯制成了能够吸收重金属离子的角蛋白颗粒,针对处理前后的角蛋白进行了二级结构的解析。而Pedram等[3]利用尿素、EDTA、巯基乙醇和羟甲基氨基乙烷处理羽毛得到角蛋白海绵和角蛋白纳米颗粒,仅定性分析了两者二级结构的不同。
目前研究蛋白质结构的常用方法有傅里叶变换红外光谱(FTIR)、拉曼光谱、圆二色光谱(CD)、X射线衍射、核磁共振技术、荧光和紫外光谱等,但各有其局限性[1]。相比较之下,FTIR有其独特之处,它没有任何遮蔽效应,不破坏样品的振动分子光谱技术,可提供的蛋白质结构信息丰富。同时,对图谱的去卷积处理可提高光谱的表观分辨率,并保留吸收峰面积[4]。将FTIR与去卷积(Deconvolution)、二阶导数谱(Second derivative spectrum)和曲线拟合(Curvefitting)等数学处理方法结合来研究蛋白质的二级结构,已得到广泛应用。
基于此,本文利用尿素(CO(NH2)2)、偏重亚硫酸钠(Na2S2O5)和十二烷基硫酸钠(SDS)通过还原法将羽毛降解,得到的不可交联羽毛角蛋白和可交联羽毛角蛋白的红外光谱,对蛋白二级结构各形式进行了定量研究,得到角蛋白的二级结构组成含量,为角蛋白能否再生提供进一步研究基础。
1 试样制备与试验方法
1.1 材料
羽毛(杭州萧山新塘霞江羽绒服厂),尿素(分析纯,上海凌峰化学试剂有限公司),偏重亚硫酸钠(分析纯,国药集团化学试剂有限公司),十二烷基硫酸钠(分析纯,国药集团化学试剂有限公司);SHZ-88A往复式水浴恒温振荡器(苏州培英实验设备有限公司),傅里叶变换红外-拉曼光谱仪(Nicolet Nexus 670+Raman Module,美国赛默飞世尔科技公司),冷冻干燥机(LYQQLEST-5,北京贝吉尔生物有限公司)。
1.2 实验方法
1.2.1 还原液的配制
由Kazunori Katoh等[5]的还原法和我们的初期实验[6]证实:偏重亚硫酸钠(Na2S2O5)浓度对角蛋白存在形态起重要作用。改变Na2S2O5的质量浓度配制A、B还原液:其中,尿素6mol/L,SDS 0.05mol/L,还原液A:Na2S2O50.025mol/L,还原液B:Na2S2O50.15mol/L。并在95℃水浴锅中预热加速溶解。
1.2.2 羽毛的降解
将5g烘干羽毛分别加入到50mL上述还原溶液中,置于95℃往复式水浴恒温振荡器中,100r/min震荡20~25min,利用纱布过滤去除残渣,得到羽毛角蛋白降解液A1和B1。
1.2.3 不可交联角蛋白与可交联角蛋白的制备
将A1和B1角蛋白溶液置于室温下15min,B1溶液即可发生交联,成为角蛋白凝胶物B2,而A1仍为液体,为不可交联A2。
1.2.4 FTIR测定
将获得的A2和B2用14KDa的半透膜透析3d,除去小分子盐类等杂质后,将其冷冻干燥,得到角蛋白固体A3和B3。将羽毛和A3和B3分别与溴化钾研磨压片,利用傅里叶变换红外-拉曼光谱仪采集红外谱图,测量的参数扫描范围为400~4000cm-1。
1.2.5 数据分析
用omnic8数据处理软件处理红外原谱,用peakfit4.12处理得到子峰,其残差r2>0.9,确认峰位归属,计算各子峰面积的相对百分含量。
2 实验结果与分析
2.1 不可交联与可交联角蛋白形貌特征
将羽毛加入还原液A和B后,在环境条件为95℃、100r/min中加热震荡得到降解液A1和B1,然后置于室温15min,便获得不可交联液A2和交联的角蛋白B2,图1(a)和图1(b)分别表示A2和B2。
从图1(a)知,不可交联的角蛋白液A2呈黄色透明液;图1(b)是交联角蛋白B2,为白色凝胶状,是比较致密、有弹性、可拉伸的角蛋白弹性体,可以直接作为应用材料。在目前的研究中,角蛋白凝胶能够促使外围神经的快速再生,并且可以与自体神经移植相媲美[7];也可以作为伤口敷料和细胞支架[8];又因为其具有止血的性质,而被开发为止血剂[9]。而A2则可以作为蛋白质原料,进一步加工处理,才能制备成有用的材料。

图1 羽毛角蛋白降解物
2.2 FTIR的测定结果
角蛋白液A2和凝胶角蛋白B2置于冷冻干燥机内干燥,得到粉末状固体A3和含有大量孔隙的块状固体B3。图2为羽毛、A3和B3的红外图谱。
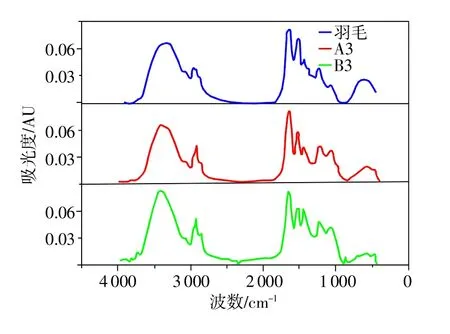
图2 羽毛、A3、B3的红外谱图
酰胺带的归属中,3306cm-1处宽而强的吸收带为N-H和O-H伸缩振动吸收带[1]。肽键的振动都是来自于酰胺I、II、III带,酰胺I带主要是C=O的伸缩振动,与氢键作用力密切相关[10],主要发生在1600~1 700cm-1范围内;酰胺II带主要涉及N-H的弯曲振动和C-H的拉伸振动;酰胺III带主要涉及1 220~1300cm-1范围,是C-N键的伸缩振动以及N-H键在平面的弯曲,还有C-C的拉伸振动和C=O的弯曲振动[2]。另外,1072,1057,1073cm-1对应烷基硫代硫酸盐中对称的S-O的伸缩振动[2]。
酰胺I带的峰归属如下:1613~1637cm-1为β-折叠,1637~1645cm-1为无规则卷曲,1645~1662 cm-1为β-转角,1662~1682cm-1为α-螺旋,1682~1689 cm-1为β-折叠。酰胺III带峰的归属如下:1220~1250 cm-1为β-折叠,1 250~1 270 cm-1为无规则卷曲,1 270~1 295cm-1为β-转角,1 295~1 330 cm-1为α-螺旋[1]。在指认峰的归属时,应该注意:酰胺I带中α-螺旋和无规卷曲相邻较近,峰的确认要注意;但在酰胺III带中α-螺旋和无规卷曲距离较远,易于确认[11]。为了清楚起见,将红外图谱局部放大。图3为3者酰胺I带(1600~1700cm-1)的局部放大图。
从图3可以看出,在羽毛中,其酰胺I带的峰位为1 646 cm-1;在不可交联角蛋白中,其酰胺I带的峰位为1 654 cm-1;交联角蛋白的酰胺I带峰位为1651cm-1。如果蛋白质的二级结构改变,酰氨基谱带的最高点就会发生迁移,酰氨基谱带向低波数迁移说明β-折叠的增加,因此,3者β-折叠的变化依次为先减少后增加。这是因为酰胺I带的氢键作用较强时,C=0的电子云密度低,吸收带偏向1 600 cm-1的较低波数范围内,反之,则偏向1 700cm-1的较高的波数范围内[10]。这个现象也在下面对蛋白质二级结构进行细致分析的时候得到验证。
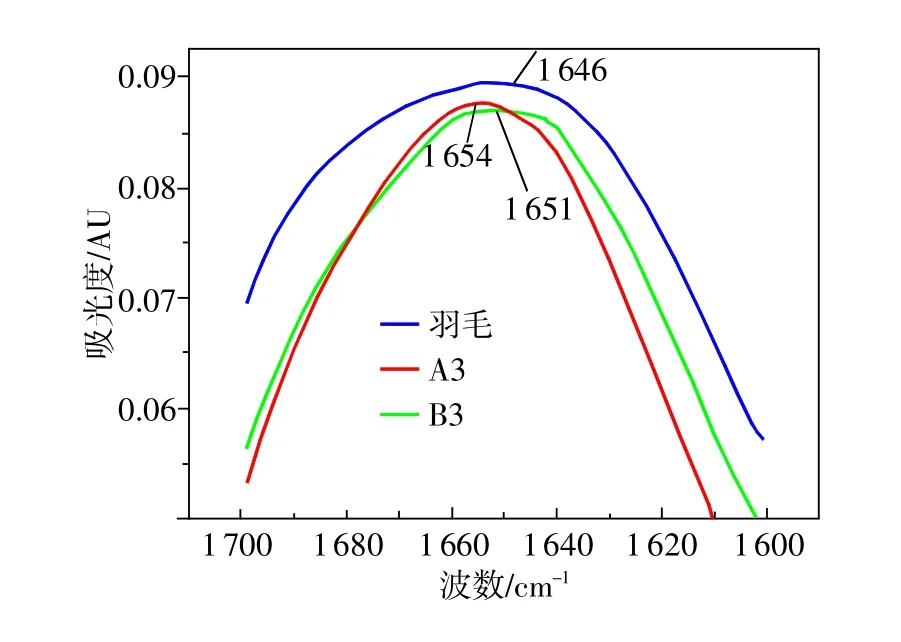
图3 羽毛、A3、B3在酰胺Ⅰ带的红外光谱局部放大图
2.3 不同降解条件下羽毛角蛋白酰胺I和酰胺III带曲线拟合
将图3中酰胺III带的谱图利用omnic8、peakfit4.12进行傅里叶去卷积处理和高斯拟合,结果见图4和表1。
从表1可以看出,破坏羽毛角蛋白的二硫键,发生二级结构的改变,成为不可交联的角蛋白,之后再次发生二级结构的重组。β-折叠的含量由羽毛中占绝对优势的45.2%变化为23.4%和41.5%;α螺旋由最初的15.4%分别变化为41.8%和28.9%;而无规则卷曲在两种不同的变化下,都是呈现增加趋势,由17.5%变为19.6%和23.2%。当角蛋白以溶液形式存在时,肽链以单链形式存在,此时疏水作用明显,以分子内氢键为主,形成螺旋或者折叠的结构,这种构象对剪切相对不敏感;而当形成角蛋白交联物时,肽链更倾向于形成更稳定的分子内氢键,β-折叠含量增多。角蛋白溶液在变为角蛋白交联物的过程中,不稳定的α-螺旋逐渐向更加稳定的β-折叠转变[12-13],促使致密角蛋白交联物的形成。
将酰胺 I带的谱图利用 omnic8、peakfit4.12进行傅里叶去卷积处理和高斯拟合,结果见图5和表2。
在酰胺I带中,所发生的变化与酰胺III带非常类似:β折叠由42.6%变化为28.3%和41.6%,而α螺旋由15.9%变为37.7%和31.3%,与酰胺III带相比,相差均在5%以内。
孙续国等[14]研究认为蛋白在受到外界因素的影响时,会造成蛋白二级结构中β-折叠增多,多个β-折叠部分重合形成微细蛋白纤维,并进一步以SAP为中心形成纤维状结构,成为能够造成组织细胞损坏和功能低下的淀粉样沉积。冯凌凌等[15]在研究外界条件对大豆分离蛋白溶解性影响时认为,适当提高温度会打开蛋白致密结构,改变二级结构,特别是α-螺旋和β-折叠,加强了蛋白与水的作用,从而提高其溶解性。这都与本文所得结果相一致。

图4 角蛋白酰胺Ⅲ带拟合曲线
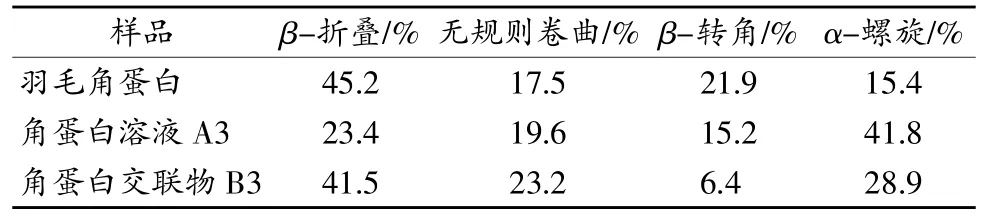
表1 羽毛、A3、B3二级结构比例
3 结束语

图5 角蛋白酰胺I带拟合曲线

表2 羽毛、A3、B3二级结构比例
角蛋白凝胶因其具有止血性,增加细胞的附着和增殖,并且能够调控重要基因的表达而在医学方面得到广泛应用。羽毛的再生过程中,可以得到两种不同形式的降解物,一种以角蛋白降解液的形式存在,另外一种是以角蛋白凝胶的形式存在。为了研究两者差异的原因,本文利用FTIR测定羽毛角蛋白降解再生所形成的角蛋白溶液和角蛋白凝胶的红外光谱,并在软件支持下,对两种再生材料的蛋白质二级结构进行测定计算;证实整个再生的过程中,蛋白二级结构与羽毛再生材料的形态存在对应关系。偏重亚硫酸钠具有调节其形态的作用,在角蛋白溶液中,α-螺旋占优势;而在角蛋白凝胶物中,β-折叠占优势,说明这种结构的角蛋白分子之间更容易生产氢键等物理交联,在一定的环境条件,促使形成致密的角蛋白交联物。
[1]张益奇,赵伟,金妙仁,等.采用FTIR技术研究汽爆处理对羽毛角蛋白二级结构的影响 [J].安徽农业科学,2011,39(10):5933-5934.
[2]Sun P,Liu Z T,Liu Z W.Particles from bird feather: A novel application of an ionic liquid and waste resource[J].Journal of Hazardous Materials,2009,170(2):786-790.
[3]Pedram R Z,Tavanai H,Moradi A.Production of feather keratin nanopowder through electrospraying[J].Journal of Aerosol Science,2012(51):49-56.
[4]王斌,王靖.FT-Raman光谱对蛋白质二级结构的定量分析[J].光谱学与光谱分析,1999,19(5):674-676.
[5]Katoh K,Shibayama M,Tanabe T,et al.Preparation and properties of keratin-poly(vinyl alcohol)blend fiber[J]. Journal of Applied Polymer Science,2004,91(2):756-762.
[6]曹张军.一种利用羽毛制备角蛋白海绵的方法:中国,CN102492166A[P].2012.
[7]Sierpinski P,Garrett J,Ma J,et al.The use of keratin biomaterials derived from human hair for the promotion ofrapid regeneration of peripheral nerves[J].Biomaterials,2008,29(1):118-128.
[8]Blanchard C R,Timmons S F,Smith R A.Keratin-based hydrogel for biomedical applications and method of production:US,09/736957[P].2001-07-26.
[9]Aboushwareb T,Eberli D,Ward C,et al.A keratin biomaterial gel hemostat derived from human hair:Evaluation in a rabbit model of lethal liver injury[J].Journal of Biomedical Materials Research Part B:Applied Biomaterials,2009,90(1):45-54.
[10]顾小红,孟旭,汤坚.豆浆凝固过程中大豆蛋白质二级结构的研究[J].分析科学学报,2007,22(6):675-678.
[11]曹栋,史苏佳,张永刚,等.酰胺I带和酰胺III带测定花生磷脂酶D的α-螺旋和β-折叠含量[J].化学通报,2009,71(11):877-880.
[12]周雪琴,由桂枫,刘东志,等.低聚壳聚糖与角质层蛋白相互作用的体外研究[J].高分子学报,2009(8):781-785.
[13]何文,张冕,代文兵,等.N-三甲基壳聚糖透皮吸收促进作用的初步研究[J].中国药学杂志,2006,41(7):519-522.
[14]孙续国,刘金平.淀粉样沉积诊断方法的研究进展[J].中国煤炭工业医学杂志,2007,10(4):361-362.
[15]冯凌凌,熊犍,李琳,等.pH值对SPC功能性和结构的影响[J].食品科学,2006,27(5):129-133.
The research of secondary structure’s distinction of keratin regeneration materials obtained by reduction
LI Xiang-yu1,YANG Xue-xia2,ZHOU Mei-hua2,CAO Zhang-jun3
(1.Key Laboratory of Science&Technology of Eco-Textile(Donghua University),Ministry of Education,Shanghai 201620,China;2.Chemistry and Chemical and Biological Engineering,Donghua University,Shanghai 201620,China;3.College of Environmental Science&Engineering,Donghua University,Shanghai 201620,China)
A method was established for identifying the secondary structure's distinction of keratin regeneration materials obtained by reduction.In this study,through the analysis of two kinds of different forms of keratin in Fourier transform infrared spectroscopy testing and amide III belt,we can know the secondary structure’s distinction of keratin regeneration materials(keratin solution,keratin solution).Experiments show that in keratin solution,alpha helix predominates,content on beta fold;In keratin jello,beta folding edge,illustrates the structure of keratin easier to produce hydrogen bond between molecules such as physical crosslinking, in certain environmental conditions,to form a dense keratin crosslinking.This method is effective,stable,high sensitive.It is suitable for identifying the secondary structure’s distinction of keratin regeneration materials obtained by reduction
feather keratin;amide III belt;α-spiral;β-fold
O657.39;Q683;Q512+.6;Q591.2
:A
:1674-5124(2014)05-0065-05
10.11857/j.issn.1674-5124.2014.05.017
2014-02-17;
:2014-05-05
国家自然科学基金项目(31000989)
李翔宇(1988-),女,山东德州市人,硕士研究生,专业方向为生物化工。

