凹土负载壳聚糖对马氏珠母贝糖胺聚糖提取物中镉的吸附研究
陈萌萌,吴红棉,衣美艳,范秀萍,郭妍妍,胡雪琼(广东海洋大学食品科技学院,广东湛江524088)
凹土负载壳聚糖对马氏珠母贝糖胺聚糖提取物中镉的吸附研究
陈萌萌,吴红棉*,衣美艳,范秀萍,郭妍妍,胡雪琼
(广东海洋大学食品科技学院,广东湛江524088)
采用凹土负载壳聚糖对马氏珠母贝全脏器的酶解液进行吸附脱镉研究,通过单因素实验,考察了振荡时间、pH、振荡速度和复合物(凹土-壳聚糖)添加量对糖胺聚糖(GAG)粗品中镉脱除和GAG含量的影响,并利用响应面法优化出镉脱除条件。结果表明:糖胺聚糖中镉脱除的最优条件是振荡时间31.0min,pH7.0,振荡速度143.0r/min,复合物添加量13.0mg/mL,在此条件下脱镉率达到76.9%,GAG含量为47.1%。
马氏珠母贝,糖胺聚糖,镉,凹土-壳聚糖
糖胺聚糖(GAG),又称酸性粘多糖或氨基多糖,是贝类体内存在的特征性多糖类化合物,是蛋白聚糖的糖链组成部分[1],现已发现其具有抗凝血、抗肿瘤、抗病毒、降血脂、增强免疫等生理活性[2]。马氏珠母贝(Pinctada martensii)是生产海水珍珠的主要贝种,应用价值广泛,从中提取的生物活性物质GAG更是GAG保健品的重要原料。但是,马氏珠母贝体内重金属镉的含量较高,在贝肉深加工过程中浓缩、提纯等工艺又会导致镉的含量进一步增大[3],相关研究表明,马氏珠母贝糖胺聚糖中较高的重金属镉含量会影响到糖胺聚糖的生理活性[4]。所以,有效降低马氏珠母贝GAG中重金属镉含量的问题亟待解决。目前,关于如何脱除贝类糖胺聚糖中重金属镉的报道并不多。衣美艳等[4]探讨了凹土、凹土-壳聚糖复合物和壳聚糖对糖胺聚糖中镉的吸附效果,发现凹土负载壳聚糖分别较凹土和壳聚糖对糖胺聚糖中镉的吸附有明显提高。因此,本文采用凹土负载壳聚糖对马氏珠母贝GAG中的镉进行有效脱除研究,考察了振荡时间、pH、振荡速度和复合物(凹土-壳聚糖)添加量四个因素的影响。本实验采用响应面设计方案,以脱镉率和GAG含量为响应指标,建立动态数学模型,优选出糖胺聚糖中镉的有效脱除最优条件,从而有效地降低马氏珠母贝糖胺聚糖提取物中重金属镉的含量,为进一步研究开发GAG保健品奠定了基础。
1 材料与方法
1.1 材料与仪器
马氏珠母贝 湛江东风市场;凹土-壳聚糖复合物 广东海洋大学实验室;肝素钠 中国医药集团上海化学试剂公司;枯草杆菌中性蛋白酶 无锡酶制剂厂;胰酶 上海化学试剂公司;硅藻土、活性炭 湛江市林达化玻仪器有限公司;其他试剂 均为分析纯。
AF610A型原子荧光光谱仪 北京吉天仪器有限公司;Z-5000型原子吸收光谱仪 日本日立公司;恒温磁力搅拌器 广州仪科实验室技术有限公司;TDL-5-A型台式离心机 上海安亭科学仪器厂;HH-6型数显恒温水浴锅 国华电器有限公司;722型分光光度计 上海精密科学仪器有限公司;DHG-9245A型电热恒温鼓风干燥箱 上海一恒科技有限公司。
1.2 实验方法
1.2.1 马氏珠母贝糖胺聚糖粗品的制备 参考文献[5]的方法:原料→匀浆→双酶解(0.3%胰酶和0.8%枯草杆菌中性蛋白酶、50℃、4h)→灭酶(煮沸10min)→单层纱布粗虑→脱色(活性炭∶硅藻土=3∶2)→双层纱布精滤→离心(4000r/min,10min)→上清液醇沉(1.5倍95%乙醇,20min)→离心(4000r/min,10min)、去上清液→洗涤→干燥→GAG粗品。
1.2.2 糖胺聚糖含量的测定 采用阿利新蓝比色法,根据参考文献[6]绘制标准曲线。在试管中分别加入
0.2 mL的100、200、400、600μg/mL糖胺聚糖(GAG)标准液,用0.2mL的去离子水代替标准液作为空白对照管,在各管中准确加入3.0mL的阿利新蓝染液,混匀。10min后,于480nm波长处测定吸光度值来绘制标准曲线。
将0.2mL糖胺聚糖标准液改成0.2mL GAG粗品液(0.15g GAG粗品溶于50mL去离子水)加入,方法同上,通过标准曲线求出GAG粗品中GAG的质量。
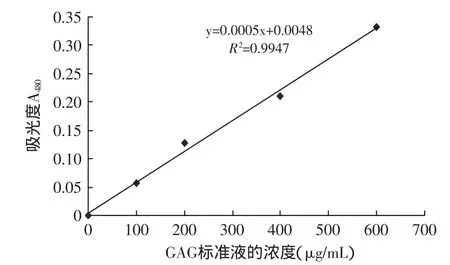
图1 糖胺聚糖标准曲线Fig.1 Calibration curve of GAG
1.2.3 糖胺聚糖粗品中重金属镉含量的测定 参照GB/T 5009.15—1996《食品中镉的测定方法》[7],样品经湿法消化后,用火焰原子吸收光谱法测定镉的含量。
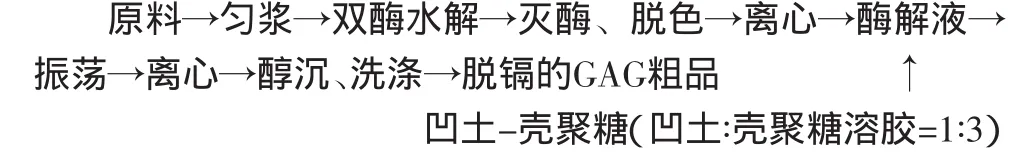
1.2.4 马氏珠母贝GAG粗品中镉脱除的技术路线 马氏珠母贝GAG粗品中镉的脱除是通过将凹土-壳聚糖间接地作用于原料处理后的酶解液里,从而有效降低镉的含量。则其技术路线如下(其操作条件和GAG粗品制备相同):
1.2.5 GAG含量与脱镉率的计算公式

式中:M1:脱镉前GAG粗品中镉含量(mg/kg);M2:脱镉后GAG粗品中镉含量(mg/kg)。
1.2.6 单因素实验 根据大量参考文献和预实验的实验结果,分析得出凹土负载壳聚糖对糖胺聚糖粗品中脱镉影响显著的因素有4个,即振荡时间、pH、振荡速度和凹土-壳聚糖复合物添加量。
1.2.6.1 振荡时间 量取6份20mL酶解液,各缓慢加入0.3g凹土-壳聚糖,调节酶解液的pH为7.0,振荡速度为150r/min,在室温条件下分别振荡5、15、30、45、60、90min。然后离心除杂蛋白,上清液醇沉得GAG粗品,测定其中镉的含量。重复3次。
1.2.6.2 酶解液pH 量取6份20mL酶解液,各缓慢加入0.3g凹土-壳聚糖,调节酶解液的pH依次为3.0、4.0、5.0、6.0、7.0、8.0,在室温条件下振荡30min,振荡速度为150r/min。然后离心除杂蛋白,上清液醇沉得GAG粗品,测定其中镉的含量。重复3次。
1.2.6.3 振荡速度 量取6份20mL酶解液,各缓慢加入0.3g凹土-壳聚糖,调节酶解液的pH为7.0,在室温条件下振荡30min,振荡速度依次为0、50、100、150、200、250r/min。然后离心除杂蛋白,上清液醇沉得GAG粗品,测定其中镉的含量。3次重复。
1.2.6.4 复合物(凹土-壳聚糖)添加量 量取6份20mL酶解液,缓慢加入凹土-壳聚糖依次为0.1、0.2、0.3、0.4、0.5、0.6g,调节酶解液的pH为7.0,在室温条件下振荡30min,振荡速度为150r/min。然后离心除杂蛋白,上清液醇沉得GAG粗品,测定其中镉的含量。3次重复。
1.2.7 响应面分析实验设计 根据单因素实验的结果,以振荡时间(A)、pH(B)、振荡速度(C)和复合物(凹土-壳聚糖)添加量(D)为影响因素,脱镉率和GAG含量为响应指标,根据中心组合设计(CCD)原理,得到4因素5水平的中心组合实验设计方案,因素水平见表1。该设计方案包括24个因素点,其中8个是轴心点(α=±2),6个是中心点的重复实验。并用JMP软件对实验数据进行处理分析,考察凹土负载壳聚糖对GAG粗品中镉脱除的最优条件。
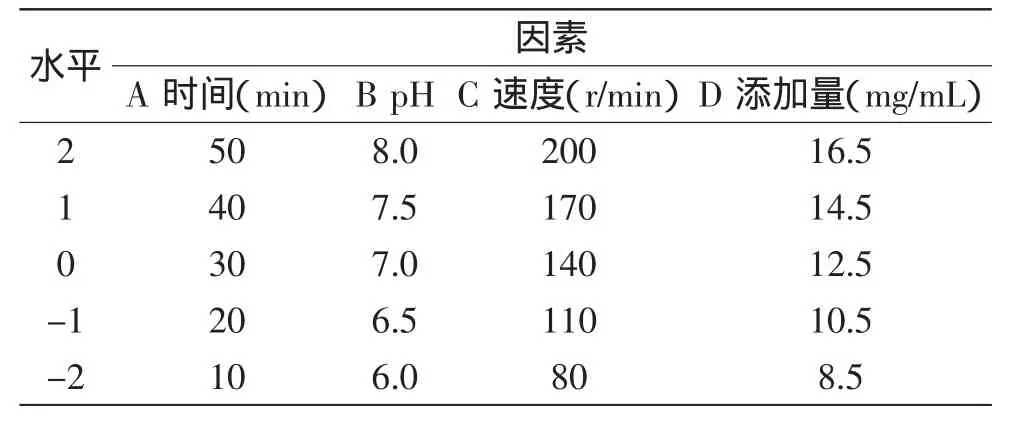
表1 实验因素水平设计表Table 1 Experimental range and levels of the independent variables
2 结果与分析
2.1 GAG粗品中重金属镉脱出条件的单因素实验结果
2.1.1 振荡时间对GAG粗品的脱镉率和GAG含量的影响 经不同时间的振荡处理后,GAG粗品的脱镉率和GAG含量的变化如图2所示。
由图2可以看出,经不同时间的振荡处理后,GAG粗品的脱镉率在0~30min的范围内呈上升趋势,在30min时GAG粗品的脱镉率最大。这可能因为随着吸附反应的进行,凹土-壳聚糖不断与重金属镉离子吸附结合,在30min吸附基本达到饱和。而其随后又有微降,这可能与实验操作、实验条件有关。GAG含量在0~15min范围内呈上升趋势,在15min时,其含量达到最大值,随后其含量逐渐下降,这可能是因为凹土-壳聚糖对镉离子的吸附基本达到饱和后,会吸附部分的糖胺聚糖,从而使GAG含量降低。
2.1.2 酶解液pH对GAG粗品的脱镉率和GAG含量的影响 经不同pH的酶解液处理后,GAG粗品的脱镉率和GAG含量的变化如图3所示。
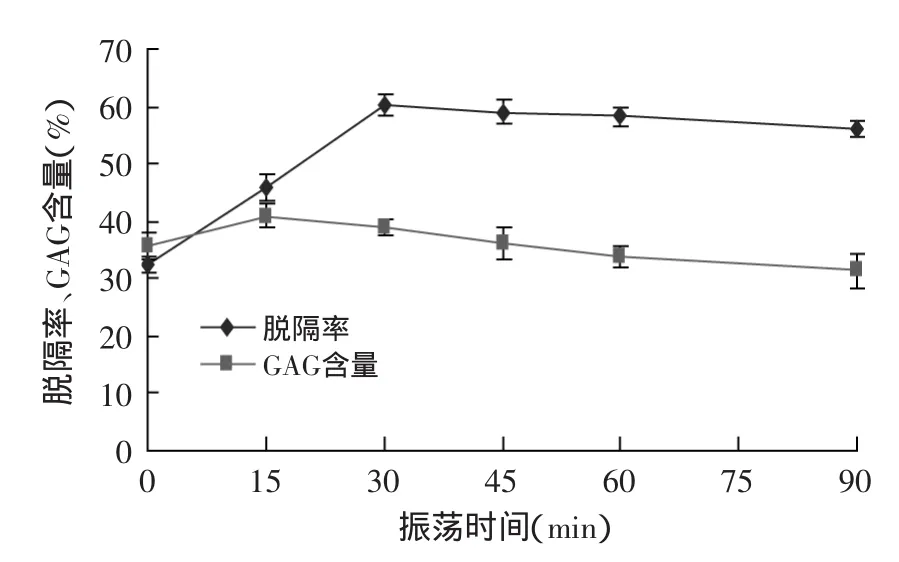
图2 振荡时间对脱镉率和GAG含量的影响Fig.2 Effect of vibration time on the removal rate of cadmium and the yield of GAG
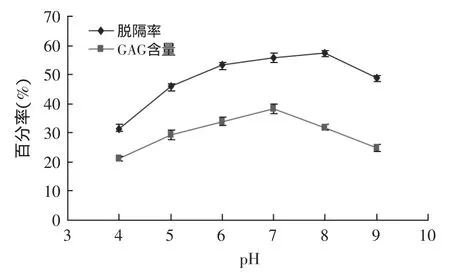
图3 pH对脱镉率和GAG含量的影响Fig.3 Effect of pH on the removal rate of cadmium and the yield of GAG
由图3得知,经不同pH的酶解液处理后,GAG粗品的脱镉率和GAG含量均呈现先上升后下降趋势,但都大于最低pH(pH4)处理的脱镉率和GAG含量。研究表明:在低pH条件下,凹土-壳聚糖复合物中氢离子的质子化过大,严重影响带正电荷的镉离子的靠近,从而降低了其吸附率。随着酶解液pH升高,壳聚糖能把与重金属离子螯合的氨根和氢氧根逐渐游离出来,从而提高了对镉离子的吸附率[8]。GAG含量在pH7时达到最大值,这可能是因为过碱性或过酸性的酶解液均会影响到GAG的提取。
2.1.3 振荡速度对GAG粗品的脱镉率和GAG含量的影响 经不同速度的振荡处理后,GAG粗品的脱镉率和GAG含量的变化如图4所示。
由图4可以看出,随着振荡速度增大,GAG粗品的脱镉率也逐渐增大,在250r/min时达到最大值。这可能是由于振荡速度越快,分子间运动也越快,凹土-壳聚糖与重金属镉离子的接触率增大,进而对镉离子的吸附增强。GAG含量的变化曲线呈现先上升后下降趋势,其中在100r/min时达到最大值,这可能因为振荡速度大于100r/min时会由于振荡速度过快而破坏了糖胺聚糖的结构和组成,从而造成GAG含量的下降。2.1.4 复合物添加量对GAG粗品的脱镉率和GAG含量的影响 经不同添加量的复合物处理后,GAG粗品的脱镉率和GAG含量的变化如图5所示。
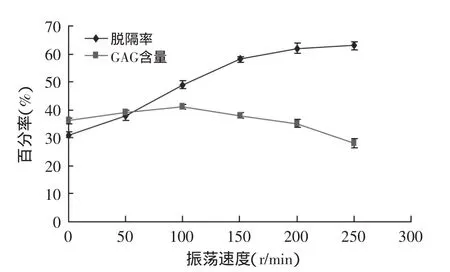
图4 振荡速度对脱镉率和GAG含量的影响Fig.4 Effect of vibration speed on the removal rate of cadmium and the yield of GAG
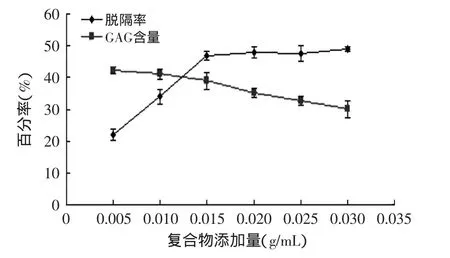
图5 复合物添加量对脱镉率和GAG含量的影响Fig.5 Effect of compound dosage on the removal rate of cadmium removal and the yield of GAG
由图5可知,随着凹土-壳聚糖添加量的增大,GAG粗品的脱镉率也逐渐升高,在0.3g时其脱镉率基本达到稳定,而其随后又有微增,这可能因为再增加用量,对镉的吸附仍会继续的,只是增加不明显。GAG含量在0.010g/mL之前基本没变化,而随着复合物添加量的增加,其呈现下降趋势,可能因为凹土-壳聚糖添加量过量时,会吸附部分的糖胺聚糖。
2.2 响应面法优化糖胺聚糖粗品中镉脱除条件的实验结果
通过JMP软件,GAG粗品中脱隔离和GAG含量的中心组合设计及实验结果见表2。
2.2.1 中心组合设计实验脱镉率的结果分析 由表3可知,模型p<0.0001,说明二次回归模型是极显著的,因此模型选择正确;失拟合p值为0.2776>0.05,说明该模型失拟不显著;相关系数R2=0.9618,说明二次回归模型能够较好地反映响应值的变化,模型与实际实验拟合程度好,预测值和实际值之间具有高度的相关性,可以应用于凹土-壳聚糖对糖胺聚糖中重金属镉脱除的理论预测。
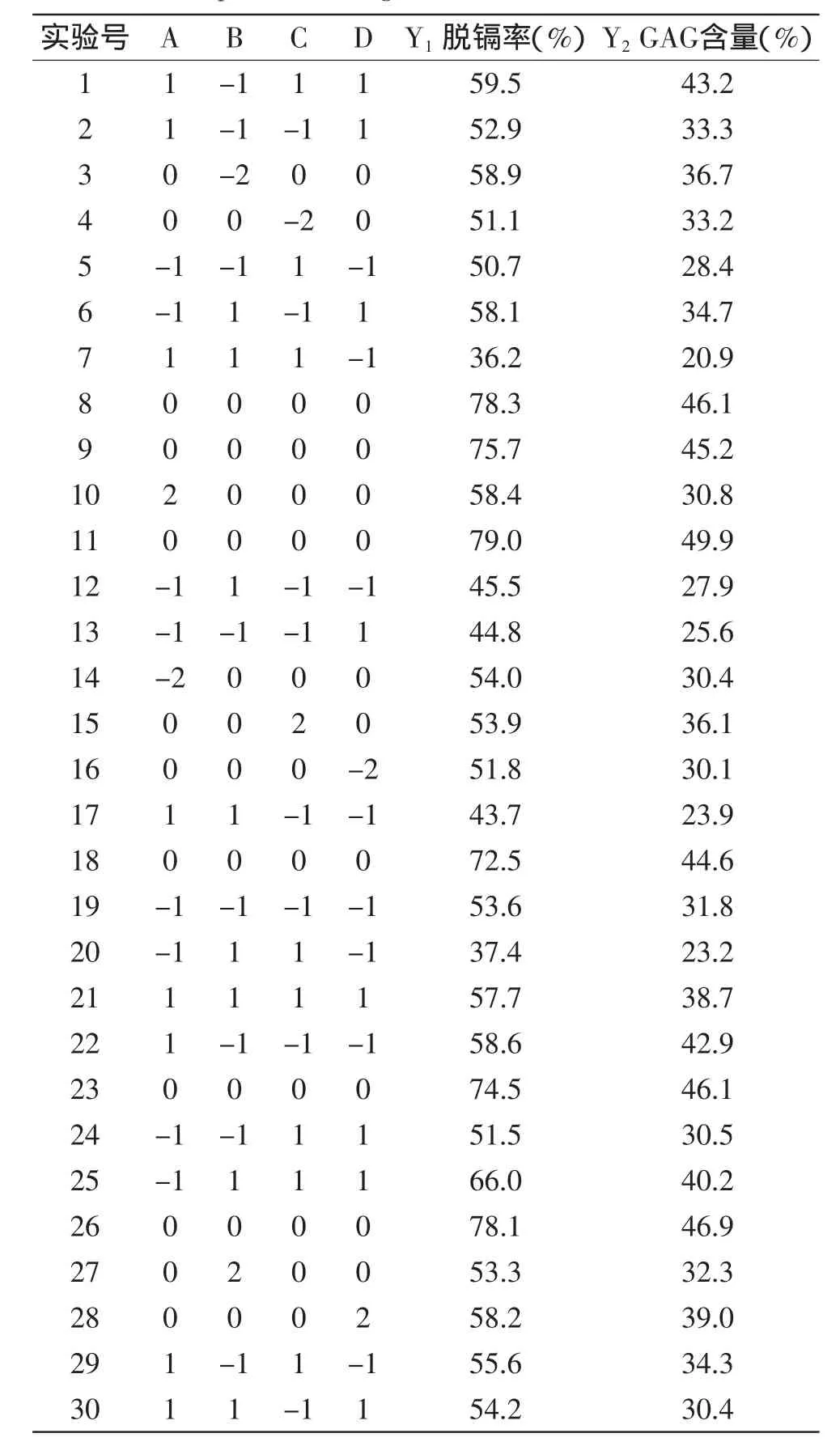
表2 中心组合设计及实验结果Table 2 Experiment design and results of the RSM studies
同时,模型中单因素pH(B)、添加量(D)对脱镉率的影响达到显著水平(p<0.05),各因素对脱镉率的影响顺序为:添加量(D)>pH(B)>时间(A)>速度(C);交互项时间(A)和pH(B)、pH(B)和添加量(D)、速度(C)和添加量(D)之间的交互作用影响显著;二次项时间、pH、速度和添加量对脱镉率的影响也达到极显著水平(p<0.0001)。最终优化回归脱镉率方程(Y1)为:Y1=76.35+0.82A-1.65B+0.37C+3.18D-2.58AB-0.25AC-0.19AD-0.73BC+5.19BD+2.89CD-5.59A2-5.62B2-6.52C2-5.89D2。
根据表3中单因素和交互项的显著性分析,选择影响显著的AB、BD和CD作图观察优化结果条件下脱镉率的变化影响。
由图6~图8的响应面立体图可以看出,响应值脱隔率存在最大值。等高线图也可以看出AB、BD和CD交互的显著程度,圆形表示交互作用不显著,椭圆表示显著。因此,图6~图8的等高线均呈现椭圆型,说明AB、BD和CD的交互作用均呈现显著。
由模拟方程及数据处理四舍五入得:振荡时间为31.0min,pH为7.0,振荡速度为143.0r/min,复合物(凹土-壳聚糖)添加量为13.0mg/mL时,脱镉率最大,且为76.9%。
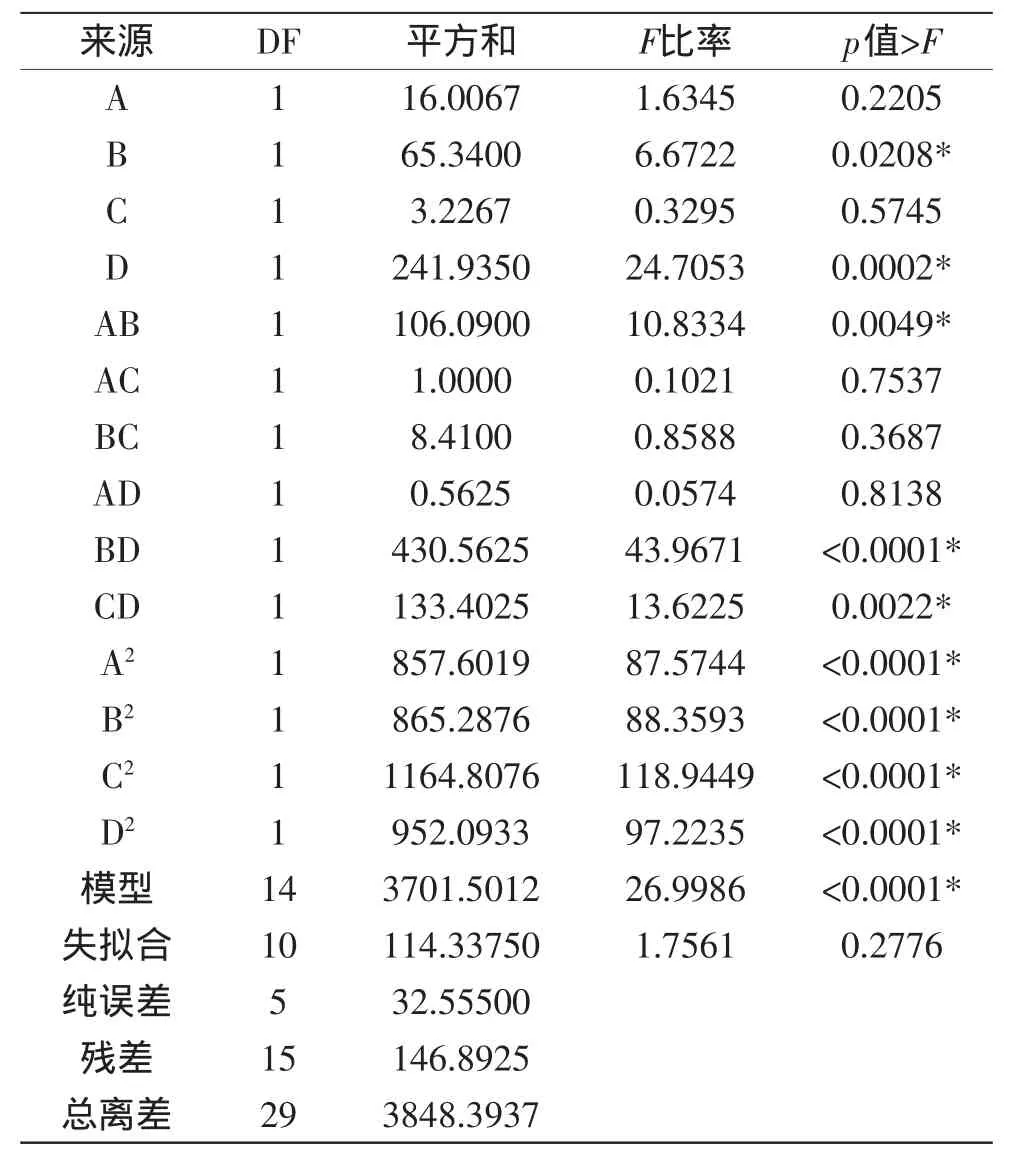
表3 回归统计分析表Table 3 ANOVA for the regression response surface model
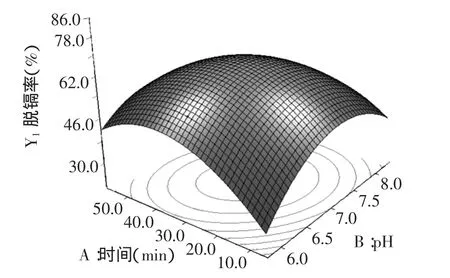
图6 pH和时间的脱镉率响应面Fig.6 Response surface for cadmium removal rate of pH and time
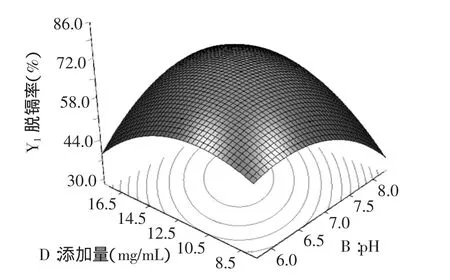
图7 pH和添加量的脱镉率响应面Fig.7 Response surface for cadmium removal rate of pH and dosage
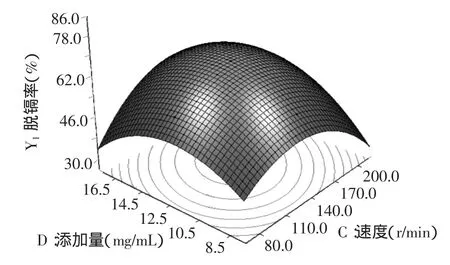
图8 速度和添加量的脱镉率响应面Fig.8 Response surface for cadmium removal rate of speed and dosage
2.2.2 中心组合设计实验GAG含量的结果分析 由表4可知,模型p<0.01,说明二次回归模型是显著的,因此模型选择正确;失拟合p值为0.3717(p>0.05),说明该模型失拟不显著;相关系数R2=0.9626,说明二次回归模型能够较好地反映响应值的变化,模型与实际实验拟合程度好,预测值和实际值之间具有高度的相关性,故此模型可适用于本反应性状的分析。
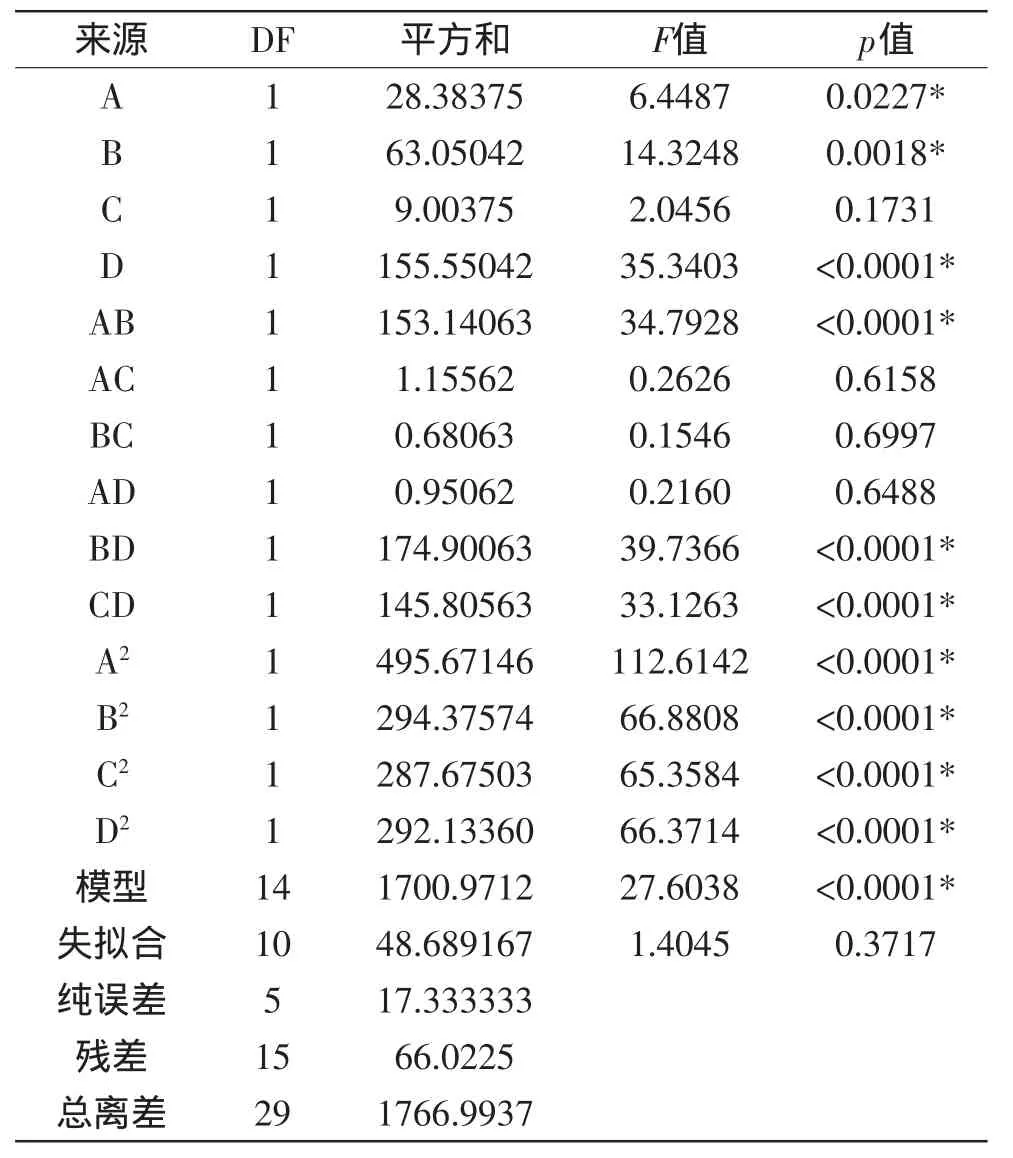
表4 回归统计分析表Table 4 ANOVA for the regression response surface model
同时,模型中单因素时间(A)、pH(B)和添加量(D)对GAG含量的影响达到极显著水平(p<0.0001),各因素对脱镉率的影响顺序为:添加量(D)>pH(B)>时间(A)>速度(C);交互项时间(A)和pH(B)、pH(B)和添加量(D)、速度(C)和添加量(D)之间的交互作用影响显著;二次项时间、pH、速度和添加量对GAG含量的影响也达到显著水平(p<0.05)。最终优化回归GAG含量方程(Y2)为:Y2=46.47+1.09A-1.62B+0.61C+ 2.55D-3.09AB+0.27AC+0.24AD+0.21BC+3.31BD+ 3.02CD-4.25A2-3.28B2-3.24C2-3.26D2。
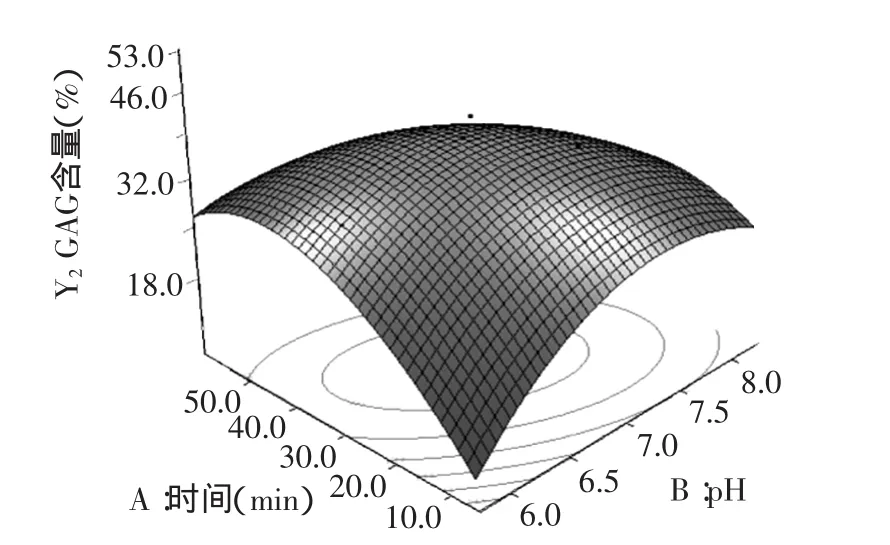
图9 pH和时间的脱镉率响应面Fig.9 Response surface for cadmium removal rate of pH and time
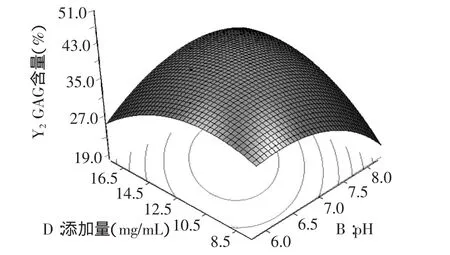
图10 pH和添加量的脱镉率响应面Fig.10 Response surface for cadmium removal rate of pH and dosage
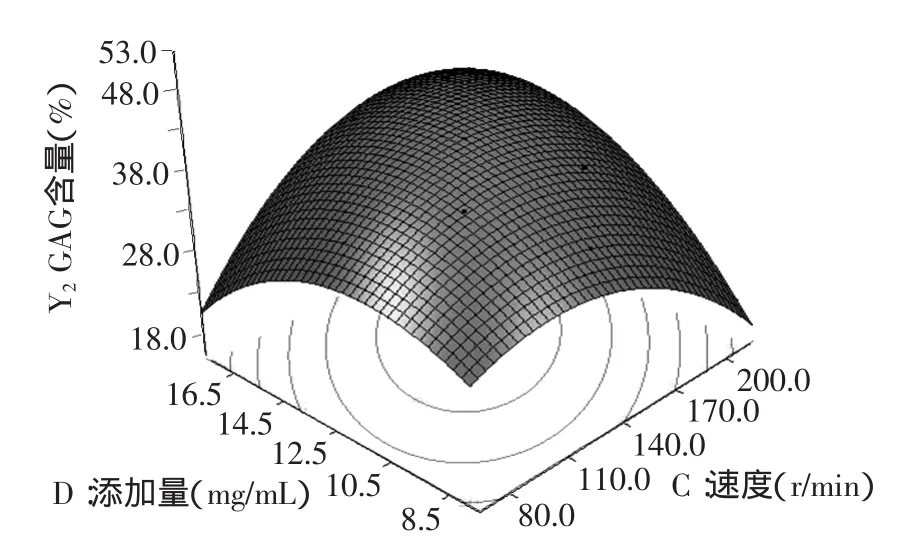
图11 速度和添加量的脱镉率响应面Fig.11 Response surface for cadmium removal rate of speed and dosage
根据表4中单因素和交互项的显著性分析,选择影响显著的AB、BD和CD作图观察优化实验结果条件下GAG含量的变化影响。
由图9~图11的响应面立体图可以看出,响应值GAG含量存在最大值。等高线图也可以看出AB、BD和CD交互的显著程度,圆形表示交互作用不显著,椭圆表示显著。因此,图9~图11的等高线均呈现椭圆型,说明AB、BD和CD的交互作用均呈现显著。
由模拟方程及数据处理四舍五入得:振荡时间为32.0min,pH为7.0,振荡速度为151.0r/min,复合物(凹土-壳聚糖)添加量为13.6mg/mL时,GAG含量最大,且为47.4%。
2.2.3 综合评定来确定GAG粗品中脱除镉的最优条件的确定 由以上数据及方差分析得:脱镉率:因素的影响顺序为:添加量(D)>pH(B)>时间(A)>速度(C);脱镉率最大为76.9%时,振荡时间31.0min,pH7.0,振荡速度143.0r/min,复合物(凹土-壳聚糖)添加量13.0mg/mL。
GAG含量:因素的影响顺序为:添加量(D)>pH(B)>时间(A)>速度(C);GAG含量最大为47.4%时,振荡时间32.0min,pH7.0,振荡速度151.0r/min,复合物(凹土-壳聚糖)添加量13.6mg/mL。
因为本实验研究的是GAG粗品中镉的脱除,因此在保证具有较好脱除镉效果的同时,糖胺聚糖的结构及含量的稳定也是需要考虑的重要因素,结合各因素对评定指标的影响大小及实验目的等多方面综合考虑,又因为马氏珠母贝酶解液中镉含量高达10mg/mL,因此选择脱镉率达到最大值时的条件为最优,即振荡时间为31.0min,pH为7.0,振荡速度为143.0r/min,复合物(凹土-壳聚糖)添加量为13.0mg/mL,此时脱镉率是76.9%,GAG含量是47.1%。经验证实验所得脱镉率为76.6%,GAG含量为47.0%,与理论预测值基本相符。
3 结论
本实验研究了凹土负载壳聚糖对马氏珠母贝糖胺聚糖中镉的脱除影响,以脱镉率和GAG含量为响应指标,利用响应面法确定了糖胺聚糖中脱除镉的最优条件:振荡时间为31.0min,pH为7.0,振荡速度为143.0r/min,复合物添加量为13.0mg/mL,在此条件下脱镉率达到76.9%,GAG含量为47.1%。而且,实验条件相对简单,也不产生二次污染,对糖胺聚糖粗品中GAG含量影响甚微小,GAG中重金属镉的含量有效降低。因此,凹土负载壳聚糖在珠母贝糖胺聚糖中对镉的有效脱除具有一定的应用价值。
[1]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999:78-79.
[2]张豁中,温玉麟.动物活性成分化学[M].天津:天津科学技术出版社,1995:996-998.
[3]Meng G T,Ching K M,Ma C Y.Thermal aggregation of globulin from an indigenous Chinese legume,Phaseolus angularis(red bean)[J].Food Chemistry,2002,79:93-103.
[4]衣美艳.凹土负载壳聚糖对两种贝类糖胺聚糖中镉的吸附作用研究[D].湛江:广东海洋大学,2012.
[5]吴红棉,雷晓凌,洪鹏志,等.珠母贝糖胺聚糖的纯化及其化学性质[J].水产学报,2000,24(6):570-574.
[6]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999:11-12.
[7]食品中镉的测定方法.GB/T 5009.15—1996[S].
[8]郭敏杰,刘振,李梅.壳聚糖吸附重金属离子的研究进展[J].化工环保,2004,24(4):262-265.
Study on adsorption of cadmium in extract of Pinctada martensii glycosaminoglycan by attapulgite-chitosan
CHEN Meng-meng,WU Hong-mian*,YI Mei-yan,FAN Xiu-ping,GUO Yan-yan,HU Xue-qiong
(College of Food Science and Technology,Guangdong Ocean University,Zhanjiang 524088,China)
Absorption of the cadmium of hydrolyzate from Pinctada martensii whole organ by attapulgite-chitosan complex was studied.The effects of vibration time,pH,vibration speed and compound dosage(attapulgitechitosan)of attapulgite-chitosan on cadmium removal rate and GAG yield were investigated through single factor assay,and the conditions of removing cadmium were optimized by response surface method.The optimum conditions of removing cadmium in GAG were 143.0r/min of speed of vibration and pH7.0,processing for 31.0min with 13.0mg/mL dosage of attapulgite-chitosan.Under this condition,cadmium removal rate reached 76.9%,GAG yield reached 47.1%.
Pinctada martensii;glycosaminoglycan;cadmium;attapulgite-chitosan
TS201.1
B
1002-0306(2014)14-0282-06
10.13386/j.issn1002-0306.2014.14.054
2013-10-14 *通讯联系人
陈萌萌(1988-),女,在读硕士研究生,研究方向:海洋生物活性物质研究与开发。
广东省科技厅科技计划项目(2010B020313003)。

