固定化酵母细胞在酱油中的发酵特性研究
王 鑫,韩春然,刘晓飞,马永强,宫安旭(哈尔滨商业大学食品工程学院省高校食品科学与工程重点实验室,黑龙江哈尔滨150076)
固定化酵母细胞在酱油中的发酵特性研究
王 鑫,韩春然,刘晓飞,马永强*,宫安旭
(哈尔滨商业大学食品工程学院省高校食品科学与工程重点实验室,黑龙江哈尔滨150076)
以磁性壳聚糖微球为固定化载体,对固定化酵母细胞的发酵条件进行研究,对影响酵母细胞增殖的主要因素:温度、食盐含量、pH进行分析,以相同时间内还原糖含量为指标,在单因素实验的基础上,利用响应曲面法对反应的发酵条件进行优化。结果表明:固定化酵母细胞最佳条件为温度28.5℃,食盐含量8%,pH6.57,还原糖含量为3.27g/mL。在最佳的发酵条件下应用固定化酵母细胞进行发酵,结果表明其可以有效的增加酱油的香气,提高酱油品质。
固定化,发酵,酱油
固定化细胞在调味品生产领域中应用广泛,如酱油发酵、酿醋、谷氨酸发酵、辣椒素、可乐饮料添加剂咖啡因和食用色素等[1]。酱油生产采用固定化细胞技术能使生产周期缩短,改善酱油风味。我国一般多为酿造酱油,可以分为两大类即高盐稀态发酵工艺酱油和低盐固态发酵工艺酱油。若在低盐固态发酵工艺酱油的过程中添加耐盐酵母或加入酱醪汁,可以显著的改善酱油味的风味,低盐固态发酵工艺酱油中主要在后期的发酵过程中添加酵母细胞[2-3]。日本的Osaki等以海藻酸钙为载体对利用固定化细胞生产酱油进行了研究,得到海藻凝胶、圆柱陶瓷和陶瓷颗粒等3种固定化细胞的产酸能力高于游离细胞,产品风味良好[4-6]。本文将筛选出的酵母菌细胞进行固定化,由于磁性壳聚糖微球固定化的莫格球拟酵母细胞的特殊性,故需要对其发酵的条件进一步的进行摸索,对反应中的温度、pH、盐度进行考察,确定最佳的发酵条件,从而提高酱油的品质,缩短生产周期。
1 材料与方法
1.1 材料与仪器
磁性壳聚糖微球 自制;莫格球拟酵母细胞Torulopsis mogii Vidal-Leir 工业微生物菌种保藏中心;麦芽糖、酱油 哈尔滨正阳河酱油厂提供;硫酸铜、亚甲基蓝 天津市天新精细化工开发中心;酒石酸钾钠、亚铁氰化钾 天津化学试剂三厂。
BS224S电子分析天平 赛多利斯科学仪器北京有限公司;ZHWY-2102C恒温培养箱 上海智城分析仪器制造有限公司;HNY型恒温培养振荡器 天津市欧诺仪器仪表有限公司;HD-920洁净工作台 北京东联哈尔仪器制造有限公司。
1.2 实验方法
1.2.1 磁性壳聚糖微球制备 准确称量1g壳聚糖溶于50mL 5%的乙酸溶液中加入1g磁粉,超声40min,温度30℃使其充分混合。将80mL液体石蜡40℃,乳化30min,将充分混合的壳聚糖与Fe3O4磁粉溶液呈珠状流出,缓缓滴入进入分散介质,10min后加入交联剂,40℃搅拌2h后升温至65℃再继续搅拌2h。反应结束后用石油醚、丙酮、无水乙醇充分洗涤,40℃真空干燥24h,即得到磁性壳聚糖微球[7-8]。
1.2.2 酱油发酵液中还原糖的测定 采用亚铁氰化钾快速法,按国标ZBX66040-87进行测定。
1.2.3 固定化酵母细胞的制备及酱油培养基的制备1.2.3.1 固定化酵母细胞的制备 酵母细胞培养基:葡萄糖100.0g;酵母膏7.0g;(NH4)2SO45.0g;NaH2PO41.0g;MgSO4·7H2O 0.5g;H2O 1000mL。
酵母细胞→活化→振荡、分离(28℃,20r/min,24h)→5× 107CFU/mL对数增长期的酵母细胞→离心(8000r/min,10min)→磷酸缓冲溶液(0.1mol/L,pH7)→5mg/mL菌悬液→备用(4℃)[9-10]。
磁性壳聚糖微球→磷酸缓冲溶液(0.1mol/L,pH7,30mL)→溶胀12h→加入菌悬液→洗涤→湿态固定化细胞→备用(4℃)。
1.2.3.2 酱油培养基的制备 取麦芽糖17mL,生酱油40mL,定容至100mL,灭菌。
1.2.4 温度对固定化酵母细胞发酵性的影响 将在最优条件下固定化好的酵母细胞50mg,分别加入到pH为6.5、食盐含量为8%的100mL的酱油培养基中,分别置于20、24、28、32、36、40℃的培养箱中进行培养36h,发酵完成后将磁性壳聚糖微球与发酵液在磁场下分离,然后测定发酵液中还原糖的含量。比较不同温度对固定化细胞发酵特性的影响。
1.2.5 盐度对固定化酵母细胞发酵性的影响 将在最优条件下固定化好的酵母细胞50mg,分别加入到pH为6.5、食盐含量为8%、10%、12%、14%、16%的100mL酱油培养基中,在30℃下培养36h,发酵完成后将固定化细胞与发酵液在磁场下分离,测定发酵液中还原糖含量。比较不同的食盐含量对固定化细胞的影响。
1.2.6 pH对固定化酵母细胞发酵性的影响 将固定化酵母细胞分别加入到pH为5.0、5.5、6.0、6.5、7.0、7.5的100mL酱油培养基中,在盐度为8%,30℃下培养36h。同样发酵完成后测定发酵液中还原糖含量,比较不同pH对固定化细胞的影响。
1.2.7 响应曲面法优化固定化酵母细胞发酵条件采用Box-Behnken模型,以pH、温度和食盐含量为影响固定化酵母细胞发酵条件的考察因子(自变量),分别以X1、X2、X3表示,并以+1、0、-1分别代表自变量的高、中、低水平,按方程X1=Xi-X0/X对自变量进行编码[11]。其中Xi为自变量的编码值,xi为自变量的真实值,X0为实验中心点处自变量的真实值,X为自变量的变化步长[12],因子编码及水平见表1。

表1 Box-Behnken实验设计因素水平及编码Table 1 Factors and levels of Box-Behnken design
1.3 数据处理
利用Design Expert7.1.1软件进行分析,并采用多元回归分析,拟合二次多项式回归模型的Box-Behnken设计实验,进行结果分析。
1.4 固定化酵母细胞发酵酱油增香成分HEMF的检测
在最优的发酵条件下,将50mg固定化细胞加入到200mL的生酱油中,28℃,发酵72h,将固定化酵母细胞在磁场条件下与发酵液分离,对发酵液进行检测。
2 结果与分析
2.1 温度对固定化酵母细胞发酵性的影响

图1 温度对固定化酵母细胞发酵性的影响Fig.1 Influence of temperature on fermentation characteristics of immobilized yeast cells
温度对酵母细胞发酵特性影响较大。由图1可知,当温度介于20~28℃区间时,酱油培养基中还原糖的含量呈下降趋势,当温度达到28℃时,还原糖的消耗量达到最低,之后随着温度的升高,还原糖的消耗量呈上升趋势。温度对微生物细胞生长、产物合成及代谢的影响是多方面的,不仅可以改变培养基的性质,而且会影响细胞代谢过程中各种关键酶的活性。因此,选择28℃为最适温度。
2.2 盐度对固定化酵母细胞发酵性的影响

图2 盐浓度对固定化酵母细胞发酵性的影响Fig.2 Influence of salt concentration on fermentation characteristics of immobilized yeast cells
由图2可知含盐量越低,酵母细胞利用糖越充分,低渗透压有利于酵母细胞的生长,随着盐分的增加,外界的渗透压增高,酵母菌的增殖受到了影响,使其生长代速较慢,还原糖的消耗率降低,但食盐含量在8%与10%时还原糖的含量相差不多,从中也可说明固定化的莫格球拟酵母细胞具有一定的耐盐性。
2.3 pH对固定化酵母细胞发酵性的影响

图3 pH对固定化酵母细胞发酵性的影响Fig.3 Influence of pH on fermentation characteristics of immobilized yeast cells
由图3可知,pH在6~7之间还原糖的消耗量最多,pH在5~6之间其次,但还原糖消耗量的差别不大,pH=7.5时还原糖的消耗量达到最低,说明pH过高不利于固定化酵母细胞的增殖,影响固定化酵母细胞的正常活性。莫格球拟酵母细胞的最适生长pH在6左右,从图中看出固定化酵母细胞的最适生长pH为6.5左右,略有增加。pH小于6时还原糖的消耗量略有降低,可能是由于固定化酵母细胞在发酵的过程中酵母利用糖类物质,产生了有机酸,使得在发酵过程中,发酵液越来越酸,从而影响了酵母细胞的增殖。
2.4 响应曲面法优化固定化酵母细胞发酵条件
2.4.1 固定化酵母细胞发酵条件的结果方差分析 采用Design Expert 7.0分析软件对实验结果进行二次多元回归拟合,对表3数据进行方差分析后得到模型的二次多项回归方程为:
Y=3.91-2.5×10-3X1+0.29X2+0.14X3-0.030X1X2-0.065X1X30.09X2X3+8.5×10-3X12-0.15X22+0.049X32;
从方程的方差分析表3可见,实验所选用的模型极显著(p<0.01),模型的校正决定系数R2Adj=0.9671,说明该模型能解释96.71%响应值的变化,仅有总变异大约3.29%不能用此模型来解释;相关系数R= 0.9834,说明该模型拟合程度良好,实验误差小,该模型是合适的,可以用此来分析固定化酵母细胞的发酵条件。从表3回归方程系数显著性检验可知,模型一次项X2、X3极显著;交互项X2X3显著;二次项X22极显著。说明各因子之间不是简单的线性关系。各因子响应面交互图见图4~图6。
图4可知,在pH为最佳值6.5时,食盐的含量与温度对固定化细胞发酵条件的交互影响效应。从其响应曲面图可以直观地看出两因素的交互作用较为显著。当温度与食盐含量呈逐渐递减的趋势,发酵液中还原糖的含量逐渐降低,固定化细胞的发酵力就越佳。综合分析,在实验水平范围内,食盐的含量与温度分别在8%和28~29℃范围内时,还原糖含量消耗达到实验中的最小值。

图4 食盐含量、温度及其交互作用对固定化细胞发酵性的响应曲面Fig.4 Influence of salt concentration,temperature and their interactions on the response surface of fermentation characteristics of immobilized yeast cells

图5 温度、pH及其交互作用对固定化酵母细胞发酵性的影响的响应曲面Fig.5 Influence of temperature,pH and their interactions on the response surface of fermentation characteristics of immobilized yeast cells

表3 响应面模型方差分析表Table 3 Response surface model analysis of variance table
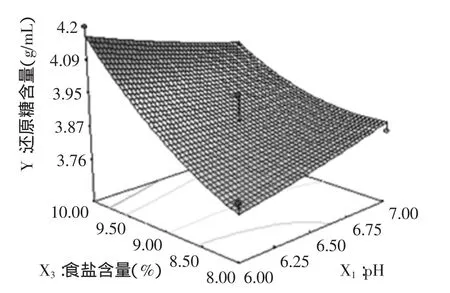
图6 食盐含量、pH及其交互作用对固定化酵母细胞发酵性的影响的响应曲面Fig.6 Influence of temperature,pH and their interactions on the response surface of fermentation characteristics of immobilized yeast cells
由图5可知,在酱油发酵液食盐含量为8%时,温度与pH对固定化酵母细胞发酵性的交互影响效应。从其响应曲面图可以直观地看出,二者之间的交互作用不显著。在实验水平范围内,发酵液中pH对固定化细胞的发酵性影响不大。温度在28~29℃之间时,固定化酵母细胞在发酵液中所消耗的还原糖最多,随着温度的升高发酵液中所剩的还原糖含量逐渐升高。
由图6可知,在发酵温度为30℃时,发酵液中食盐含量与pH对固定化酵母细胞发酵性的交互效应。由图中可以看出两者之间交互作用不显著。但食盐的含量对固定化酵母细胞的发酵性有一定的影响,当发酵液中pH一定时,随着含盐量的增加,还原糖的消化逐渐降低。pH则对固定化细胞的发酵性影响不大,当含盐量一定时,在因素水平范围内,还原糖消耗量基本不变。
通过回归方程求解,固定化酵母细胞最佳条件:pH为6.57,温度为28.46℃,食盐含量为8%,此时理论还原糖含量为3.29g/mL。
2.5 验证实验结果分析
采用响应曲面法优化后的工艺条件,根据实际操作情况,将固定化酵母细胞最佳条件校正为pH6.57,温度为28.5℃,食盐含量为8%,经验证实验表明,还原糖含量可达3.27g/mL。

表4 验证实验Table 4 The results of Verify
2.6 酱油增香成分HEMF的检测结果分析
图7为固定化酵母细胞的酱油挥发成气相色谱图,图中保留时间在9.403min时出现峰,说明在样品中含有HEMF。图8为未添加固定化酵母细胞的酱油挥发成气相色谱图,在HEMF标准品保留时间附近未出现峰,说明此样品中不含有HEMF。说明添加固定化的莫格球拟酵母细胞可以有效的增加酱油的香气。

图7 添加固定化酵母细胞的酱油挥发成气相色谱图Fig.7 GC of soy sauce evaporate by adding immobilized yeast cells

图8 未添加固定化酵母细胞的酱油挥发成气相色谱图Fig.8 GC of soy sauce evaporate by not adding immobilized yeast cells
3 结论
将固定化细胞应用于酱油的酿造过程中,最佳条件为温度为28.5℃,食盐含量为8%,pH为6.57,还原糖含量为3.27g/mL。通过气相色谱分析,固定化酵母细胞所发酵的酱油有HEMF生成,氨基酸态氮含量也高于未添加固定化酵母细胞的酱油,说明添加固定化酵母细胞可以有效的增加酱油的香气,提高酱油的品质。
[1]鲁肇元,唐娟娟.传统工艺与酱油行业的发展[J].中国酿造,2009(11):5-10.
[2]李大锦,王汝珍.提高低盐固态发酵法酱油风味的实用技术(上)[J].中国调味品,2006(7):35-37.
[3]徐鑫煤,陈英文,沈树宝.壳聚糖固定化酶和细胞研究新进展[J].化工科技,2006,14(1):54-57.
[4]石小霞,褚可成,陈志梅,等.固定化细胞技术及应用[J].食品工业科技,2010,31(12):380-383.
[5]李超敏,韩梅,张良,等.细胞固定化技术-海藻酸钠包埋法的研究进展[J].安徽农业科学,2006,34(7):1281-1282.
[6]Kevin J Possman Verstrepen.Immobilized yeast cell systems for continuous fermentation applications[J].Biotechnol Lett,2006,28:1515-1525.
[7]王健,冯玉杰.壳聚糖磁性微球的制备和工艺参数的优化[J].磁性材料及器材,2008,39(6):45-46.
[8]Emir Baki Denkbas,Ebru Kilicay,Cengiz Birlikseven.Magnetic chitosan microspheres:preparation and characterization[J]. Reactive and Functional Polymers 2002,50:225-232.
[9]王健,冯玉杰.磁性壳聚糖微球固定化酵母细胞及其用于发酵生产酒精的研究[J].化学与生物工程,2008,25(8):67-69.
[10]Ehab T,Mansoor A.Enzyme immobilization in novel alginatechitosan core-sell microcapsules[J].Biomaterials,2004,25:1937-1945.
[11]Montgomery D C.实验设计与分析[M].北京:人民邮电出版社,2009:589-592.
[12]李云雁,胡传荣.实验设计与数据处理[M].北京:化学工业出版社,2009:82-109.
Study on fermentation characteristics of immobilized yeast cells in soy sauce
WANG Xin,HAN Chun-ran,LIU Xiao-fei,MA Yong-qiang*,GONG An-xu
(Key Laboratory of Food Science and Engineering,School of Food Engineering,Harbin University of Commerce,Harbin 150076,China)
This paper firstly reported the fermentation characteristics of immobilized yeast cells in soy sauce.The magnetic chitosan microspheres as a carrier of immobilized yeast cells.The consumption of reducing sugar was elected as the indexes in the same time,single factor experiment and response surface methodology of temperature,salt content and pH had been taken out to evaluate the impact of various levels.The result of response surface methodology showed that the best temperature,salt content and pH were 28.5℃,8%,and 6.57,respectively.Calculationshowedthattheconsumptionofreducingsugarwas3.27g/mL.The immobilized yeast cells could increase the aroma effectively and improve the quality of soy sauce at the best fermentation conditions.
immobilization;fermentation;soy sauce
TS201.2
A
1002-0306(2014)12-0192-05
10.13386/j.issn1002-0306.2014.12.033
2013-08-27 *通讯联系人
王鑫(1984-),女,在读博士,讲师,研究方向:食品化学,食品营养与安全。
哈尔滨市科技攻关计划项目(2009AA6BN075)。

