穿山龙水溶性总皂苷对RSC-364细胞分泌MMP-2和MMP-9的影响
段一娜,杨佳琪,王 晶,高亚贤
(承德医学院,河北承德 067000)
穿山龙水溶性总皂苷对RSC-364细胞分泌MMP-2和MMP-9的影响
段一娜,杨佳琪,王 晶,高亚贤
(承德医学院,河北承德 067000)
目的:观察穿山龙水溶性总皂苷对大鼠滑膜成纤维细胞系RSC-364细胞分泌基质金属蛋白酶-2(MMP-2)和MMP-9的影响。方法:应用肿瘤坏死因子-α(TNF-α)和白介素17(IL-17)刺激RSC-364细胞建立类风湿性关节炎细胞模型,并以不同剂量穿山龙水溶性总皂苷进行干预,ELISA法检测细胞培养液上清MMP-2和MMP-9的水平。结果:穿山龙水溶性总皂苷各剂量组(10、20、30mg/L)在不同时间点(24、48、72h)均可明显降低TNF-α和IL-17刺激的RSC-364细胞分泌MMP-2、MMP-9水平的升高,并呈剂量依赖性(P<0.05)。结论:穿山龙水溶性总皂苷可能通过抑制RSC-364细胞分泌MMP-2和MMP-9发挥抗类风湿性关节炎的作用。
穿山龙水溶性总皂苷;类风湿性关节炎;基质金属蛋白酶-2;基质金属蛋白酶-9
类风湿性关节炎(rheumatoid arthritis,RA)是临床常见的慢性炎性自身免疫性疾病,以滑膜增生、骨侵蚀和多关节炎症为基本特征,RA的致残率较高,是造成劳动力丧失的主要病因之一[1]。滑膜炎症伴大量血管翳形成是导致RA骨侵蚀、关节破坏的主要原因。RA进展过程中,异常的血管新生是滑膜增生和血管翳形成的病理基础。调节血管新生的因素很多,包括血管内皮生长因子(vascular endothelial growth factor,VEGF)高表达以及基质金属蛋白酶系统(MMPs)的激活等,其中MMPs的激活对调节血管翳的形成具有重要作用[2-3]。
穿山龙是民间常用的治疗RA的中药,主要成分是穿山龙水溶性总皂苷,但其治疗RA的作用机制不明,相关研究报道较少。本课题组的前期研究发现,穿山龙总皂苷对胶原诱导性关节炎大鼠关节滑膜组织血管内皮生长因子的表达水平具有显著的抑制作用[4]。本研究拟从细胞水平观察穿山龙水溶性总皂苷对RA血管翳形成的关键因子-MMPs分泌的影响,进一步阐明其治疗RA的作用机制。
1 材料与方法
1.1 材料与试剂 大鼠成纤维样滑膜细胞株RSC-364(河北医科大学惠赠),薯蓣皂苷片(主要成分为穿山龙水溶性总皂苷,西安东盛制药厂,批号H20003743),研磨、溶于细胞培养液过滤除菌,-4℃冰箱保存,实验时以细胞培养液稀释至所需浓度。胎牛血清、DMEM(美国Sigma公司),大鼠MMP-2、MMP-9 ELISA试剂盒(美国PEPROTECH公司)。
1.2 方法
1.2.1 细胞培养:大鼠成纤维样滑膜细胞株RSC-364 40℃水浴复苏,用含10%胎牛血清的DMEM培养基制成细胞悬液,调整细胞浓度为2×105/ml,接种于一次性培养瓶中,置于37℃、5% CO2培养箱中培养,隔天换液,传代2次后选用对数生长期细胞进行实验。
1.2.2 加药干预:RSC-364细胞消化后制成2×104/ ml的细胞悬液,接种于6孔板中,每孔2ml。实验分为空白对照组、模型组、穿山龙总皂苷(10、20、30mg/L)组,每组设置6个复孔,置于37℃、5%CO2培养箱中培养。待细胞长满6孔板的80%后,除空白对照组外,其余各组加入TNF-α(10μg/L)和IL-17(10μg/L)共同孵育,继续培养4h后,穿山龙总皂苷组分别加入10、20、30mg/L的穿山龙总皂苷水溶液;分别于干预后24、48、72h收集细胞培养液上清,置-80℃保存。
1.3 检测细胞培养液上清MMP-2和MMP-9的含量 采用ELISA检测,按试剂盒说明书进行操作,酶标仪450nm处检测A值,根据标准曲线计算含量。
1.4 统计分析 数据以均数±标准差表示,采用SPSS 19.0统计软件行重复测量的方差分析。
2 结果
2.1 穿山龙水溶性总皂苷对RSC-364细胞分泌MMP-2的影响 TNF-α+IL-17刺激后,模型组各时间点RSC-364细胞分泌MMP-2的水平明显高于空白组(P<0.05);穿山龙总皂苷3个剂量组各时间点RSC-364细胞分泌MMP-2的水平均明显低于模型组,并呈剂量依赖性(P<0.05)。见附表。
2.2 穿山龙水溶性总皂苷对RSC-364细胞分泌MMP-9的影响 TNF-α+IL-17刺激后,模型组各时间点RSC-364细胞分泌MMP-9的水平明显高于空白组(P<0.05);穿山龙总皂苷3个剂量组各时间点RSC-364细胞分泌MMP-9的水平均明显低于模型组,并呈剂量依赖性(P<0.05)。见附表。
附表 细胞培养上清液MMP-2、MMP-9的含量±s)
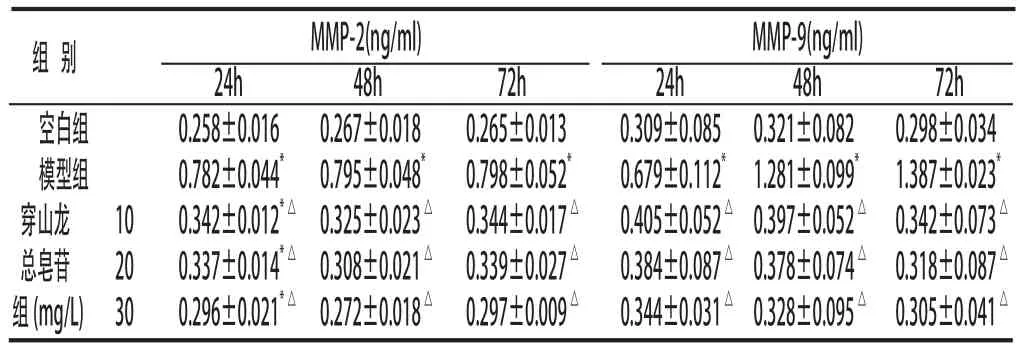
附表 细胞培养上清液MMP-2、MMP-9的含量±s)
与空白组同时间点比较:*P<0.05;与模型组同时间点比较:△P<0.05
组 别 MMP-2(ng/ml) MMP-9(ng/ml) 24h 48h 72h 24h 48h 72h空白组 0.258±0.016 0.267±0.018 0.265±0.013 0.309±0.085 0.321±0.082 0.298±0.034模型组 0.782±0.044* 0.795±0.048* 0.798±0.052* 0.679±0.112*1.281±0.099* 1.387±0.023*穿山龙 10 0.342±0.012*△ 0.325±0.023△ 0.344±0.017△ 0.405±0.052△0.397±0.052△0.342±0.073△总皂苷 20 0.337±0.014*△ 0.308±0.021△ 0.339±0.027△ 0.384±0.087△0.378±0.074△0.318±0.087△组(mg/L) 30 0.296±0.021*△ 0.272±0.018△ 0.297±0.009△ 0.344±0.031△0.328±0.095△0.305±0.041△
3 讨论
RA是一种常见的慢性自身免疫性疾病,病理学基础为关节滑膜慢性炎症病变,病理学特征是滑膜上皮层出现过度增生,上皮下层大量炎性细胞浸润伴有微血管新生、血管翳形成以及对骨组织和软骨的侵蚀破坏。抑制滑膜新生血管形成,阻止血管翳的生长和进一步对软骨和骨的破坏,可能是治疗RA的一种重要方法[5]。Paleolog的研究证实,MMPs是参与血管翳形成及对软骨侵蚀破坏的重要细胞因子[6]。
MMPs是一种分解细胞外基质(ECM)成分的锌蛋白酶[7]。正常生理状态下,MMPs与其天然抑制剂TIMPs保持动态平衡,维持机体组织的降解和更新修复。RA时,炎性因子的刺激可导致MMPs表达升高,引发软骨基质崩解,MMPs对ECM的降解是RA患者关节破坏的必要环节[8]。MMP-2又称为明胶酶-A,可降低ECM中Ⅰ型、Ⅲ型、Ⅳ型、Ⅴ型、Ⅶ型、Ⅺ型胶原和蛋白多糖、粘连蛋白、纤维结合素等的含量,加快ECM的降解。MMP-9又称为明胶酶-B,能降解微血管基底膜及间质成分,可为管腔形成和血管内皮迁移清除基质屏障,是血管新生、血管翳形成的重要前提条件。因此,MMP-2、MMP-9在RA中可能起着重要作用,抑制二者的过度表达可能控制RA病情的发展[9]。
本研究观察了穿山龙水溶性总皂苷对调节RA滑膜血管新生的重要因子MMP-9和参与ECM降解的因子MMP-2分泌的影响,结果发现,穿山龙水溶性总皂苷干预可明显抑制RA滑膜细胞分泌MMP-2和MMP-9,且呈明显的剂量依赖性。本研究表明,穿山龙水溶性总皂苷可通过抑制RA滑膜细胞分泌MMP-2和MMP-9,达到抑制血管新生、减慢血管翳形成的作用,从而减轻MMP-2和MMP-9过度分泌对关节软骨及骨的降解侵蚀作用,发挥对RA的治疗作用,因此提示,穿山龙水溶性总皂苷可能具有抗RA的潜在价值。
[1]古正涛,沈鹰.NF-κB对类风湿性关节炎发病作用的研究进展[J].广东医学,2008,29(9):1576-1578.
[2]Paleolog EM, Miotla JM. Angiogenesis in arthritis:role in disease pathogenesis and as a potential therapeutic target [J] Angiogenesis,1998,2(4):295-307.
[3]Okada Y, Nagase H, Harris ED. A metalloproteinase from human rheumatoid synovial fibroblasts that digests connective tissue matrix components [J]. J Biol Chem, 1986, 26(1): 14245-14255.
[4]董文娟,梁秀军,翟泽玲,等.穿山龙总皂苷对CIA大鼠滑膜血管新生的作用[J].承德医学院学报,2010,27(4):360-362.
[5]Koch AE. Angiogenesis as a target in rheumatoid arthritis [J] Ann Rheum Dis, 2003, 62 (Suppl Ⅱ): 1164-1167.
[6]Paleolog EM. Angiogenesis: a critical process in the pathogenesis of RA: a role for VEGF [J]. Br J Rheumatol, 1996, 35: 917-919.
[7]Giannelli G, Erriquez R, Iannone F, et al. MMP-2, MMP-9 TIMP-1 and TIMP-2 levels in patients with rheumatoid arthritis and psoriatic arthritis [J]. Clin Exp Rheumatol, 2004, 22(3): 335-338.
[8]Gillian M, Vera K, Susan A, et al. Matrixmetalloproteinases in arthritic disease [J]. Arthritis Res, 2002, 4 (suppl 3): S39-S49.
[9]Lu KH, Yang SF, Chu SC. The signi fi cance of altered gelatinase expression in the synovium of patient with arthritic effusions [J] Clin Rheumatol, 2004, 23(1): 21-26.
EFFECTS OF WATER SOLUBLE TOTAL SAPONINS OF DIOSCOREA NIPPONICA ON RSC-364 CELLS SECRETING MMP-2 AND MMP-9
DUAN Yi-na, YANG Ja-qi, WANG Jing, et al
(Chengde Medical College, Hebei Chengde 067000, China)
Objective:To observe the inf l uence of water soluble total saponins of Dioscorea nipponica on rat synovial fi broblast cell line RSC-364 cells secreting matrix metalloproteinases-2 (MMP-2) and MMP-9.Methods:Interleukin-17 (IL-17) and tumor necrosis factor-α (TNF-α) were used to stimulate RSC-364 for establishing rheumatoid arthritis (RA) cell model, then the cell model was intervened by water soluble total saponins of Dioscorea nipponica in different dosage. ELISA was used to detect the MMP-2 and MMP-9 level in cultural supernatants of RSC-364 cells.Results:Water soluble total saponins of Dioscorea nipponica in different dosage at different time point could obviously reduce the level of RSC-364 cells secreting MMP-2 and MMP-9 stimulated by IL-17+ TNF-α, and showed dosage-dependent (P<0.05).Conclusions:Water soluble total saponins of Dioscorea nipponica may play a role in anti-RA by inhibiting RSC-364 cell secreting MMP-2 and MMP-9.
Water soluble total saponins of Dioscorea nipponica; Rheumatoid arthritis; MMP-2; MMP-9
R966
A
1004-6879(2014)03-0189-03
2013-10-07)

