蜜蜂消化道内含物细菌群落组成的PCR-DGGE分析
崔海辉
(浙江育英职业技术学院,浙江杭州 310018)
蜜蜂消化道内含物细菌群落组成的PCR-DGGE分析
崔海辉
(浙江育英职业技术学院,浙江杭州 310018)
通过PCR-DGGE技术研究蜜蜂消化道内含物的细菌群落组成,结合蜜蜂消化道细菌的形态特征,对蜜蜂肠道可培养的细菌进行分类与鉴定,研究分析了春季和夏季2个季节健康的蜜蜂工蜂的肠道菌相区别,同时还比对了春季健康蜜蜂和病蜂肠道菌相的区别。
蜜蜂;消化道;PCR-DGGE;分析
蜜蜂属于昆虫纲膜翅目细腰亚目针尾部蜜蜂总科蜜蜂科(A pi da e)蜜蜂亚科(A pi na e)蜜蜂属(A p i s),是以雌性个体为主的社会性群体生活昆虫,分布于除南北极以外的世界各地[1]。
蜜蜂体内存在的微生物菌相与蜜蜂的营养生理活动有着密切的联系,两者相互依存、互相作用而不可分割,微生物对寄主肠道的消化、吸收、营养、免疫、生物拮抗等很多方面起着重要作用[2-4]。因此微生物的分布及种类直接影响到蜜蜂的健康。中国作为养蜂大国,但国内对健康蜜蜂及病蜂肠道的菌相分析极为少见。因此,开展蜜蜂微生物生态的研究对蜜蜂的养殖、保健和蜂产业的深度开发都有重要意义。
由于自然界中85%~99%的细菌是不可分离培养的[5],因此通过分离纯化培养来鉴定肠道微生物种类,难以真实反映蜜蜂消化道细菌群落组成的实际情况。而随着分子生物学技术的发展,直接抽提样品中总DNA,通过扩增16S r R N A片段和D G G E指纹图谱分离[5-6],可以更加全面地分析微生物群落组成,目前已成为国内外微生物分子生态学研究的常用方法。
本文采用16S r R N A基因克隆文库法,分析冬季和春季健康的蜜蜂工蜂的肠道菌相区别,同时还比对了春季健康蜜蜂和病蜂肠道菌相的区别,为开展蜜蜂肠道微生态研究提供基础性参考资料,也为今后蜜蜂疾病的生物防治提供理论基础。
1 材料与方法
1.1 样品采集
健康活体的蜜蜂工蜂成虫和患爬蜂病的蜜蜂采自浙江萧山市各大养蜂的农场。样品采集时间为春季和冬季,春季时同时采集患有爬蜂病的病体。每次采样时,每个蜂场的取样量为200只左右蜜蜂,采样及运送过程中尽量保持其活力,送至实验室后,立刻取组织进行增菌培养。
1.2 样品总DNA提取
采用B i o s pi n细菌基因组DNA提取试剂盒提取样品中的微生物基因组DNA,提取方法按试剂盒说明书执行,具体操作步骤如下。
收集细菌,取0.5~4.0 m L细菌于最大速度离心1 min,吸弃上清。加入100µLE LBuffer,使用tip头吹打均匀。37℃温育40 min,对部分革兰氏阳性细菌,可将温育时间延长至1 h。加入100µL R S B uf f e r,随后加入PK Solution,充分混匀。于56℃环境中温育15 min,对于难裂解样品可将温育时间延长至30 min。加200µLG AB uf f e r混合均匀,12 000g离心5~10 min。将上清液移至新的1.5 m L离心管,加入400µLB A Buffer,混合均匀。将混合液体转移至Spincolumn,10 000g离心1 min,弃去接液管中液体。向Spin column中加入500µLGB indingB uffer,10000g离心30s,弃接液管中液体。向Spincolumn中加入500µLWash Buffer,10 000g离心30 s,弃接液管中液体。重复该操作1次。再次将Spincolumn于10 000g离
心1 min,并将Spincolumn转移至新的1.5 m L离心管。向Spincolumn中加入50µLE l ut i o n B uf f e r,室温温育1 min,于12 000g离心1 min,弃去Spincolumn,1.5 m L离心管中液体含有DNA。细菌16S r DNAV 3区P C R扩增。
1.3 P C R反应条件
94℃预变性5 min;94℃变性1 min,58℃退火1 min,72℃延伸2 min,35个循环,72℃延伸10 min,15℃保温[7-9]。按照表1所列,在P C R管内加入各种试剂后在P C R仪上进行反应。

表1 P C R扩增体系参数
1.4 DGGE凝胶电泳
1.4.1 丙烯酰胺变性胶配置
采用35%和55%变性胶溶液进行D G G E电泳,具体配置方法如表2,蒸馏水均加至100 m L。

表2 不同浓度变性胶溶液配置
1.4.2 变性梯度凝胶电泳
变性梯度凝胶电泳制胶板的装配参考仪器说明书进行。制胶和上样的具体步骤如下。
取35%和55%变性胶溶液各15 m L,置于2个离心管中,每管加入15µLT E ME D,100µL 10%A P S,迅速混匀,用连有聚乙烯管分别吸取高浓度和低浓度胶溶液。
分别将含有高浓度、低浓度胶溶液的注射器放在梯度传送系统的正确位置并固定好,再将注射器的聚丙烯管用三通管相连。
轻柔并匀速地旋转凸轮来传送溶液,带胶灌满后,小心插入梳子,让凝胶聚合大约1 h。在凝胶聚合过程中,将7 L1 xT A E缓冲液加入电泳槽中,预热到60℃。
凝胶完毕后拔走梳子,将胶放入到电泳槽内,清洗点样孔。
将DNA样品和6 xLoadingB uf f e r以5∶1比例混合,开始上样,上样量为10~20µL。
待电泳溶液温度达到60℃时,开始电泳。在30 V电压条件下,电泳30 min;然后将电压调制150 V条件下,电泳4.5 h。
电泳完毕后用E B染色,然后用Q ua nt i t y0 ne(B i o-R a d)拍照。
1.5 DGGE条带的切割、克隆与测序
对D G G E胶片上的主要条带进行割胶回收DNA,经第2次P C R扩增后,用1.2%琼脂糖凝胶电泳进行检测,然后对所有条带的P C R产物测序(由上海生物工程公司代测)。
2 结果和分析
2.1 16Sr DNAV 3区特征片段DGGE指纹图谱
对D G G E胶片上的主要条带进行割胶回收DNA(条带1-52),经第2次P C R扩增后,用1.2%琼脂糖凝胶电泳进行检测,然后对所有条带的P C R产物进行测序。由于31个条带在割胶回收后,经P C R扩增后浓度太低,无法测序,所以没有得到这31个条带的序列。图1中D G G E图谱条带的数量可反映样品的细菌多样性,条带信号的强弱可反映细菌的相对数量。
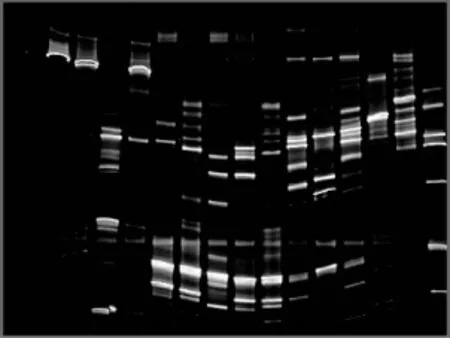
图1 蜜蜂消化道内含物中细菌群落的D G G E图谱
2.2 春夏季健康蜜蜂肠道中细菌群落组成
在春季,健康蜜蜂肠道的主要有乳酸杆菌属、荧光假单胞菌、梭状芽孢杆菌属、γ-变形杆菌属、肠杆菌属;在夏季健康蜜蜂肠道的主要有乳酸杆菌属、荧光假单胞菌、梭状芽孢杆菌属、肠杆菌属、明串珠球菌属、沙雷氏菌属、隆德假单胞菌属、克雷伯氏菌属。
2.3 健康蜜蜂与患爬蜂病、白垩病蜂肠道中细菌种类组成
结合D G G E图谱可知,患有爬蜂病的病蜂肠道中细菌有乳酸杆菌属、梭状芽孢杆菌属、γ-变形杆菌属、肠杆菌属、恶臭假单胞菌属、芽孢杆菌属、大亚湾细菌、明串珠球菌属,而患有白垩病病蜂肠道中细菌有乳酸杆菌属、荧光假单胞菌、明串珠球菌属、肠杆菌属、芽孢杆菌属。
3 小结与讨论
通过将测序所得的16S r DNA的V 3区序列与N C B I数据库中已知的序列进行相似性比较发现,蜜蜂肠道内含物主要有乳酸杆菌属、明串珠球菌属、恶臭假单胞菌属、芽孢杆菌属、大亚湾细菌、梭状芽孢杆菌属、肠杆菌属、荧光假单胞菌、瘤胃细菌属、γ-变形杆菌属、隆德假单胞菌属、沙雷氏菌属、克雷伯氏菌属。该结论与从蜜蜂肠道分离培养并通过生理生化鉴定所得到的结果基本一致[7-9]。
从春季与夏季的健康蜜蜂肠道中细菌群落组成来看,在夏季蜜蜂肠道的细菌种类比春季有所增加,这说明在春夏不同季节的蜜蜂对肠道内细菌群落产生了影响。蜜蜂肠道内细菌菌群结构差异明显。
通过16S r DNA片段的D G G E图谱发现,健康蜜蜂肠道中细菌菌落多样性高于患爬蜂病、白垩病病蜂肠道中细菌多样性。
本研究发现蜜蜂肠道内细菌对蜜蜂个体和群体的健康都有重要意义,蜜蜂肠道细菌生物学功能多样,具有很强的实用性。通过研究,为调节和改善蜜蜂肠道微生态环境构建蜜蜂肠道细菌种质资源库和揭示蜜蜂肠道微生物的种类、作用及进一步探讨其对蜜蜂成虫的生命活动影响奠定基础和提供理论依据。
[1] 金汤东,陈盛禄,钱建华,等.我国蜜蜂疾病发生趋势与防治技术[J].中国蜂业,2007,58(2):23-24.
[2] 颜珣,韩日畴.我国蜜蜂主要病原检测技术[J].昆虫知识,2008,45(3):483-488.
[3] 周婷.从病理学角度谈谈病原微生物与蜜蜂的免疫防御机能[J].中国养蜂,1996(3):12-13.
[4] 崔海辉,杨权兴,李波.利用组合益生菌对蜜蜂无公害蜂病防治技术的研究[J].中国蜂业,2011,62(10):37-39.
[5] 孙晓媛,李影,钱爱东.开发未可培养微生物技术的研究进展[J].微生物学通报,2008,35(5):798-802.
[6] 丁林贤,苏晓梅,横田明.活的但非可培养(V B N C)状态菌的研究进展[J].微生物学报,2011,51(7):858-862.
[7] 杨志波,张绍升.蜜蜂肠道细菌菌群结构及其季节性变动[J].中国蜂业,2010,61(5):11-14.
[8]GilliamM, Valentine DK.Enterobae teria ceaei solated fromfor aging work er honey bees, Apismellifera [ J].JournalofInvertebratePathology, 1974, 23: 38 -41.
[9]GilliamM, PrestDB.Microbiology of feces of the larval honeybee, Apismellifera [ J].JournalofInvertebratePathology,1987, 49: 70 -75.
(责任编辑:张瑞麟)
S 89文献标志码:A文章编号:0528-9017(2014)05-0759-02
2014-01-04
杭州市种子种苗项目(20120332H 09)
崔海辉(1979-),男,副教授,本科,研究方向为食品生物技术,E-mail:c ui ha i hui@s i na.com。
文献著录格式:崔海辉.蜜蜂消化道内含物细菌群落组成的PCR-DGGE分析[J].浙江农业科学,2014(5):759-760,764.

