低温处理对湘莲采后生理变化的影响
王建辉,靳 娜,刘永乐*,王发祥,李向红,俞 健
(长沙理工大学 湖南省水生资源食品加工工程技术研究中心,湖南 长沙 410114)
低温处理对湘莲采后生理变化的影响
王建辉,靳 娜,刘永乐*,王发祥,李向红,俞 健
(长沙理工大学 湖南省水生资源食品加工工程技术研究中心,湖南 长沙 410114)
以新鲜湘莲为原料,于(4±0.1)℃和(25±0.1)℃贮藏条件下,测定湘莲采后水分、蛋白质、可溶性固形物含量(soluble solids content,SSC)、净光合速率、莲壳色差及感官质量变化。结果表明,贮藏温度对鲜莲水分含量、蛋白质含量、L*、a*、b*值及感官质量均具有极显著影响(P<0.01);此外,(4±0.1)℃贮藏期间,SSC的最高点(成熟饱和点)在21 d,较(25±0.1)℃贮藏(6 d)明显推迟;净光合速率从3 d之后持续维持在较低水平,始终居于(25±0.1)℃贮藏之下。由此说明,低温贮藏条件下,鲜莲组织水分散失减慢,蛋白质含量变化减缓,呼吸速率受到显著抑制,从而,大大保留了其营养价值和食用品质,鲜莲货架期延长。
湘莲;采后生理;贮藏温度
莲,睡莲科多年生水生草本植物,我国特色优质资源之一,全国种植面积达150万亩,主要集中在以湖南、湖北、浙江、江西为代表的江南地区。莲子营养丰富,有益心、补肾、健脾、止泻和安神等多重功效[1-4],尤其是鲜莲,较干莲易食、组织细腻、口感酥软、清甜可口[5],是公认老少皆宜的滋补佳品。
鲜莲采收期多集中在高温季节,且采后一段时间内仍具有生命活动,特别是由于呼吸作用的存在,继续消耗体内大量的糖分和水分等营养物质,加速了果实腐烂变质,严重影响了鲜莲的货架期,致使鲜莲常温条件下仅能贮藏3~5 d[6],从而制约了鲜莲产业的发展。研究显示,环境温度是影响果蔬采后生理最为直接的因素,温度过高过低均对果蔬贮藏不利[7-9]。目前市售莲子多以干莲产品为主[10],国内外研究也主要集中于干莲营养价值及莲子系列产品加工等领域[11],而对鲜莲采后生理研究不多,采后不同贮藏温度对鲜莲理化、生理、及感官指标的变化未曾有报道,针对长期以来鲜莲基础研究及深加工技术研究滞后的现状,本研究以新鲜湘莲为研究对
象,着重对4 ℃和25 ℃条件下鲜莲的水分、蛋白质及可溶性固形物含量(soluble solids content,SSC)、净光合速率、莲壳色差变化进行对比研究,旨在为鲜莲采后品质检验与监测以及今后鲜莲保鲜护色研究提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜莲蓬由湖南省湘潭县湘莲种植基地提供。
十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(分析纯) 美国Amresco公司;二硫苏糖醇(dithiothreitol,DTT)(分析纯) 美国Ruibio公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
A TN-300型全自动定氮仪 上海洪纪仪器设备有限公司;索氏抽提仪 四川蜀玻集团有限责任公司;Yaxin-1101光合作用测定仪、Yaxin-GHS-D1呼吸室 北京雅欣理仪科技有限公司;WSC-S测色色差计 上海仪电物理光学仪器有限公司;DHG型电热恒温鼓风干燥箱杭州奥科环境试验设备有限公司。
1.3 方法
1.3.1 鲜莲原料处理
新鲜莲蓬采摘后立即运送回实验室,选取成熟度一致、大小均匀、无病虫害和机械损伤的鲜莲样品。将莲蓬贮藏于相对湿度65%~70%、温度分别为(4.0±0.1)℃和(25±0.1)℃恒温条件下,实验期间按期取样,测定鲜莲各项指标变化。
1.3.2 鲜莲水分含量的测定
按照GB/T 5009.3—2010《食品中水分的测定》方法[12]进行。
1.3.3 鲜莲蛋白质含量的测定
按照刘永乐等[13]莲子蛋白质的提取方法稍作修改。取样当天将莲子去壳去芯研碎,准确称取2.000 0 g,加入3.27% SDS 12 mL和0.2% DTT 12 mL,于pH 12.0、温度30 ℃条件下提取90 min,超声波辅助提取21.5 min,之后8 000 r/min离心10 min,取上清液,重复离心2 次,弃残渣,上清液定容至50 mL,用凯氏定氮法测定不同贮藏期内莲子的蛋白质含量,每个处理3 个平行。
1.3.4 贮藏期间鲜莲SSC的测定
按照曹建康等[14]方法,用WYT型手持糖量计(0~80%)测定不同贮藏温度条件下贮藏期间鲜莲的含糖量,并作适当修改。取样当天待测莲子去壳去芯研钵磨碎,按料液比1∶1(g/mL)混合,匀浆10 s后4 000 r/min离心10 min,取上层汁液测定。折射率在20 ℃时测定,每个处理3 个平行。
1.3.5 鲜莲净光合速率的测定
待测前,将Yaxin-1101光合作用测定仪提前充电,闭路方式调零完毕后,分别选取4 ℃和25 ℃条件下莲子各10 粒,置于呼吸室,待CO2气体体积分数稳定之后,间隔60 s,分别记录下每组样品CO2初始体积分数和终止体积分数,每个样品平行测定8 次,求闭路系统的净光合速率Pn/(μ mol CO2/(m2·s)):

式中:V为叶室容积与样品容积之差/L;Δt为间隔时间/s;Ta为空气温度/K;P为大气气压/MPa;A为样品总面积/cm2;Co为终止时CO2体积分数/(μL/L);Ci为终止时CO2体积分数/(μL/L)。
1.3.6 鲜莲外壳色差的测定
于待测当天,分别选取4 ℃和25 ℃条件下莲子若干,绞碎外壳,均匀平铺于测试盒内,待仪器校正稳定后进行测定,用测色色差计测定莲子壳色泽变化,分别用明度L*,红绿色相a*(+a*表示偏红,-a*表示偏绿),黄蓝色相b*(+b*表示偏黄,-b*表示偏蓝),白度W表示。每个样品重复测定5 次。
1.3.7 鲜莲感官鉴评
参考李伟锋等[15]感官评定方法稍作改动,组织食品专业人士10 人,参考表1的评分标准对贮藏期间鲜莲感官(腐烂率、风味、质感)进行独立评分。根据鉴评小组成员对指标的敏感程度,确定各项权重因子大小,以鲜莲的感官评分平均值为感官综合评定结果。

表1 贮藏期间鲜莲感官质量鉴评标准Table 1 Standards for sensory quality of fresh lotus seeds during storage
2 结果与分析
2.1 贮藏期间鲜莲组织含水量的变化

图1 不同贮藏温度条件下鲜莲组织含水量的变化Fig.1 Effect of storage temperature on moisture content change in fresh lotus seeds
贮藏温度对鲜莲果实组织含水量的影响如图1所示,贮藏温度对鲜莲水分含量影响极显著(P<0.01)。常温(25±0.1)℃环境下,鲜莲水分随贮藏时间散失迅速,贮藏9 d后,鲜莲外形明显皱缩,萎蔫失鲜。贮藏第12天,组织含水量减少至50.23%;而在低温(4±0.1)℃条件下,鲜莲水分整体变化幅度不大,介于75%~85%之间,低温贮藏期间,湘莲水分饱满,能较好地保持新鲜状态。
2.2 贮藏期间鲜莲蛋白质含量的变化
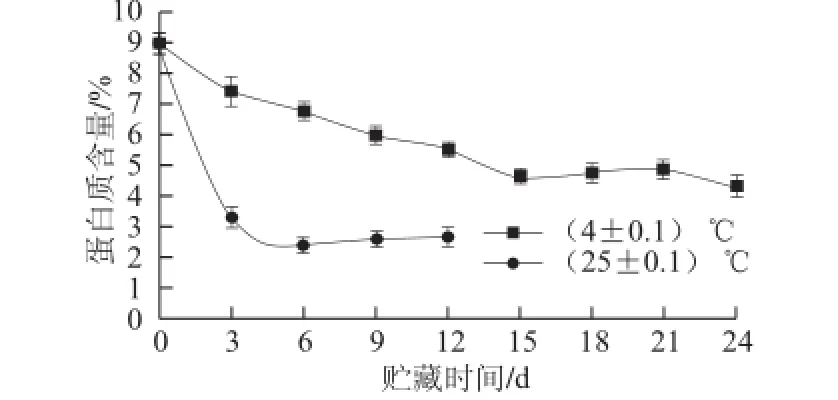
图2 不同贮藏温度条件下鲜莲蛋白质含量的变化Fig.2 Effect of storage temperature on protein content change in fresh lotus seeds
蛋白质是莲子的重要组成部分,同时其含量的下降也是其组织衰老的重要标志之一[16]。不同贮藏温度条件下鲜莲蛋白质含量的变化如图2所示,贮藏温度对鲜莲蛋白质含量变化影响极显著(P<0.01)。随着贮藏期的延长,常温和低温条件下蛋白质含量均呈下降趋势,常温(25±0.1)℃条件下,前3 d蛋白质含量剧烈下降,3 d时蛋白质含量仅为3.31%,较新鲜莲子其蛋白质含量下降63.43%,之后变化不显著。(4±0.1)℃低温贮藏条件下,鲜莲蛋白质下降幅度较常温条件下变化缓慢,由此说明,低温能有效减缓蛋白含量下降,减缓鲜莲组织衰老进程。
2.3 贮藏期间鲜莲SSC的变化

图3 不同贮藏温度条件下鲜莲SSC的变化Fig.3 Effect of storage temperature on soluble solids content (SSC) change in fre sh lotus seeds
口感是否香脆细腻、味道是否甜美适中是消费者对莲子采后品质好坏的主要判断标准。SSC作为各营养物质变化的综合表现,是决定品质的重要因素之一[17]。贮藏期间莲子SSC的变化如图3所示。在低温和常温贮藏期间,SSC变化趋势大体相同,采后鲜莲为了适应新的异己环境,SSC略微降低来抵抗外界的逆境伤害[18],之后SSC缓慢升高,升高一定程度后即达到了莲子最成熟的饱和点[18],常温条件下,莲子最成熟饱和点出现在采后第6天,而低温贮藏可使莲子最成熟饱和点推迟15 d,接着SSC大幅下降。从实验期间的外观来看,常温贮藏6 d后鲜莲逐渐变软,外壳失绿红化,而对低温贮藏鲜莲,此现象出现在21 d之后,与SSC的变化一致,此时莲子接近衰老、果实腐烂,该过程可能与细菌消耗和破坏有关[18]。
2.4 贮藏期间鲜莲净光合速率的变化

图4 不同贮藏温度条件下鲜莲净光合速率的变化Fig.4 Effect of storage temperature on change in net photosynthetic rate of fresh lotus seeds
鲜莲的净光合速率间接反映了莲子的呼吸作用。由图4可知,在贮藏期间,(4±0.1)℃低温和(25±0.1)℃常温条件下,莲子的净光合作用绝对值均逐渐减小,由此可见,莲子呼吸作用逐渐减弱,但趋势各异。(4±0.1)℃低温条件下,莲子从3 d之后均维持在较低水平,即-0.15 μmol CO2/(m2·s)左右。(25±0.1)℃常温条件下,呼吸作用下降趋势平缓,12 d鲜莲净光合速率为-0.2 μmol CO2/(m2·s),小于低温贮藏3 d后鲜莲净光合速率,即常温贮藏期间呼吸作用持续高于低温贮藏水平,鲜莲萎蔫老化,品质变劣。而呼吸强度是反应果蔬 耐贮藏性的一个重要指标[19],由此可见,低温有助于抑制鲜莲呼吸,减少鲜莲营养成分的损失,延长鲜莲的货架期。
2.5 贮藏期间鲜莲外壳色差的变化
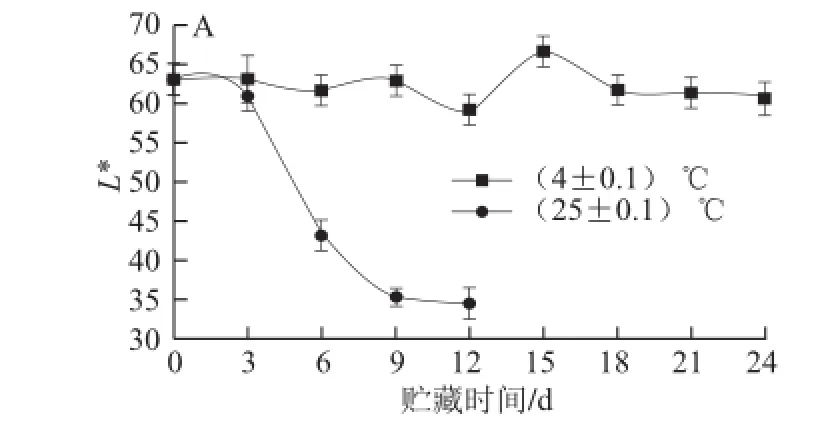

图5 不同贮藏温度条件下莲壳L*值(AA)、a*值( BB)、b*值(CC)和W值(D)的变化Fig.5 Eff ect of storage temperature on changes in L* (A), a* (B), b* (C) and W (D) values of fresh lotus shells
果蔬颜色是果蔬外观指标之一,通过测定果蔬的颜色即可达到检验其品质的目的。同样鲜莲外观也是莲子品质优劣度的重要评价指标[20]。由图5A可知,贮藏温度对莲壳明亮(L*值)变化影响极显著(P<0.01)。(4±0.1)℃低温条件下,莲壳明亮程度变化不大;(25±0.1)℃常温条件下,莲壳随贮藏时间的延长,其外观逐渐变暗,失去光泽。由图5B(a*值)和C(b*值)可知,贮藏温度对莲壳色泽a*值(P<0.01)、b*值(P<0.01)变化均具有极显著影响。(4±0.1)℃低温条件下,随着时间的延长,鲜莲壳偏绿、偏黄程度几乎不变,(25±0.1)℃常温条件下,莲壳偏红程度愈加明显,偏黄程度大幅下降。鲜莲壳白度(W值)变化如图5D所示,贮藏温度对莲壳色泽整体影响(W值)极显著(P<0.01)。(4±0.1) ℃低温条件下,W值变化不明显,(25±0.1)℃常温条件下,W值逐渐下降,贮藏期间W值下降幅度达42.39%。可见,低温有利于维持鲜莲的外观品质,延长其货架期。
2.6 贮藏期间鲜莲感官指标的变化

图6 不同贮藏温度条件下鲜莲感官指标的变化Fig.6 Effect of storage temperature on sensory quality change in fresh lotus seeds

图7 不同贮藏温度条件下鲜莲外观变化Fig.7 Effect of storage temperature on outward appearance change in fresh lotus seeds
如图6所示,贮藏期间鲜莲感官评分总体呈下降趋势,采后莲子清甜可口,新鲜质脆,外表翠绿(图7A)。(25±0.1)℃常温条件下,3 d时外壳失绿,略显菌斑,(图7B2),6 d时红化失鲜,产生异味,质地变软,菌斑迅速增多(图7C2),贮藏9 d后明显皱缩,萎蔫褐变,长毛出水(图7D2、E2)。常温贮藏期间鲜莲感官评分急剧减少。(4±0.1)℃常温条件下,6 d时鲜莲外观几乎无明显变化(图7B1),清甜味感仍在,
15 d时莲蓬外观略显菌斑(图7C1),清甜味减弱,此期间感官评分随贮藏时间的延长降低缓慢,至15 d时感官评分仍属鉴定等级中等最高分值7 分之上。从15 d开始,莲子劣化加快,18 d时莲蓬表面菌斑明显增多(图7D1),质地较15 d时明显变软,之后腐败率、风味、口感等感官品质明显下降(图7E1、F1),感官评分下降加快,贮藏温度对鲜莲感官指标具有显著影响(P<0.01)。整体而言,(4±0.1)℃低温条件18 d时的莲子明显优于(25±0.1)℃常温条件6 d时的莲子,可见,(4±0.1)℃低温条件延缓鲜莲品质劣化,鲜莲感官评分的变化与其他采后生理变化基本同步。
3 结 论
贮藏期间,果蔬水分、营养、色泽等直接关系着其品质的优劣[21-22],不同贮藏温度对湘莲采后生理影响各异,(4±0.1)℃低温条件下,随着贮藏时间的延长,湘莲水分保持75%~85%之间,蛋白质含量、感官质量变化较常温贮藏变化明显变缓,净光合速率从3 d之后持续维持在低水平,莲壳色差变化不显著;相比之下,(25±0.1)℃常温贮藏期间,12 d时组织含水量仅存50.23%,蛋白质含量下降迅速,期间鲜莲的呼吸作用持续高于低温贮藏水平,L*、a*、b*值显著减小,a*持续上升,莲壳外观逐渐变暗,偏红程度愈加明显,偏黄程度大幅下降,鲜莲感官质量急剧变差。综合考虑,鲜莲低温贮藏最佳货架期为0~15 d。由此可见,采后低温处理对鲜莲保鲜至关重要,这与相关研究[23-25]相吻合。对鲜莲进行低温贮藏有利于抑制其呼吸速率,最大程度保留其营养及食用价值,保证鲜莲采后品质,延长其货架期。
[1] 郑宝东, 郑金贵, 曾绍校. 我国主要莲子品种营养成分的分析[J]. 营养学报, 2003, 25(2): 153-156.
[2] BHAT R, SRIDHAR R. Nutritional quality evaluation of electron beam-irradiated lotus (Nelumbo nucifera) seeds[J]. Food Chemistry, 2008, 107(1): 174-184.
[3] WU Jinzhong, ZHENG Yuanbin, CHEN Tiqiang, et al. Evaluation of the quality of lotus seed of Nelumbo nucifera Gaertn from outer space mutation[J]. Food Chemistry, 2007, 105(2): 540-547.
[4] 郑宝东, 郑金贵, 曾绍校. 我国主要莲子品种中三种功效成分的研究[J]. 营养学报, 2004, 26(2): 158-160.
[5] 郑天闻, 徐婷婷, 范亚苇, 等. 莲子多酚氧化酶的酶学性质[J]. 食品工业科技, 2014, 35(2): 162-165.
[6] 汪国超, 徐伟民. 去皮新鲜莲子的保鲜包装与呼吸速率研究[J]. 武汉工业学院学报, 2013, 32(2): 16-18.
[7] JHA S N, CHOPRA S, KINGSLY A R P. Modeling of color values for non-destructive evaluation of maturity of mango[J]. Journal of Food Engineering, 2007, 78(1): 22-26.
[8] ZHUANG H, HILDEBRAND D F, BARTH M M. Temperature inf l uenced lipid peroxidation and deterioration in broccoli buds during postharvest storage[J]. Postharvest Biology and Technology, 1997, 10(1): 19-28.
[9] 王凌云, 杨梦飞, 郑寨生, 等. 不同温度条件对鲜食莲子品质的影响[J].现代农业科技, 2013(12): 296-299.
[10] 曾绍校, 张怡, 梁静, 等. 中国22 个莲子品种外观品质和淀粉品质的研究[J]. 现代工业科技, 2007, 7(1): 74-77.
[11] 郑宝东. 莲子科学与工程[M]. 北京: 科学出版社, 2010:19-20.
[12] GB/T 5009.3—2010 食品中水分的测定[S]. 北京: 中国国家标准管理委员会, 2010.
[13] 刘永乐, 王发祥, 俞健, 等. 响应曲面法优化莲子蛋白质的提取条件[J].长沙理工大学学报, 2012, 9(4): 1-4.
[14] 曹建康, 姜微波, 赵玉梅, 等. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社, 2007: 24-25.
[15] 李伟锋, 何玲, 冯金霞, 等. 生姜提取物对鲜切苹果保鲜研究[J]. 食品科学, 2013, 34(4): 236-240.
[16] BURTON K S, PARYIS M D, WOOD D A, et al. Accumulation of serine proteinase in senescent sporophores of the cultivated mushroom, Agaricus bisporus[J]. Mycological Research, 1997, 101(2): 146-152.
[17] 刘路. 杏果采后生理及贮藏保鲜技术的研究[D]. 石河子: 石河子大学, 2010: 21-30.
[18] 罗颖, 薛琳, 黄帅, 等. 番茄果实可溶性固形物含量与果实指标的相关性研究[J]. 石河子大学学报: 自然科学版, 2010, 28(1): 23-27.
[19] 任文彬, 黎铭慧. L-半胱氨酸与壳聚糖复合处理对鲜切火龙果贮藏效果的影响[J]. 食品科学, 2013, 34(18): 317-320.
[20] 张旻, 罗丽萍, 丁红秀, 等. 新鲜和陈化莲子理化特性的初步比较[J].食品科学, 2009, 30(21): 27-30.
[21] ZENG Rong, ZHANG Ashan, CHEN Jinyin, et al. Postharvest quality and physiological responses of clove bud extract dip on ‘Newhall’navel orange[J]. Scientia Horticulturae, 2012, 138(1): 253-258.
[22] SERRANO M, MARTÍNEZ-ROMERO D, GUILLÉN F, et al. The addition of essential oils to MAP as a tool to maintain the overall quality of fruits[J]. Trends in Food Science & Technology, 2008, 19(9): 464-471.
[23] 郑杨, 生吉萍, 申琳, 等. 采后处理方法对果蔬口感品质的改良研究进展[J]. 食品科学, 2009, 30(13): 276-279.
[24] PAREEK S, YAHIA E M, AREEK O P, et al. Postharvest physiology and technology of Annona fruits[J]. Food Research International, 2011, 44(7): 1741-1751.
[25] 吴日章, 刘丽丹, 曾凯芳. 贮藏温度对新鲜茎瘤芥品质和保鲜效果的影响[J]. 食品科学, 2011, 32(14): 328-332.
Effect of Low Temperature on Postharvest Physiology of Xiang Lotus Seeds
WANG Jian-hui, JIN Na, LIU Yong-le*, WANG Fa-xiang, LI Xiang-hong, YU Jian
(Hunan Provincial Engineering Research Center for Food Processing of Aquatic Biotic Resources, Changsha University of Science and Technology, Changsha 410114, China)
In order to understand the postharvest physiological changes of fresh Xiang lotus seeds, the moisture content, protein content, soluble solids content (SSC), and net photosynthetic rate of fresh lotus seeds (from Xiangtan county, Hunan province) and the color variation of fresh lotus shells were studied at storage temperatures of (4 ± 0.1) and (25 ± 0.1) ℃. The results showed that storage temperature had extremely significant effects on the moisture content, protein content, L*, a* and b* values, and sensory quality of fresh lotus seeds (P < 0.01). The peak level (mature saturation point) of soluble solids was significantly delayed to appear on the 21std of posthavest storage at (4 ± 0.1) ℃, compared to be the 6thd when stored at (25 ± 0.1) ℃. Since the 3rdd of postharvest storage, the net photosynthetic rate of fresh lotus seeds at (4 ± 0.1) ℃remained at a level lower than at (25 ± 0.1) ℃. These results indicate that low temperature (4 ± 0.1) ℃ storage can slow down the water loss and protein degradation in fresh lotus, thus significantly inhibiting the respiration rate. Therefore, low temperature storage can maintain the nutritional value and eating quality at the maximum extent, and extend the shelf life of fresh lotus seeds.
Xiang lotus; postharvest physiology; storage temperature
TS201.2
A
1002-6630(2014)18-0209-05
10.7506/spkx1002-6630-201418040
2014-01-19
“十二五”国家科技支撑计划项目(2012BAD31B08);国家自然科学基金青年科学基金项目(31301564;31201427);湖南省“十二五”重点学科建设项目
王建辉(1980—),男,副教授,博士,研究方向为淡水生物资源开发与功能性食品。E-mail:wangjh0909@163.com
*通信作者:刘永乐(1962—),男,教授,博士,研究方向为食品生物技术与农副产品加工。E-mail:lyle19@163.com

