生姜贮藏期病原菌分离鉴定及精油抑菌效果
刘 继,颜 静,何靖柳,董红敏,郭 菲,熊亚波,黄 影,秦 文,*
(1.成都市农林科学院农产品研究所,四川 成都 611130;2.四川农业大学食品学院,四川 雅安 625014)
生姜贮藏期病原菌分离鉴定及精油抑菌效果
刘 继1,2,颜 静2,何靖柳2,董红敏2,郭 菲2,熊亚波2,黄 影2,秦 文2,*
(1.成都市农林科学院农产品研究所,四川 成都 611130;2.四川农业大学食品学院,四川 雅安 625014)
分离、纯化及鉴定生姜贮藏期病原菌,筛选出对抑制病原菌效果较好的精油并验证该精油抑菌效果。通过分离、纯化及致病性实验得到了病原菌菌株ljr4及ljw2。以病原菌18S rDNA序列进行进化树分析,结果表明该两种病原菌分别属于镰刀菌属及被孢霉属。根据病原菌种属选择了6 种精油进行抑菌性实验,结果发现肉桂精油及百里香精油在用量为2 000 μL/L时对病原菌生长抑制率均为100%。在药敏实验中发现肉桂精油比百里香精油抑菌活性更强。肉桂精油对ljr4、ljw2这2 种病原菌最低抑菌用量分别为64、32 μL/L,最低杀菌用量分别为125、500 μL/L。与未熏蒸生姜相比,在贮藏30 d后肉桂精油熏蒸处理分别使接种ljr 4及ljw2的生姜感病率下降了59.33%和47.33%。肉桂精油作为生姜贮藏前的熏蒸剂有较好的应用前景。
镰刀菌;被孢霉;18S rDNA;肉桂精油;抑菌效果
生姜(Zingiber officinale Roscoe)含有多种烯萜类及酚类物质,独特的风味使其成为亚洲地区的传统调味品,并逐渐被全世界的消费者所接受。目前已知生姜具有降血脂、强心、抗氧化、抗肿瘤、防腐杀虫和护肤美容等多方面的用途[1]。由于其较高的经济价值,我国的生姜种植面积已自2008年的150万亩攀升至2012年的450万亩。姜的食用部分为根状茎,其表面附着的源自土壤 的各种微生物可能导致贮藏期生姜感病,且传统的窖藏、埋藏、井藏等方 法受天气及土壤的影响较大,温、湿度不易调控,为微生物大量生长及繁殖创造了条件。目前关于生姜贮藏期病害及天然杀菌剂的研究较少,缺乏对于针对性用药的指导,这 也是“硫磺熏姜”类事件发生的根本 原因。由于生姜气味浓郁,病害初期很难及时发现,如不能有效预防及控制病害不仅会造成巨大的经济损失,甚至可能会导 致食品安全问题。
在目前关于生姜贮藏期病害的研究中,只有Stirling[2]明确提出尖孢镰刀菌(Fusarium oxysporum)会造成种姜贮藏过程中的腐败,关于生姜贮藏过程的病原菌分离鉴定工作目前进行的较少。由于生姜表皮幼嫩并且在采收过程会引起无法避免的伤口,所以使用的抑菌剂必须是
无毒低残留甚至是无残留的。精油是植物特有的次生代谢产物,主要由萜类、芳 香族类、脂肪族类等化合物的混合物组成,具有抗菌、抗病毒、抗氧化等多种生物活性,是一种重要的天然防腐剂,并且由于其高挥发和低残留特性,在果蔬保鲜事业中拥有广阔的应用前景。
肉桂(Cinnamomum zeylanicum)[3]、百里香(Thymus v ulgaris)[4]、丁香(Syzygium aromaticum)[5]、茶树(Melaleuca alternifolia)精油[6]、山苍子(Litsea cubeba)[7]、罗勒(Ocimum basilicum)[8]都对镰刀菌属(Fusarium sp.)微生物有明显的抑制作用。此外这些植物精油也对其他属的多种微生物有显著的抑菌作用,如肉桂精油对匍枝根霉(R. stolonifer)、黑曲霉(A. niger)、腊叶枝孢(C. herbarum)、灰霉菌(B. cinerea)、炭疽菌(C. coccodes)有良好的抑制作用[3]。
本实验拟对从感病生姜表皮分离到的微生物进行纯化,将纯化后的微生物接种于健康生姜进行致病性实验。对确定为病原菌菌株的18S rDNA保守序列测序,通过该保守序列的进化树分析确定病原菌种属。以病原菌种属为依据,选用百里香、肉桂、丁香、罗勒、茶树叶精油作为杀菌剂进行抑菌性实验、药敏性实验及活体抑菌实验。本研究旨在为生姜贮藏期杀菌剂选择提供理论依据。
1 材料与方法
1.1 材料与试剂
莱芜大姜分别购自四川国际农产品交易中心及高水蔬菜批发市场,病原菌分离材料为贮藏期感病生姜,致病性实验及活体抑菌实验材料为健康生姜。
供试精油分别提取自百里香(Thymus vulgaris)叶、丁香(Syzygium aromaticum)叶、肉桂(Cinnamomum zeylanicum)皮、山苍子(Litsea cubeba)果实、茶树(Melaleuca alternifolia)叶、罗勒(Ocimum basilicum)叶江西吉安盛大香料油公司;不透气封口膜 美国Omega公司;UNIQ-10柱式真菌基因组抽提试剂盒、UNIQ柱式DNA胶回收试剂盒 上海生工生物工程有限公司。
沙堡弱培养基(sabourand’s agar,SDA)配方(每1 000 mL):葡萄糖40 g、蛋白胨10 g、琼脂12 g,pH (6.5±0.2)。营养肉汤培养基(nutrition agar,NA)配方(每1 000 mL):蛋白胨10 g、牛肉粉3 g、氯化钠5 g,pH(7.2±0.2)。
1.2 仪器与设备
DNP-9272型生化培养箱 上海精宏实验设备有限公司;YXQ.SG41.280手提式压力蒸汽灭菌器 上海华线医用核子仪器有限公司;SW-CJ-1F洁净工作台苏净集团安泰公司;PHS-3C型数显酸度计 中国雷磁分析仪器厂;BR4i型高速冷冻离心机 美国Thermo Electron公司;3730测序列分析仪 美国Applied Bio Systems公司;DYY-8型稳压稳流电泳仪 上海琪特分析仪器有限公司;Gene Genius Bio Image凝胶成像系统英国Syngene公司;PCR反应扩增仪、移液器(范围100~1 000、20~200、0.5~10 μL) 加拿大Bio Basic公司;U-3010紫外-可见分光光度计 日本Hitachi公司。
1.3 方法
1.3.1 病原菌分离
选择被微生物侵染、带有明显腐烂痕迹的生姜茎块,使用体积分数70%乙醇溶液进行表面消毒后,以清水冲洗,将患病组织切割成面积为5 mm×5 mm×3 mm(长×宽×厚度)的小块,放置于研钵,加入1 mL无菌蒸馏水捣碎后分别划线接种于SDA培养基及NA培养基,继续以SDA和NA培养基纯化各菌株,至连续3 次纯化过程无其他菌落出现。
1.3.2 致病性测试
参照Vero等[9]的方法将纯化后的微生物接种于生姜上,微生物接种量为2×105CFU/mL。将接种不同微生物的茎块分别装入不同的PE袋中并密封,共3 个重复组,每组16 块茎块分别装于4 个PE袋,所接种生姜于28 ℃,相对湿度90%条件下存放10 d。以上述方法分离发病部位微生物,并与该组接种的微生物对比,如果形态学鉴定一致则确定为病原菌。
1.3.3 病原菌18S rDNA序列分析
测定已确定病原菌的18S rDNA序列,通过进化树分析确定病原菌种属,并以此为精油种类的选择提供依据。测序所用菌丝于28 ℃条件下预先培养5 d,DNA的提取参照Bargues等[10]的方法,18S rDNA序列PCR扩增引物如下:
NS1(5’-GTAGTCATATGCTTGTCTC-3’)
NS6(5’-GCATCACAGACCTGTTATTGCCTC-3’)
PCR反应参照Zhao等[11]的方法,18S rDNA片段测序由ABI PRISM 3730 DNA测序仪完成。所获得序列提交GenBank并使用BLAST(basic local alignment search tool)在GenBank进行比对。收集相关菌种的18S rDNA序列,以MEGA5.2构建进化树,大致确定病原所属种属,为有针对性的选择抑菌剂提供依据。
1.3.4 精油抑菌效果实验
根据病原菌鉴定结果,确定了以百里香、丁香、肉桂、山苍子、罗勒、茶树等植物中提取的精油作为供试抑菌剂,所选取供试精油已被报道对分离鉴定的病原菌同属微生物中一种或几种有抑制作用。精油抗菌活性实
验方法参照Singh等[12]报道的污染食物技术,所有精油用量均为2 000 μL/L,全部处理均重复3 次。接种3 d后使用游标卡尺测量菌落直径,以在未加入精油的培养基上生长的同种菌正常菌落为对照,计算抑菌率。计算公式如下:

式中:dc为对照组菌落直径平均值/mm ;dt为处理组菌落直径平均值/mm。
1.3.5 药敏性实验
为了进一步测试对病原菌抑菌效果较好的几种精油的最低抑菌用量,将各种病原菌菌悬液50 μL(2×105CFU/mL)加入平板中,于30 ℃条件下培养6 h。待水分蒸发后将140~1 μL(熏蒸用量2 000~16 μL/L)的精油均匀涂抹至培养皿。关闭培养皿并以不透气膜封口,标记为X-2 000至X-16。其中X为精油简写,每个用量设置为上一用量1/2,于30 ℃条件下培养4 d后观察菌落生长情况。以无菌落生长的最低用量作为该精油对该种病原菌的最低抑菌用量(minimal inhibitory concentration,MIC)。
确定MIC以后,取出大于MIC处理的所有平板,以1 mL灭菌水冲洗其培养基表面,将洗液转移至无精油的培养皿中,标记为R-2 000至R-A。R表示该测试主要以病原菌能否恢复生长来衡量病原菌是否死亡,A为该精油对该菌MIC。从以上R-2 000至R-A每组取任意一只培养皿,再次加入50 μL(2×106CFU/mL)对应菌悬液作为对照组,于30 ℃条件下培养4 d后观察菌落生长情况,以对照组正常生长,处理组菌落数小于5的处理用量为最低杀菌用量(minimal fungicidal concentration,MFC)。
1.3.6 活体抑菌实验
以药敏实验中对病原菌MIC及MFC较小的精油进行活体抑菌实验。熏蒸处理前2 d,将每种病原菌分别接种于健康的生姜,参照Vero等[9]的方法,接种微生物数量为2×105CFU/mL。在温度25 ℃、相对湿度90%培养箱中培养。熏蒸处理用量为所使用精油的最低杀菌用量,熏蒸在12 ℃、相对湿度90%恒温恒湿培养箱中进行,精油使用放置于培养箱中的电热板进行加热,处理时间为3 d。熏蒸完成后,将生姜放置于避光的空气流通处使残余精油挥发,分别以接种不同病原菌后未进行熏蒸处理的生姜为对照。接种ljr4的茎块以切开接种部位后能够观察到接种组织附近有红色病斑为衡量发病的标准;接种ljw2的茎块以接种部位及周围能够观察到白色菌丝为衡量发病的标准,于处理完成后10、20、30 d统计发病率。
2 结果与分析
2.1 病原菌分离及鉴定
本实验从贮藏期腐败、霉变的生姜中分离出了4 种真菌及3 种细菌。在病原菌测试中,从生姜的发病部位分离得到的微生物中有2 种与原接种微生物一致。在接种的其他处理中也分离得到该2 种微生物分别标记为ljr4及ljw2,30 ℃培养4 d后其菌落形态如图1所示。
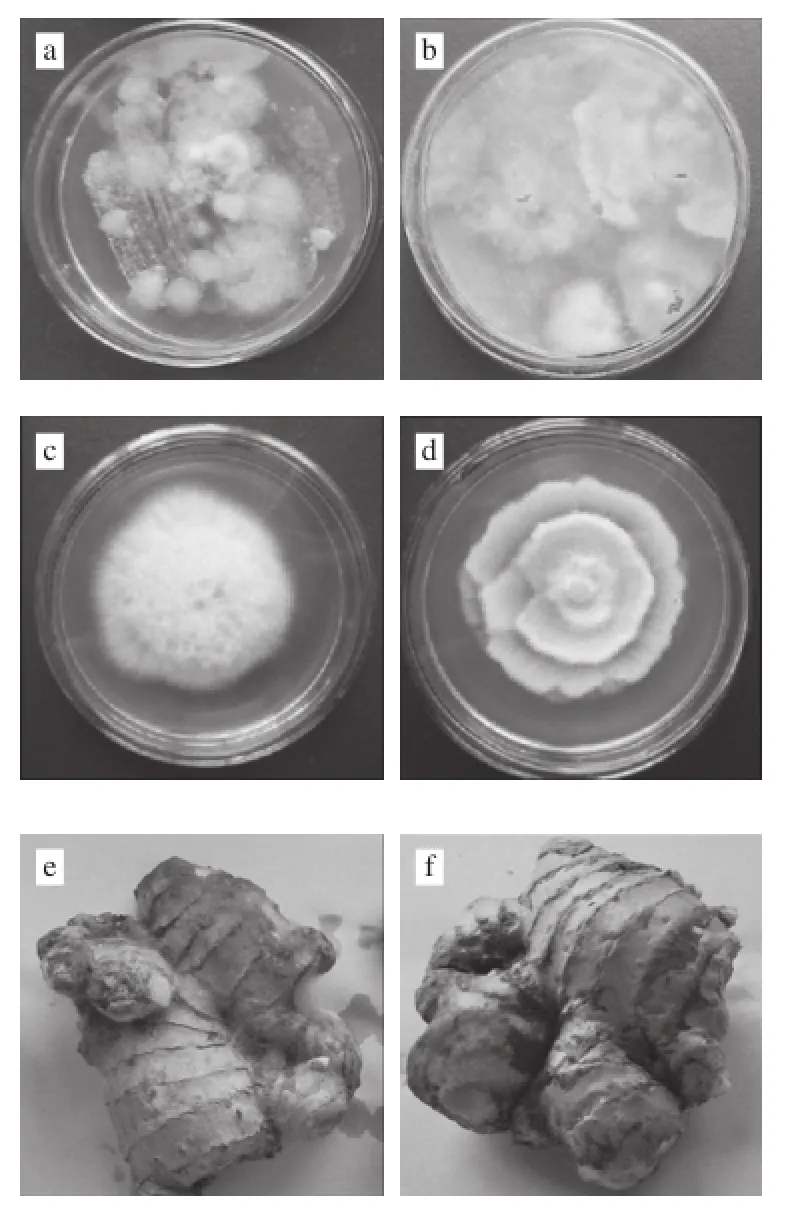
图1 生姜贮藏期病原菌分离、菌落形态及发病症状Fig.1 Pathogen isolation, colony morphology, and pathogenicity test
ljr4菌落近圆形,单菌落能扩展至直径9 cm,边缘不规则,菌落正面白色至4 d后为粉红色,菌落反面培养初为淡黄色4 d后为粉红色,菌丝为树枝状无隔长菌丝,被感染生姜初期茎块外层组织能观察到粉红色斑点,较不明显,后期表皮呈深红色至褐色可观察到少量菌丝,菌丝长而稀疏。
ljw2菌落近圆形,莲花状,单菌落能扩展至直径7 cm,边缘缺刻,菌落正面为白色,背面为淡黄色,菌丝为鹿角状有隔菌丝,被感染生姜茎块上明显可见白色菌丝,菌丝短而致密。
18S rDNA序列分析结果表明,2 种病原菌与镰刀菌属及被孢霉属微生物保守序列相似度最高。该2 种病原菌的18S rDNA序列NCBI登录号分别为:KC833484.1及KC833483.1。
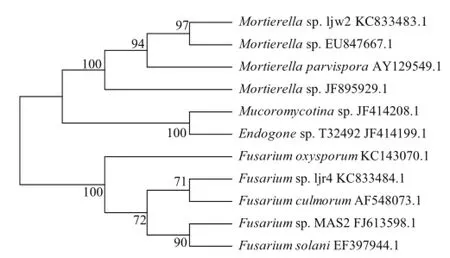
图2 Mortierella sp. ljw2、Fusarium sp. ljr4和相关菌株的系统进化树Fig.2 Phylogenetic tree of Mortierella sp. ljw2, Fusarium sp. ljr4, and their relative strains
进化树分析(图2)显示,该两种病原菌分别与Fusarium culmorum及Mortierella parvispora具有最高的同源性。ljr4菌株与黄色镰刀菌(Fusarium culmorum)亲缘关系较近,与尖孢镰刀菌(Fusarium oxysporum)及腐皮镰刀菌(Fusarium solani)亲缘关系较远。ljw2菌株与被孢霉属亲缘关系较近,与毛霉菌(Mucoromycotina sp.)及内囊霉(Endogone sp.)亲缘关系较远。
2.2 不同精油抑菌效果对比
本实验选择已经报道的对镰刀菌属微生物有较好抑制效果的精油进行抑菌性实验。

表1 精油对病原菌菌丝生长的抑制率Table 1 Inhibition rates of toxic media on mycelial growth of pathogenic fuunnggii %
如表1所示,百里香和肉桂精油在2 000 μL/L用量下对两种病原菌生长的抑制率为100%,该用量下丁香和罗勒精油对ljr4抑制率为100%,但对于ljw2的抑制率分别为54.89%和60.03%,抑菌效果不明显。山苍子及茶树精油在该用量下对两种病原菌都有一定的抑制作用,但不能达到抑制率100%的效果,且对ljw2的抑制效果显著低于其他精油。
2.3 药敏性实验

表2 肉桂精油及百里香精油对病原菌的MIC及MFCTable 2 Minimum inhibitory concentration (MIC) and minimal fungicidal concentration (MFC) of thyme and cinnamon essential oil on pathogenic fungi
如表2所示,百里香对镰刀菌及被孢霉的MIC分别为64和250 μL/L,其对ljw2的熏蒸处理MFC为2 000 μL/L。与百里香精油相比,两种病原菌都对肉桂精油熏蒸处理更为敏感,肉桂精油对ljr4和ljw2的熏蒸MIC分别为64 μL/L和32 μL/L,熏蒸MFC分别为125 μL/L和500 μL/L。
肉桂及百里香精油对ljr4的MIC均为64 μL/L,但肉桂精油对ljw2的MIC仅为百里香的约1/8。肉桂及百里香精油对ljr4的MFC分别为125、250 μL/L,肉桂精油对ljw2的MFC为500 μL/L,为百里香精油的1/4。由此可见,肉桂精油熏蒸处理对ljr4和ljw2效果优于百里香精油。
2.4 活体抑菌实验
离体条件下肉桂精油熏蒸处理对ljr4及ljw2菌株的最低杀菌用量分别为125 μL/L和500 μL/L。如图3所示,在整个贮藏过程中,经过熏蒸处理的A组和C组感病率都小于未处理的B组和D组(P≤0.05,n=3)。在活体实验中接种ljr4的对照组B在贮藏30 d后感病率为70%,该感病率约为熏蒸处理组A的6.36 倍。接种ljw2的对照组D在贮藏30 d后感病率为58%,该感病率为熏蒸处理组C的7.25 倍。贮藏30 d后肉桂精油熏蒸处理分别使接种ljr4及ljw2的生姜感病率下降了59.33%和47.33%。处理B与D相比,在贮藏10 d时接种的两种病原菌感病率差异不明显,但B处理贮藏20 d及30 d后感病率都显著大于同一贮藏期的D处理(P≤0.05,n=3)。
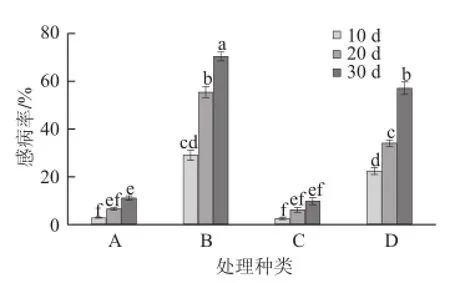
图3 熏蒸处理与未处理生姜感病率Fig.3 The infection rates of fumigation-treated ginger an d untreated ginger
3 讨 论
本实验所用材料取材自四川的两个地区,而分离、筛选并鉴定后的病原菌却是一致的。这说明该两种病原菌可能在四川地区生姜贮藏期侵染性病害中具有普遍性。本实验发现生姜贮藏期2 种病原菌分别为镰刀菌属和被孢霉属微生物。澳大利亚学者Sti rling[13]研究表明镰刀菌是生姜生长及贮藏期主要病原菌,并证明该病害主要由土壤传播,该结论与本实验结果相符。此外Overy等[14]也认为镰刀菌是生姜贮藏期的主要病原菌。Fatima等[15]在报道中认为与生姜同 为根茎类蔬菜的胡萝卜和芋头也易在贮藏期内受到镰刀菌侵染。
早在1971年澳大利亚学者Pegg和Moffett证明生姜生产中常见的姜瘟病是由细菌青枯假单胞杆菌(Pseudomonas solanacearum)引起的[16]。Hosoki等[17]发现生姜的软腐病是由真菌Pythium aphanidermatum引起的,该菌还能引起瓜类、豆类及茄果类腐霉病。1974年Pegg又发现真菌尖孢镰刀菌(Fusarium oxysporum)会引起生姜茎部腐败[18],而真菌Colletotrichum capsici能够引起生姜炭疽病的病原菌[19]。在生产中常见病原菌仅有尖孢镰刀菌与本工作分离到的病原菌具有较高的同源性,但进化树显示本工作中分离到的ljr4菌株与黄色镰刀菌(Fusarium culmorum)亲缘关系更近。因此,虽然本实验中所使用的肉桂精油能较好抑制ljr4菌株生长繁殖,但 该精油或其他种类精油是否可以用于姜生产中的病害防治还有待进一步研究。生姜表面及组织内部携带有经土壤传播的病原菌,这也是生姜采后致病微生物的主要来源。但贮藏过程中的致病微生物并不一定与生产过程中的致病菌完全相同,这可能是由于生姜生产中常见致病菌都需要较高的温湿度条件,如30 ℃以上、相对湿度95%以上,而在贮藏过程中虽然湿度能够满足病原菌的生长繁殖,但是低温的环境对某些病原菌是不利的。
镰刀菌属微生物在生长繁殖的过程中可能会产生毒素[20]。在进化树分析中ljr4与黄色镰刀菌亲缘关系较近,黄色镰刀菌已经被证明是产生镰刀菌毒素DON(脱氧雪腐镰刀菌烯醇)的主要菌种之一[21],此外该属微生物还能产生如玉米赤霉烯酮、脱氧雪腐镰刀菌烯醇、串珠镰刀菌素C和单端孢霉素类等,该类毒素能够引起人类多种疾病[22],因此分离自贮藏期生姜的ljr4产生镰刀菌毒素的可能性较大。ljw2菌株为被孢霉属微生物,该属微生物未见产生毒素方面的报道,但是关于该属微生物合成脂肪酸方面的报道较多[23],而合成过程需要大量底物,可能会使生姜的营养品质降低,缩短贮藏期。
就两种病原菌的危害分析,镰刀菌对人体健康的潜在危害性更大。生姜被镰刀菌侵染后发病症状较隐蔽,患病部位在感病初期不能观察到明显的菌丝,因此消费者可能因误食受感染的生姜而摄入镰刀菌毒素。因此在贮藏前及贮藏期控制该类病原菌能够 有效降低食品安全事件发生的风险。
由于生姜在表皮有水滴的情况下容易腐败,在其贮藏前及贮藏期杀菌处理中采用熏蒸方式更合理,所以本研究的药敏性实验及活体抑菌实验均采用熏蒸方式进行。由于目前尚无精油抑制被孢霉属微生物的报道,本实验选择对镰刀菌属微生物有较好抑制效果的6 种精油进行抑菌性试验[24-25],分别测试所选精油对2 种病原菌的抑菌效果。由于对经济性因素的考虑,本实验采用2 000 μL/L用量进行精油有效性的测试。供试精油中肉桂精油及百里香精油表现出对病原菌较好的抑制效果。该两种精油已经广泛的运用于果蔬[26]及肉类[27]保鲜,其中肉桂精油已被证明对与ljr4同属的串珠镰刀菌(Fusarium moniliforme)[28]及与ljw2亲缘关系较近的根霉菌(Rhizopus sp.)、毛霉菌(Mucor dimorphosporus)[29]有较强的抑制作用。Alfonso等[30]也在研究中发现百里香精油对镰刀菌属微生物有较强的抑制作用。这些报道都与本实验结果相符。茶树精油对镰刀菌抑制不明显,与Hammer等[31]的报道不符,这可能是由于本实验所使用的精油用量较低所致。
肉桂与百里香精油在2 000 μL/L用量下对ljw2及ljr4菌株生长抑制率均达到100%,其他供试精油在该用量下不能同时抑制两种病原菌,且抑制单一病原菌的效果并未优于肉桂精油及百里香精油,所以本实验在药敏性实验中仅比较了病原菌对该2种精油的敏感程度。由于保持生姜表皮干燥及独特气味的需要,药敏性实验中采用熏蒸法进行抑菌处理。
离体条件下肉桂精油熏蒸处理对ljr4及ljw2菌株的最低杀菌用量分别为125 μL/L和500 μL/L。在活体实验中以此用量熏蒸处理3 d后的生姜感病率显著低于对照组,说明熏蒸处理能够有效抑制接种于生姜的病原菌。但熏蒸处理组在30 d时感病率仍分别为11%和9.67%,说明熏蒸处理后的生姜病原菌并未被完全抑制。Farbood等[32]研究发现抑制食品上的病原菌需要的精油用量大于体外抑菌所需精油用量。这与本实验的结果一致,这可能是由于病原菌在其原本宿主上有更好的适应性,因此病原菌对杀菌剂的耐受性有所增强。但这并不能说明肉桂精油熏蒸在活体条件下效果不佳,因为本实验所得到的感病率是基于接种病原菌后的抑菌实验结果,而实际贮藏中使用的是经挑选后健康的生姜,其表面组织的单位体积含菌用量远小于接种用量。
所以该用量的熏蒸理论上适用于生姜杀菌处理。在实际情况下,该用量的肉桂精油熏蒸处理更适合于贮藏前的杀菌操作,熏蒸时间为3~4 d。如果在贮藏期长期封闭的环境中使用,由于处理时间很长,可以降低用量进行熏蒸操作。
4 结 论
本实验从贮藏中的生姜感病部位分离出的ljr4及ljw2真菌菌株表现出致病性,通过18S rDNA序列比对发现病原菌分别属于镰刀菌属及被孢霉属。其中ljr4菌株与黄色镰刀菌亲缘关系较近,产生镰刀菌毒素的可能性较大,存在潜在的食品安全隐患。在已知对镰刀菌属有较强抑制作用的6种精油中,ljw2只对百里香及肉桂精油较敏感。药敏性实验证明肉桂精油熏蒸抑制该2种病原菌效果较好,肉桂精油熏蒸处理对ljr4及ljw2菌株的最低杀菌用量分别为125 μL/L及500 μL/L。活体抑菌实验中125 μL/L用量肉桂精油熏蒸能降低接种ljr4菌株生姜的感病率至对照的1/6;500 μL/L用量肉桂精油熏蒸能降低接种ljw2菌株生姜的感病率至对照的1/7。肉桂精油是一种适用于生姜贮藏的熏蒸剂。
[1] ALI B, BLUNDEN G, TANIRA M, et al. Some phytochemical, pharmacological and toxicological properties of ginger (Zingiber off i cinale Roscoe) a review of recent research[J]. Food and Chemical Toxicology, 2008, 46(2): 409-420.
[2] STIRLING A M. The causes of poor establishment of ginger (Zingiber off i cinale) in Queensland, Australia[J]. Australasian Plant Pathology, 2004, 33(2): 203-210.
[3] TZORTZAKIS N G. Impact of cinnamon oil-enrichment on microbial spoilage of fresh produce[J]. Innovative Food Science and Emerging Technologies, 2008, 10(1): 97-102.
[4] VIUDA-MARTOS M, RUIZ-NAVAJAS Y, FERNÁNDEZ-LÓPEZ J, et al. Antifungal activities of thyme, clove and oregano essential oils[J]. Journal of Food Safety, 2007, 27(1): 91-101.
[5] VELLUTI A, SANCHIS V, RAMOS A J, et al. Inhibitory effect of cinnamon, clove, lemongrass, oregano and palmarose essential oils on growth and fumonisin B1 production by Fusarium proliferatum in maize grain[J]. International Journal of Food Microbiology, 2003, 89(2/3): 145-154.
[6] CARSON C F, HAMMER K A, RILEY T V. Melaleuca alternifolia (tea tree) oil a review of antimicrobial and other medic inal properties[J]. Clincal Microbiology Reviews, 2006, 19(1): 50-62.
[7] YANG Yu, JIANG Jiazhang, QIMEI Luobu, et al. The fungicidal terpenoids and essential oil from Litsea cubeba in tibet[J]. Molecules, 2010, 15(10): 7075-7082.
[8] DAMBOLENAA J S, ZUNINOA M P, LÓPEZB A G. Essential oils composition of Ocimum basilicum L. and Ocimum gratissimum L. from Kenya and their inhibitory effects on growth and fumonisin production by Fusarium verticillioides[J]. Innovative Food Science and Emerging Technologies, 2010, 11(2): 410-414.
[9] VERO S, MONDINO P, BURGUEÑO J, et al. Characterization of biocontrol activity of two yeast strains from Uruguay against blue mold of apple[J]. Postharvest Biology and Technology, 2002, 26(1): 91-98.
[10] BARGUES M D, MAS-COMA S. Phylogenetic analysis of lymnaeid snails based on 18S rDNA sequences[J]. Molecular Biology and Evolution, 1997, 14(5): 569-577.
[11] ZHAO K, PING W, LI Q, et al. Aspergillus niger var. taxi, a new species variant of taxol-producing fungus isolated from Taxus cuspidata in China[J]. Journal of Applied Microbiology, 2009, 107(4): 1202-1207.
[12] SINGH G, MAURYA S, DE LAMPASONA M P, et al. Chemical Constituents, Antimicrobial investigations, and antioxidative potentials of Anethum graveolens L. essential oil and acetone extract: part 52[J]. Journal of Food Science, 2005, 70(4): 208-215.
[13] STIRLING A M. The causes of poor establishment of ginger (Zingiber off i cinale) in Queensland, Aust ralia[J]. Australasian Plant Pathology, 2004, 33(2): 203-210.
[14] OVERY D, FRISVAD J. Mycotoxin production and postharvest storage rot of ginger (Zingiber off i cinale) by Penicillium brevicompactum[J]. Journal of Food Protection, 2005, 3(1): 607-609.
[15] FATIMA N, BATOOL H, SULTANA V, et al. Prevalence of postharvest rot of vegetables and fruits in Karachi, Pakistan[J]. Pakistan Journal o f Botany, 2009, 41(6): 3185-3190.
[16] PEGG K G, MOFFETT M L. Host range of the ginger strain of Pseudomonas solanacearum in Queensland[J]. Australian Journal of Experime ntal Agriculture and Animal Husbandry, 1971, 53(11): 696-698.
[17] HOSOKI T, SAGAWA Y. Clonal propagation of ginger (Zingiber off i cinale Rosc.) through tissue culture[J]. Hort Sci ence, 1977, 12: 451-452.
[18] PEGG K G, MOFFETT M L, COLBRAN R C. Diseases of ginger in Queensland[J]. Queensland Agricultural Journal, 1974, 100(12): 611-618.
[19] SNOWDON A L. Post-harvest diseases and disorders of fruits and vegetables[M]. London: Manson Publishing Ltd., 1991: 1 36-142.
[20] 彭杰, 吴晓鹏, 黄惠琴, 等. 镰刀菌毒素研究进展[J]. 中国农学通报, 2009, 2(2): 25-27.
[21] 吴茂森, 何晨阳. 小麦赤霉病穗组织中黄色镰刀菌和DON毒素的定量分析[J]. 植物保护学报, 2008, 35(1): 33-36.
[22] MORGAVI D P, RILEY R T. An historical ov erview of fi eld disease outbreaks known or su spected to be caused by consumption of feeds contaminated with Fusarium toxins[J]. Animal Feed Science and Technology, 2007, 137(3/4): 201-212.
[23] ZENG Yan, JI Xiaojun, CHANG Shumei, et al. Improving arachidonic acid accumulation in Mortierella alpina through B-group vitamin addition[J]. Bioprocess and Biosystems Engineering, 2012, 35(1): 683-688.
[24] GILARDI G, INNELLA C, GULLINO M, et al. Susceptibility of basil cultivars of basil against Fusarium oxysporum[J]. Protezione delle Colture, 2012, 2(1): 48.
[25] SINGH R I, SINGH R A, CHARAN R R. Evaluation of antifungal activity in essential oil of the Syzygium aromati cum (L.) by extraction, purif i cation and analysis of its main component eugenol[J]. Brazilian Jour nal of Microbiology, 2011, 42(4): 1269-1277.
[26] AVILA-SOSA R, PALOU E, JIMÉNEZ MUNGUÍA M T, et al. Antifungal activi ty by vapor contact of essential oils added to amaranth, chitosan, or starch edible fi lms[J]. International Journal of Food Microbiology, 2012, 153(12): 6 6-72.
[27] GUDRUN L, BUCHBAUER G. A review on recent research results (2008-2010) on essential oils as antimicrobials and antifungals. A review[J]. Flavour and Fragrance Journal, 2012, 27(1): 13-39.
[28] MATANA N, SAENGKRAJANGA W, MATANB N. Antifunga l activities of essential oils applied by dip-treatment on areca palm (Areca catechu) leaf sheath and persistence of their potency upon storage[J]. International Bio deterioration and Bi odegradation, 2011, 65(1): 212-216.
[29] MATAN N, RIMKEEREE H, MAWSON A J, et al. Antimicrobial activity of cinnamo n and clove oils under modified atmosphere conditions[ J]. International Journal of Food Microbiology, 2006, 107(2): 180-185.
[30] PÉREZ-ALFONSO C O, MARTÍNEZ-ROMERO D, ZAPAT A P J, et al. The effects of essential oils carvacrol and thymol on growth of Penicillium digitatum and P. italicum involved in lemon decay[J]. International Journal of Food Microbiology, 2012, 158(2): 101-106.
[31] HAMMER K, CARSON C, RILEY T. Antifungal activity of the components of Melaleuca alternifolia (tea tree) oil[J]. Journal of Appled Microbiology, 2003, 95(4): 853-860.
[32] FARBOOD M, MACNEIL J, OSTOVAR K. Effect of rosemary spice extract on growth of microorganisms in meats[J]. Journal of Milk and Food Technology, 1 976, 39(1): 6 75-679.
Isolation, Identification and Inhibition of Pathogens from Mature Ginger during Storage
LIU Ji1,2, YAN Jing2, HE Jing-liu2, DONG Hong-min2, GUO Fei2, XIONG Ya-bo2, HUANG Ying2, QIN Wen2,*
(1. Agriculture Products Research Institute, Chengdu Academy of Agriculture and Forestry Sciences, Chengdu 611130, China; 2. College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
This research was intended to isolate, purify, and identify the pathogens which cause ginger rotting during storage, to screen essential oils for controlling the pathogenic isolates, and to test their effectiveness. In this work, ljw2 and ljr4 were identif i ed as pathogens through isolation, purif i cation, and pathogenicity tests. The results of 18S rDNA sequence analysis showed that these fungi belonged to the genera Fusarium and Mortierella. Six essential oils, based on the pathogen genera, were investigated for their activity to control these pathogens. As results, cinnamon and thyme oil showed complete inhibitory effect on all pathogens at a concentration of 2 000 μL/L. Cinnamon oil showed higher antifungal activity in the drug sensitivity test. The minimal inhibitory concentrations (MIC) of cinnamon oil against these two pathogens were 64 and 32 μL/L, respectively. The minimal fungicidal concentrations of cinnamon oil against the pathogens were 125 and 500 μL/L, respectively. Compared with untreated samples, the infection rates of fumigation treatment samples declined by 59.33% (ljr4) and 47.33% (ljw2), respectively. Cinnamon oil seems to be a promising potential fumigant.
Fusarium; Mortierella; 18S rDNA; cinnamon oil; antibacterial effect
TS205.9
A
1002-6630(2014)18-0172-06
10.7506/spkx1002-6630-201418034
2013-12-26
刘继(1984—),男,博士,研究方向为果蔬加工及贮藏。E-mail:liujidemail@sina.com
*通信作者:秦文(1967—),女,教授,博士,研究方向为果蔬加工及贮藏。E-mail:qinwen1967@aliyun.com.cn

