静态顶空气相色谱-质谱联用法同时测定食品添加剂中9 种有机溶剂残留
洪 华,王 莉,武中平,顾爱国,王 伟
(江苏省产品质量监督检验研究院,江苏 南京 210007)
静态顶空气相色谱-质谱联用法同时测定食品添加剂中9 种有机溶剂残留
洪 华,王 莉,武中平,顾爱国,王 伟
(江苏省产品质量监督检验研究院,江苏 南京 210007)
建立一种用于食品添加剂中常见的9 种残留溶剂含量的顶空气相色谱-质谱联用检测方法,对顶空孵化温度、孵化时间的影响进行研究。结果表明:孵化温度在80 ℃、孵化时间5 min时,选用HP-5MS(30 m×0.25 mm,0.25 μm)的毛细管色谱柱对9 种有机溶残在10 min内能很好地分离。该法在烷烃类、芳香烃类有机溶剂在0.1~10 mg/L、酯类、酮类1.0~100 mg/L、醇类4.0~400 mg/L范围内线性关系良好,9 种残留溶剂的相关系数均大于0.997 1,加标回收率87.54%~106.50%,相对标准偏差(n=5)1.43%~6.17%。检出限范围为烷烃类、芳香烃类0.000 4~0.005 2 mg/L;酯类、酮类0.016 0~0.024 0 mg/L;醇类0.550 0~0.596 0 mg/L。该法快速、准确、灵敏度高,适用于食品添加剂中多种溶剂残留量的同时测定。
顶空;气相色谱-质谱;有机溶剂;残留;食品添加剂
食品添加剂中的残留溶剂是指在原辅料以及食品添加剂生产过程中使用的,但在工艺过程中未能完全去除的有机挥发性化合物。在食品添加剂合成工艺中,选择适当的溶剂可提高产量或决定食品添加剂的性质,如晶型、纯度、溶解速率等。因此有机溶剂在食品添加剂合成反应中是必不可少和非常关键的物质。但是,当食品添加剂所含的残留溶剂水平高于安全值时,就会对人体或环境产生危害,因此对残留溶剂的控制已越来越受到人们的关注[1]。
目前,对于易挥发性有机溶剂残留的检测方法主要有顶空气相色谱法、顶空气相色谱-质谱(headspace gas chromatography-mass spectrometry,HS-GC-MS)法、吹扫捕集-气相色谱-质谱法和顶空固相萃取-气相色谱-质谱法等[2-20]。检测对象主要包括食品包装材料、化妆品、玩具、涂料、饮料、土壤和酒,针对食品添加剂产品的分析方法鲜有报道。由于HS-GC-MS联用法测定易挥发性有机溶剂具有操作简单、准确度高、确证性好等优点,并且采用选择离子扫描模式可排除本底和干扰离子的影
响,提高了信噪比和检测灵敏度,在国内外应用广泛。本研究采用顶空进样法同时测定食品添加剂中残留的甲醇、甲酸甲酯、乙醇、丙酮、二硫化碳、正己烷、苯、正庚烷和甲苯这9 种常见的有机溶剂的含量,并得到了满意的结果。
1 材料与方法
1.1 材料与试剂
9 种有机溶剂标准物质的纯度均为分析纯(脱水后进行重蒸馏处理)、N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)(分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
ITQ900 GC-MS联用仪(配有电子电离源、Tri Plus自动进样系统)、20 mL钳口平底顶空瓶(配聚四氟乙烯硅橡胶垫) 美国Thermo Fisher公司;BS224S型电子分析天平(精度0.000 1g) 德国Sartorius公司。
1.3 方法
1.3.1 色谱条件
色谱柱:HP-5MS石英毛细柱(30 m×0.25 mm,0.25 μm);升温程序:初始温度30 ℃,保持4 min,10 ℃/min升温至60 ℃,40 ℃/min升温至180 ℃保持2 min;进样口温度120 ℃。载气为高纯氦气(纯度99.999%);流速1.0 mL/min;分流进样,分流比1∶50。
1.3.2 顶空进样器条件
孵化器温度80 ℃;孵化时间5 min;进样针温度85 ℃;进样量1 mL。
1.3.3 质谱条件
电子电离源;电子能量70 eV;传输线温度150 ℃;离子源温度220 ℃;选择离子扫描模式,溶剂延迟1.84 min。9 种有机溶剂的保留时间、定量和定性离子及定量离子与定性离子的丰度比见表1。采用分时段分别扫描,质谱参数见表2。

表1 9 种有机溶剂的GC-MS检测参数Table 1 GC-MS parameters for 9 organic solvents
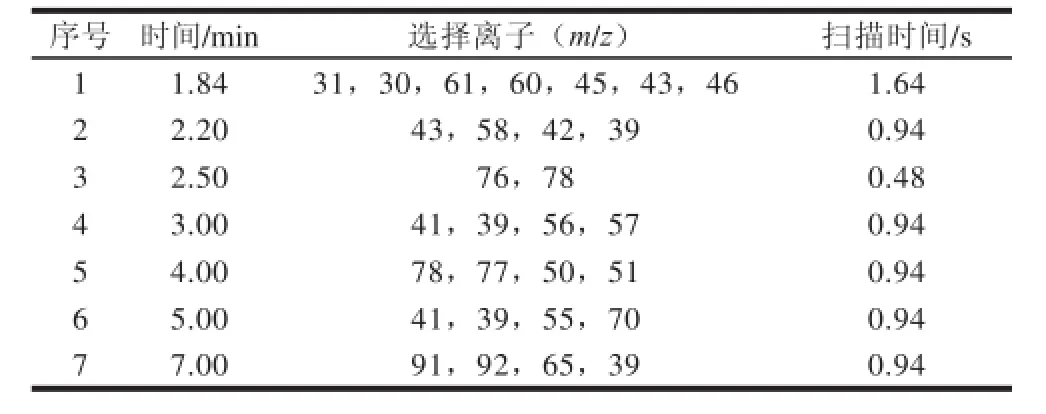
表2 9 种有机溶剂选择离子扫描模式的参数Table 2 Parameters in selected ion monitoring mode for 9 organic solvents
1.3.4 标准溶液配制
1.3.4.1 标准溶液母液的配制
分别称取2.000 g甲醇和乙醇,0.500 g甲酸甲酯、丙酮和二硫化碳,0.050 g正己烷、苯、正庚烷和甲苯到1 000 mL的容量瓶中,用DMF定容到刻度,配成混合标准工作溶液A,此溶液的质量浓度50 mg/L(实验中提及混合标准溶液质量浓度时均以甲苯的质量浓度定,下同)。
1.3.4.2 标准曲线溶液的配制
移取10 mL 1.3.4.1节混合标准工作溶液A到50 mL的容量瓶中,用DMF定容至刻度,配成10.0 mg/L的混合标准工作溶液B,再以此溶液逐级稀释配制成5.0、2.0、1.0、0.5、0.1 mg/L的标准曲线溶液。
1.3.5 样品处理
称取0.5 g(精确到0.000 1 g)食品添加剂样品置于20 mL顶空瓶中,加入8 mL的DMF,密封瓶口;手动混匀1 min;同时做样品空白。
1.3.6 试样中残留溶剂含量的计算
将1.3.5节的样品和空白样按照1.3.1、1.3.2节和1.3.3节的方法条件,采用保留时间和定性离子定性,定量离子外标法定量。试样中残留溶剂含量由以下公式计算。

2 结果与分析
2.1 测定目标溶剂及稀释溶剂的选择
有机溶剂在食品添加剂生产中被广泛使用,种类也繁多,但是本研究通过对国内外相关文献和标准的研究以及前期对一定样本量的食品添加剂检测分析确定了这9 种常用并且容易产生残留的溶剂作为研究对象。
对于目标有机溶剂的稀释溶剂的选择,文献报道主要有甲醇、丙酮、正己烷、环己酮、酰胺、甘油三乙酸酯和DMF。由于甲醇、丙酮、正己烷等溶剂为本研究的品种,而DMF能与水、醇、醚、酯、烷烃和芳香类化合物等有机溶剂任意混合,并且测定过程中出峰时间及碎片离子对其他待测物基本无干扰,故本研究最终选择DMF作为9 种有机溶剂的稀释剂。
2.2 色谱柱及GC-MS条件的选择
本研究中主要难分离的溶剂为甲醇、甲酸甲酯和乙醇,采用DB-624(或等效)的色谱柱可以很好地分离,但是该类型的色谱柱多为气相用色谱柱,少见质谱专用柱,气相用色谱柱在质谱上应用,在高温阶段会产生很大的柱流失,从而加大了基线噪音。本研究使用实验室最常见的HP-5MS色谱柱对目标物进行分离,这9 种目标溶剂都得到了很好地分离。在优化的色谱条件下9 种有机溶剂的总离子流图见图1。可以看出甲醇、甲酸甲酯和乙醇分离的很好。
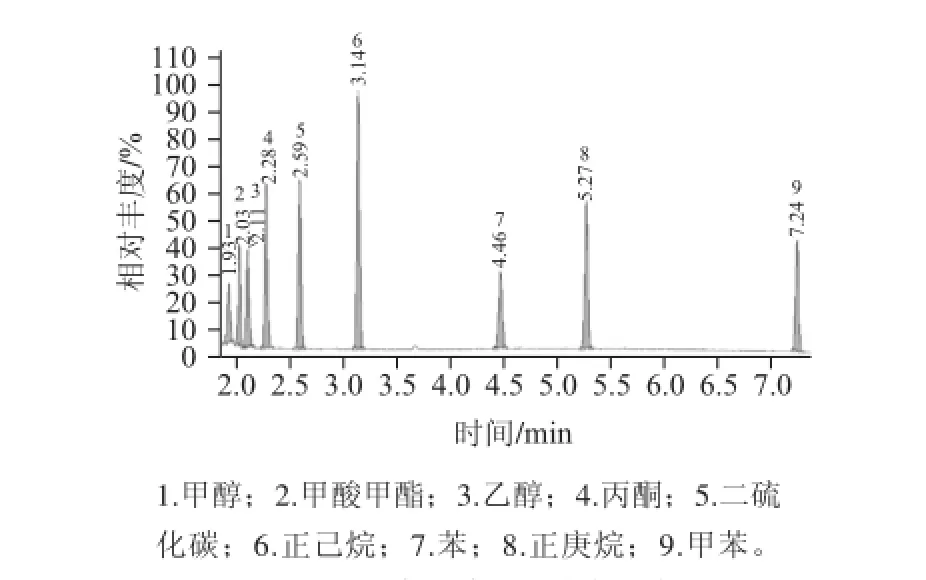
图1 9 种有机溶剂的总离子流图Fig.1 TIC of 9 organic solvents
采用GC-MS联用仪在m/z 30~650质量扫描范围内对9 种有机溶剂进行测定时发现,干扰离子主要是m/z 32、40、44。如果采用选择离子扫描模式就可以排除这些离子,可明显降低噪声,提高信噪比。每种化合物选择1 个定量离子,3 个定性离子(甲醇和二硫化碳选择1 个定性离子)。可依据保留时间、定量离子及定性离子之间的丰度比来定性。在选择离子扫描模式下9 种有机溶剂的色谱图见图2。

图2 9 种有机溶剂的选择离子扫描图Fig.2 SIM of 9 organic solvents
2.3 孵化时间的选择
残留溶剂从基体挥发到顶空相需要一定时间,该时间主要与残留溶剂的挥发特性有关。实验过程中,取10 mg/L的混合标准溶液8 mL于4 个顶空瓶中,设置顶空孵化器温度80 ℃,孵化时间5.0、10.0、15.0、20.0 min。以时间为横坐标,溶剂在质谱上的响应峰面积为纵坐标画图,考察孵化时间对残留溶剂检测的影响,结果如图3所示。
樱桃熟了,果粒红得发紫。给院子增添一道靓丽风景线,大楼里的人舍不得摘。这天,来了三个骑摩托车自称是种樱桃树的园林农工,理直气壮地进园就摘樱桃。门卫经警好言相劝,走时还是摘了半塑料袋樱桃。樱桃好吃树难栽,这里的樱桃树是她们栽的,果子理应她们吃。
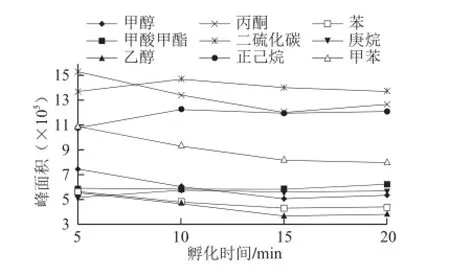
图3 孵化时间对9 种有机溶剂峰面积的影响Fig.3 Effect of incubation time on peak areas of 9 organic solvents
从图3可知,孵化时间在5.0 min的时候,多数目标化合物峰面积达到最大值。为了使顶空瓶内的待测组分充分达到平衡,并且节省时间,选择孵化时间5.0 min。
2.4 孵化温度的选择
孵化温度是影响检测速度和效果的重要因素。若顶空平衡温度高,则分析物质扩散的速度快,顶空气体的浓度高,因此分析灵敏度高;但温度过高,分析物质则容易分解。在本研究中,取10 mg/L的混合标准溶液8 mL于5 个顶空瓶中,孵化时间设置为5 min,分别设置孵化温度60、65、70、75、80 ℃,以孵化温度为横坐标,溶剂在质谱上的响应峰面积为纵坐标画图,考察孵化温度对残留溶剂检测的影响,结果如图4所示。
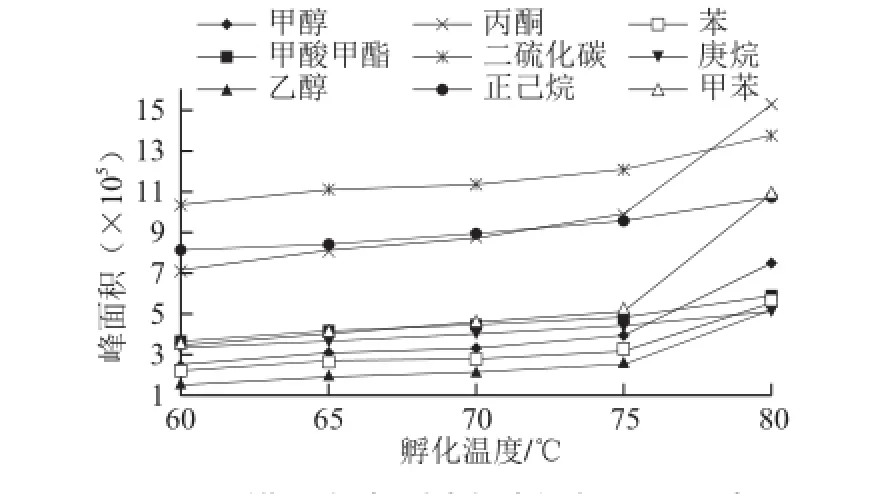
图4 孵化温度对9 种有机溶剂峰面积的影响Fig.4 Effect of incubation temperature on peak areas of 9 organic solvents
从图4可知,孵化温度从60 ℃开始,目标化合物峰面积随着温度升高而增加。但是由于稀释溶剂选择DMF,DMF在温度升高的过程中会随目标化合物一起气化进入质谱系统,对质谱系统造成伤害,同时温度越高
被试物分解的可能性就越大,综合各方面因素考虑,选择80 ℃作为孵化温度。
2.5 进样口温度的选择
进样口温度也是影响检测效果的因素。若进样口温度高,则分析物质在进样口内膨胀扩散,甚至分解,从而降低响应值;但进样口温度过低,分析物质在进入进样口后液化,降低蒸汽浓度,也会降低响应值。在本研究中,取10 mg/L的混合标准溶液8 mL于5 个顶空瓶中,孵化时间设置为5 min,孵化温度设置为80 ℃,以进样口温度为横坐标,溶剂在质谱上的响应峰面积为纵坐标画图, 考察进样口温度对残留溶剂检测的影响,结果如图5所示。
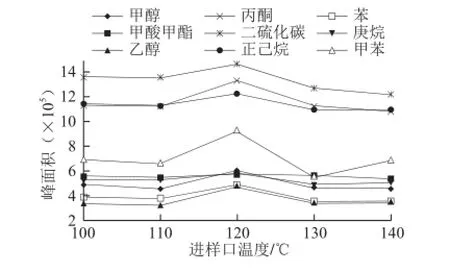
图5 进样口温度对9 种有机溶剂峰面积的影响Fig.5 Effect of inlet temperature on peak areas of 9 organic solvents
从图5可知,进样口温度在120 ℃时,目标化合物峰面积达到最大值。所以选择120 ℃作为进样口温度。
2.6 方法的线性关系

表3 9 种有机溶剂的线性范围、相关系数、线性方程和检出限Table 3 Linear ranges, correlation coefficients, regression equations and LOD for 9 organic solvents
由于各类有机溶剂在仪器上的响应值不同,在配制混合标准溶液时,将各类有机溶剂按不同质量浓度进行配制,使各个待测物响应值(峰高或峰面积)基本一致,这样在条件实验、建立线性关系和进行添加回收率实验等工作中容易获得满意的结果。用1.3.4.2节的标准曲线溶液和1.3.1、1.3.2节和1.3.3节的方法绘制标准工作曲线,每个样品重复测定3 次,取平均值。以对照品的质量浓度为横坐标(X,mg/L)和对照品峰面积为纵坐标(Y)进行线性回归,得到回归方程和相关系数。在测定范围内,9 种有机溶剂有良好的线性关系,线性相关系数均大于0.997 1。同时移取1.3.4.2节中的0.5 mg/L的混合标准溶液8 mL到11 个顶空瓶中,用1.3.1、1.3.2节和1.3.3节方法检测其中9 种有机溶剂的含量,以11 次测得峰面积计算标准偏差,以标准偏差的3 倍作为噪声带入线性方程中计算出质量浓度即为检出限,计算结果见表3。
2.7 添加回收率及精密度
选择复配水分保持剂样品进行添加回收率和精密度实验。首先采用本方法对食品添加剂样品进行测定,得到该食品添加剂中已含有的有机溶剂的定量结果。然后在样品中添加不同质量浓度的混合标准溶液,用稀释剂充分混合,按本方法进行HS-GC-MS测定。测定结果扣除样品空白值。方法的回收率和精密度见表4。
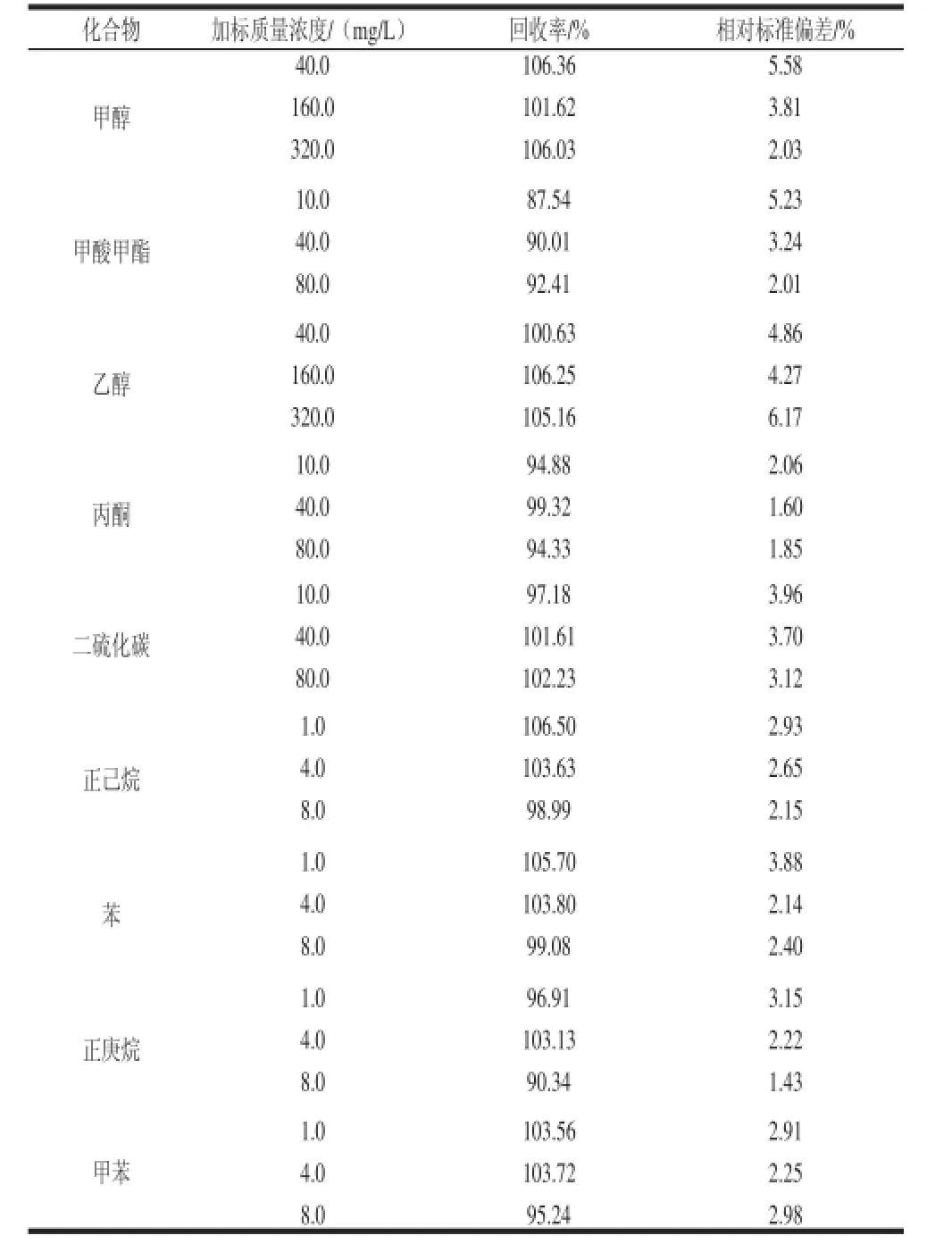
表4 食品添加剂样品中9 种有机溶剂的添加回收率和精密度(n =5)Table 4 Recoveries and precision (RSD) of 9 organic solvents spiked in food additives ( n= 5)
从表4可以看出,平均回收率在8 7.5 4%~106.50%之间,相对标准偏差在1.43%~6.17%之间,均符合方法学要求。
2.8 实际样品检测
利用本研究建立的方法对市场上抽取的100 个批次的食品添加剂样品进行检测,样品中检出不同含量的
溶剂残留。其中检出甲醇12 个批次(65~300 mg/kg)、乙醇8 个批次(140~1 000 mg/kg)、丙酮4 个批次(18~120 mg/kg)、苯1 个批次(28 mg/kg)、甲苯18 个批次(1.6~370 mg/kg)。通过本研究发现溶剂残留在食品添加剂行业是一个普遍存在的问题。
3 结 论
本研究建立的静态HS-GC-MS联用法检测食品添加剂产品中残留有机溶剂含量的灵敏度高,选择性好,前处理方法简单快捷。同时通过对100 个批次实际样品的检测,证明本方法对有机溶剂残留量的测定适应性好,可操作性强。适用于食品添加剂中溶剂残留含量的日常检测,为修订相关检测标准打下了较好的基础,有较高的实用价值。
[1] The United States Pharmacopeial Convention. USP<467>residual solvents[S]. The United States: Pharmacopeial Convention, 2008.
[2] TOYODA T, NOHARA I, SATO T, et al. Headspace analysis of volatile compounds emitted from various citrus blossoms[J]. Bioactive Volatile Compounds from Plants, 1993, 15: 205-219.
[3] ANDRE M, LOID L J, LAUS G, et al. Ionic liquids as advantageous solvents for headspace gas chromatography of compounds with low vapor pressure[J]. Analytical Chemistry, 2005, 77(2): 702-705.
[4] GAN Jianying, PAPIEMIK S, YATES S, et al. Static headspace and gas chromatographic analysis of fumigant residues in soil and water[J]. Journal of Agricultural and Food Chemistry, 1998, 46(3): 986-990.
[5] FARAHANI H, GANJALI M, DINARVAND R, et al. Study on the performance of the headspace liquid-phase microextraction, gas chromatography-mass spectrometry in the determination of sorbic and benzoic acids in soft drinks and environmental water samples[J]. Journal of Agricultural and Food Chemistry, 2009, 57(7): 2633-2639.
[6] 汪海峰, 鞠兴荣, 杨晓蓉. 食用植物油中残留溶剂的高温顶空气相色谱分离与测定[J]. 食品科学, 2006, 27(2): 235-238.
[7] 徐春祥, 杨洋, 高俊伟. 食品包装复合膜中15 种溶剂残留的同时测定方法[J]. 食品科学, 2008, 29(9): 496-498.
[8] 俞燕君. 项空色谱法测定食品添加剂中的残留溶剂[J]. 色谱, 1986, 4(6): 77-79.
[9] 刘永明, 葛娜, 王飞. 顶空气相色谱-质谱法同时测定蜂蜜中57 种挥发性有机溶剂残留[J]. 色谱, 2012, 30(8): 782-791.
[10] 祝波, 赵鲁青, 陈安珍. 顶空采样-毛细管气相色谱法分析格列美脲原料药中的溶剂残留[J]. 色谱, 2009, 27(6): 755-759.
[11] 李祖光, 朱国华, 曹慧. 顶空固相微萃取-气相色谱-质谱法测定二苯甲酮类防晒剂中残留溶剂[J]. 理化检验: 化学分册, 2009, 45(12): 1422-1423; 1427.
[12] 金永灿, 崔柱文, 孔维松. 顶空固相微萃取-气相色谱法测定卷烟包装材料中残留溶剂[J]. 理化检验: 化学分册, 2011, 47(12): 1424-1426.
[13] 刘玉敏, 路庆华, 庄明珠. 静态顶空/气相色谱-质谱联用快速测定茶粉中残留溶剂[J]. 分析测试学报, 2007, 26(1): 122-124.
[14] 刘军, 祝文书, 刘杰. 盐析顶空毛细管气相色谱法测定7-ADCA原料药中有机残留溶剂的含量[J]. 分析仪器, 2012(5): 14-17.
[15] 张艳红, 吕昭云, 张颖. 顶空毛细管气相色谱法测定羟戊基苯甲酸钾中的残留溶剂[J]. 药物分析杂志, 2009, 29(9): 1565-1567.
[16] 董嘉君, 林锦生. 顶空程序升温法测定硫酸头孢匹罗的残留溶剂[J].西北药学杂志, 2010, 25(1): 10-11.
[17] 林平, 傅晓钦, 钱飞中. 顶空毛细管气相色谱法测定盐酸格拉司琼中残留溶剂[J]. 中国药师, 2011, 14(1): 34-37.
[18] 吴朝华, 王秀梅, 顾保明. 顶空毛细管气相色谱法测定盐酸丁卡因原料药中的残留溶剂[J]. 药物分析杂志, 2011, 31(6): 1188-1192.
[19] 阮昊, 陈悦. 顶空进样气相色谱法测定阿洛西林钠原料药中的残留溶剂[J]. 中国现代应用药学, 2011, 28(11): 1047-1050.
[20] 郭琴, 张立军, 董洪文. 顶空进样法测定布洛芬中的残留溶剂[J]. 中国药学杂志, 2002, 37(7): 57-59.
Simultaneous Determination of 9 Residual Organic Solvents in Food Additives by Static Headspace Gas Chromatography-Mass Spectrometry
HONG Hua, WANG Li, WU Zhong-ping, GU Ai-guo, WANG Wei
(Jiangsu Provincial Supervising and Testing Research Institute for Products Quality, Nanjing 210007, China)
An analytical method was developed for the determination of 9 residual solvents in food additives by static headspace gas chromatography-mass spectrometry (HS-GC-MS). The optimal chromatographic conditions were as follows: an HP-5MS capillary column (30 m × 0.25 mm, 0.25 μm), and equilibration of the sample in the headspace vessel at 80 ℃ in 5 min. The results showed that all 9 organic residues were separated well within 10 min, and the standard curves were linear in the range of 0.1-10 mg/L for alkanes and aromatic hydrocarbons, 1-100 mg/L for esters and ketones, and 4.0-400 mg/L for alcohols. The correlation coefficients were more than 0.997 1 for 9 residual organic solvents. The recoveries for spiked samples were 87.54%-106.50% with RSD (n = 5) in the range of 1.43%-6.17%, and the limits of detection were 0.000 4-0.005 2 mg/L for alkanes and aromatic hydrocarbons, 0.016 0-0.024 0 mg/L for esters and ketones, and 0.550 0-0.596 0 mg/L for alcohols. The proposed method is simple, rapid, sensitive and accurate, and can be used for the simultaneous determination of residual solvents in food additives.
headspace; gas chromatography-mass spectrometry; organic solvents; residual; food additive
TS202.3
A
1002-6630(2014)18-0167-05
10.7506/spkx1002-6630-201418033
2014-04-22
洪华(1979—),男,工程师,博士,研究方向为有毒有害物质检测。E-mail:18761888911@139.com

