草果甲醇溶出物对D-半乳糖致衰老小鼠的抗氧化作用机理研究
闫 倩,俞龙泉,陈 野,王宏涛,张秋艳,魏 刚
(1.天津科技大学食品工程与生物技术学院,天津300457;2.石家庄学院化工学院,河北石家庄050035;3.河北以岭医药研究院,河北石家庄050035)
草果甲醇溶出物对D-半乳糖致衰老小鼠的抗氧化作用机理研究
闫 倩1,俞龙泉2,*,陈 野1,王宏涛3,张秋艳3,魏 刚3
(1.天津科技大学食品工程与生物技术学院,天津300457;2.石家庄学院化工学院,河北石家庄050035;3.河北以岭医药研究院,河北石家庄050035)
目的:了解明草果甲醇溶出物对D-半乳糖所致衰老小鼠的抗氧化功效。方法:采用D-半乳糖结合高脂饲料建立ICR小鼠衰老模型,高、低剂量组分别添加草果溶出物200、100mg/kg,考察血浆和肝组织中SOD、GSH、GSH-Px、MDA、8-ISO-PGF2α指标。结果:以模型为参照,血指标显示,草果组SOD活力极显著提高(p<0.01),草果组GSH含量均极显著提高(p<0.01),GSH-Px活力也极显著提高(p<0.01),草果组MDA含量均显示显著降低(p<0.05),高剂量组8-ISOPGF2α含量显著降低(p<0.05);肝指标显示,低剂量组SOD活力显著提高(p<0.05),高剂量组差异极显著(p<0.01),高剂量组GSH含量极显著提高(p<0.01),能极显著提高GSH-Px活力(p<0.01),极显著降低MDA含量(p<0.01);结论:草果甲醇溶出物能够显著提高小鼠SOD、GSH、GSH-Px指标,MDA和8-ISO-PGF2α含量显著下降。
草果,甲醇溶出物,D-半乳糖,抗氧化作用,小鼠
草果(Amomum tsao-ko Crevost et Lemaire),又 名草果子、草果仁,分布于我国云南、广西、贵州等地,为姜科豆蔻属多年生常绿丛生草木植物。草果是一种药食同源植物,具有特殊风味和药用价值[1-2]。作为常用的中药,草果有健胃、顺气、驱风、增进食欲的药疗效果,同时具有燥湿健脾、温胃止痛、止呕截疟的功能,能用于寒湿内阻、脏腹胀满、呕逆、不思饮食等症[3]。草果的干燥果实气香、性温、味辛辣,在国内广泛应用于食品香料行业。
自由基连锁反应引起的脂质过氧化会导致细胞损伤、衰老或死亡,与人体许多疾病及衰老密切相关[4-5],因此人体摄入抗氧化功能因子显得尤为重要。前期研究发现草果比其他香辛料具有更好的抗氧化性[6],关于草果及其功效成分的抗氧化机理研究,到目前为止国内外还没有发现相关报道。本研究的目的是探讨草果中生物活性物质的体内抗氧化作用,解明其对D-半乳糖所致衰老小鼠的抗氧化机理。本研究参照中国食品药品监督管理局2012年发布的《抗氧化功能评价方法》[7],以D-半乳糖所致衰老小鼠作为实验对象,给予不同组小鼠普通饲料、高脂饲料及添加不同剂量草果甲醇溶出物的实验饲料,进行小鼠体内抗氧化功能的研究,从小鼠血浆及肝组织抗氧化酶水平(SOD、GSH-Px的活性)、肽水平(GSH的含量)和脂质过氧化产物(8-ISO-PGF2α、MDA的含量)三个方面,解明草果甲醇溶出物的抗氧化作用机理,为开发第三代保健食品新品种提供科学依据。
1 材料与方法
1.1 材料与仪器
草果 产于云南;猪油 台湾正义食品有限公司;小鼠基础饲料 购于河北医科大学动物实验中心,为粉末状;甘油三酯(TG)检测试剂盒、低密度脂蛋白胆固醇(LDL-C)检测试剂盒、高密度脂蛋白胆固醇(HDL-C)检测试剂盒、总胆固醇(TC)检测试剂盒 均购于北京九强生物技术有限公司;超氧化物歧化酶(SOD)测定测试盒、还原型谷胱甘肽(GSH)测定测试盒、谷胱甘肽过氧化物酶(GSH-Px)测试盒、丙二醛(MDA)测试盒、BCA法测定超微量蛋白含量试剂盒、小鼠8-异前列腺素F2α(8-ISO-PGF2α)酶联免疫检测试剂盒 均购于南京建成生物工程研究所;D-半乳糖 天津市沃尔斯化工有限公司;甲醇、氯仿 分析纯,天津市河东区红岩试剂厂;丙酮 分析纯,天津市致远化学试剂有限公司;SPF级ICR 8周龄雄性小鼠 体重28~32g,购于北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2012-0001。
日立7080全自动生化分析仪 日本日立公司;RT-6000全自动酶标仪 美国雷杜公司;H2050R台式高速冷冻离心机 长沙湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 草果甲醇溶出物的制备 草果去壳后烘干,粉碎成100目以上粉末。称取50g草果粉末,加入200mL氯仿,400mL甲醇和40mL蒸馏水,静置过夜,用均质机均质5min(18000r/min),冷却后用超声波细胞粉碎仪粉碎10min(功率70%,工作频率20~25Hz)。混合物真空抽滤后收集滤液,滤饼加入100mL氯仿,200mL甲醇,20mL蒸馏水,再次利用上述方法萃取有效物质,重复两遍。将三次滤液收集到一起,并加入60g已活化硅胶粉末,利用旋转蒸发仪蒸干,旋转蒸发仪温度设为25℃,得到粉末状样品后,进行干法上柱(自制50Ø×250mm的200~300目硅胶氢柱)。先后用600mL氯仿、600mL丙酮、600mL甲醇洗脱,收集甲醇溶出液[23-24]。将甲醇溶液用微孔滤膜(0.22μm)过滤后进行蒸发浓缩,待滤液量小于50mL时真空干燥,最终得到草果甲醇溶出物,提取率约为2%。
1.2.2 实验饲料的制备 高脂饲料:在基础饲料基础上,添加10%的猪油;低剂量实验饲料:在高脂饲料基础上,添加100mg/kg的草果甲醇溶出物;高剂量实验饲料:在高脂饲料基础上,添加200mg/kg的草果甲醇溶出物。
1.2.3 动物分组、造模及处理
1.2.3.1 动物分组 取8周龄ICR雄性小鼠,体重28~32g,随机分成4组,每组12只,设为空白对照组、模型对照组、草果低剂量实验组、草果高剂量实验组。在不锈钢丝笼中饲养动物。给予小鼠普通棒状饲料2周后,进行粉末饲料的适应性喂养。小鼠在第12周龄时用苦味酸进行编号,开始进行90d喂养实验。
1.2.3.2 动物造模及饲养 模型对照组、草果低剂量实验组及草果高剂量实验组用D-半乳糖致亚急性衰老法造模,剂量为125mg/(kg·d),腹腔注射8周,注射体积是0.1mL/(10g·bw),每天依据体重调整注射剂量。空白对照组腹腔注射等量生理盐水,同时,空白对照组给予普通饲料,模型对照组给予高脂饲料,草果低剂量实验组给予低剂量实验饲料,草果高剂量实验组给予高剂量实验饲料。每周记录食量及体重。动物房温度保持在(24±0.5)℃,相对湿度保持在65% ±5%。室内照明包括光明与黑暗的12h交替。
1.2.3.3 动物血液及肝组织的采集 在饲养结束时,所有小鼠禁食20h,用乙醚麻醉,解剖收集血液并取肝组织。将肝组织进行称重,将肝组织和剖前体重的比值作为肝脏指数。取血时,用柠檬酸钠抗凝,4℃,3000r/min离心15min,取上清液-30℃保存待测。取小鼠肝脏0.5g,放入研磨器中,加入4.5mL生理盐水,制成10%的肝匀浆,振荡,4℃,3000r/min离心20min,取上清液,-30℃保存备用。
1.2.4 指标测定 血浆采用全自动生化分析仪依据试剂盒说明书测定TG[8]、LDL-C[9]、HDL-C[10]、TC[11]含量。血浆及肝脏中SOD[12]、GSH[13]、MDA[14]、GSH-Px[15]含量均按试剂盒说明进行测定。肝脏蛋白定量按试剂盒说明用BCA法[16]测定。血浆中8-ISO-PGF2α[17]含量按ELISA试剂盒说明进行测定。
1.3 数据处理
实验数据用完全随机设计的独立样本t检验,以平均数±标准差()表示,用SPSS 13.0统计软件处理。p<0.05表示差异显著,p<0.01表示差异极显著。
2 结果与分析
2.1 对小鼠体重及肝脏指数的影响
图1表示对小鼠体重及肝脏指数的影响,由图1(A)可见,随着饲养时间的增加,各组小鼠体重均呈现出不同的增加趋势,与模型对照组相比,草果低剂量组、高剂量组的初始体重、中期体重、解剖前体重均无显著性差异(p>0.05)。空白对照组、模型对照组、草果低剂量组、草果高剂量组的平均日进食量分别为(5.08±0.26)、(5.00±0.18)、(4.90±0.11g)、(4.88± 0.12)g,各组间平均日进食量均无显著差异(p>0.05),说明草果甲醇溶出物对小鼠的正常生长及体重没有显著的影响。由图1(B)可见,草果实验组与模型对照和空白组相比,肝脏指数虽有差别,但各组之间比较,经统计学分析无显著性差异(p>0.05),说明草果甲醇溶出物对小鼠肝脏生理没有显著影响。
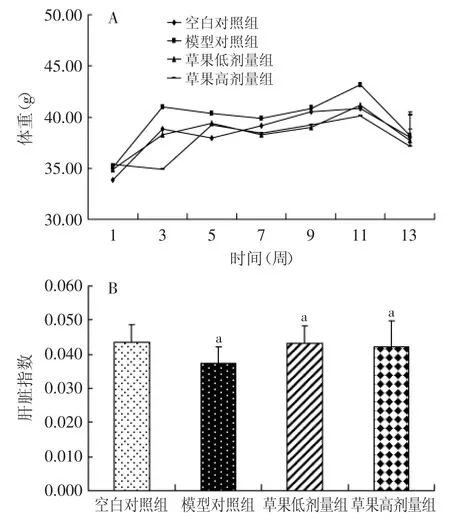
图1 各组小鼠体重的变化及肝脏指数的变化Fig.1 Body weight and ratio of liver to body weight
2.2 对小鼠血脂指标的影响
图2表示对小鼠血浆中甘油三酯、低密度脂蛋白、高密度脂蛋白、总胆固醇含量的影响,由图2A可见,模型组甘油三酯含量比空白对照组有增加趋势,但无显著性差异(p>0.05),与模型组相比,草果低剂量组能明显降低TG的含量,差异极显著(p<0.01),草果高剂量组,虽有降低趋势,但无显著性差异(p>0.05)。由图2(B~D)可见,各组间LDL-C、HDL-C、TC含量虽然有所差别,但无显著性差异(p>0.05)。
2.3 对小鼠抗氧化指标的影响
图3表示对小鼠肝组织及血浆中SOD活力的影响。由图3(A)可见,模型对照组肝组织SOD活力与空白对照组相比极显著降低(p<0.01),与模型对照组相比,草果低、高剂量组均能升高肝组织SOD活力水平,均存在极显著差异(p<0.01)。由图3(B)可见,模型对照组血浆SOD活力与空白对照组相比显著降低(p<0.05),与模型对照组相比,草果低剂量组能显著升高血浆SOD活力水平(p<0.05),高剂量组能极显著升高SOD活力水平(p<0.01),此外,与草果低剂量组相比,草果高剂量组可显著提高血浆SOD活性(p<0.05),且高剂量组与空白对照组相比血浆SOD活力极显著升高(p<0.01),以上结果表明草果甲醇溶出物能够有效的提高SOD的活性。
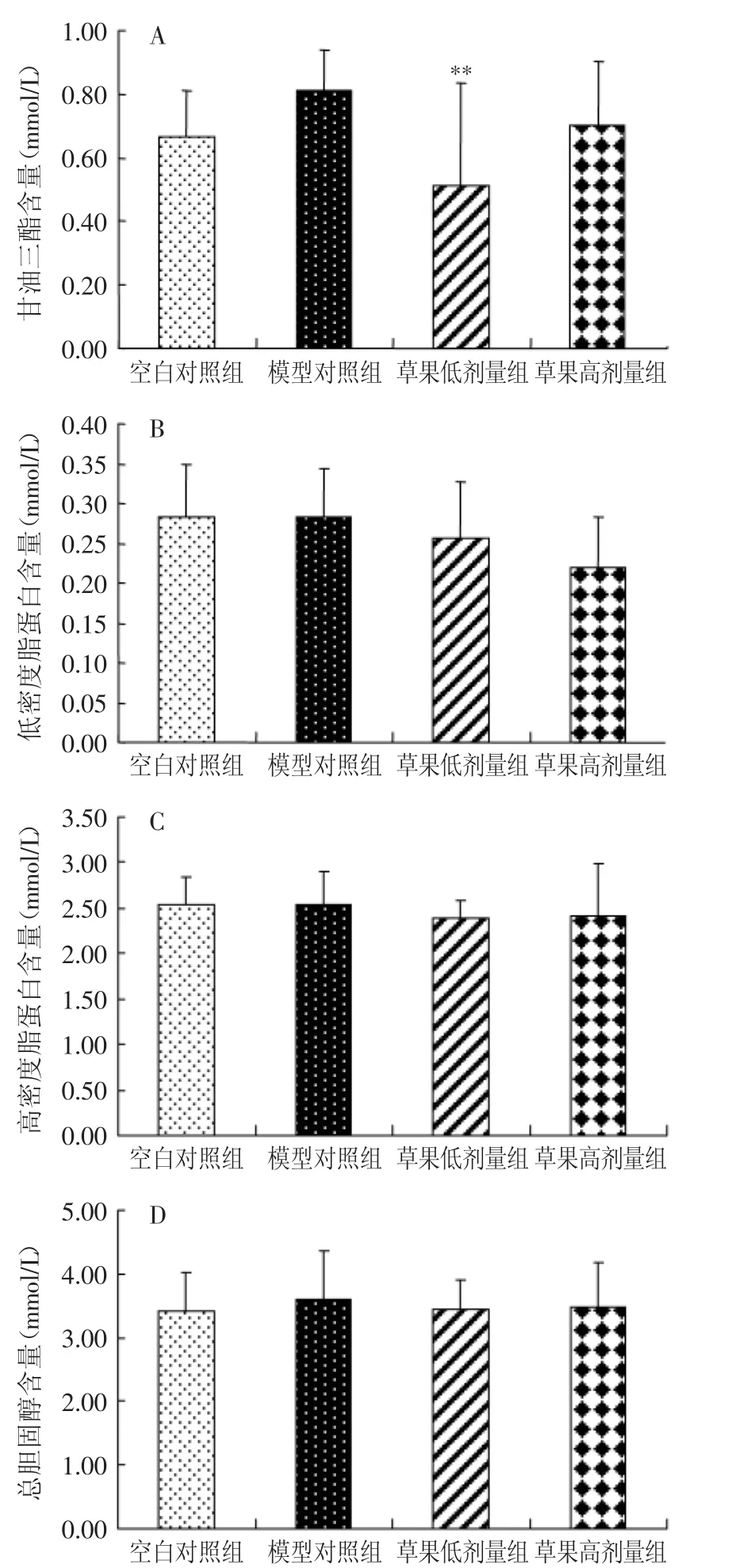
图2 各组小鼠血浆甘油三酯、低密度脂蛋白、高密度脂蛋白、总胆固醇含量的变化Fig.2 Triglyceride,low density lipoprotein,high density lipoprotein,total cholesterol
图4表示对小鼠肝组织及血浆中GSH含量的影响。由图4(A)可见,模型对照组肝组织GSH含量与空白对照组相比极显著降低(p<0.01),与模型对照组相比,草果低剂量组有升高肝组织GSH水平的趋势,但无显著性差异(p>0.05),草果高剂量组能极显著升高肝组织GSH水平(p<0.01)。由图4(B)可见,模型对照组血浆GSH含量与空白对照组相比极显著降低(p<0.01),与模型对照组相比,草果低、高剂量组均能极显著升高血浆GSH含量(p<0.01),此外,与草果低剂量组相比,草果高剂量组可显著增加血浆GSH含量(p<0.05),与空白对照组相比,草果低、高剂量组也均能极显著升高血浆GSH含量(p<0.01),表明草果甲醇溶出物能够有效增加体内GSH含量。
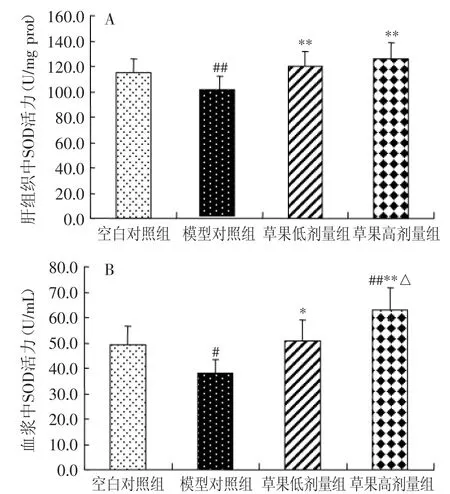
图3 不同饲料组小鼠肝组织及血浆中SOD活力的变化Fig.3 SOD activity in mice fed the control and experimental diets
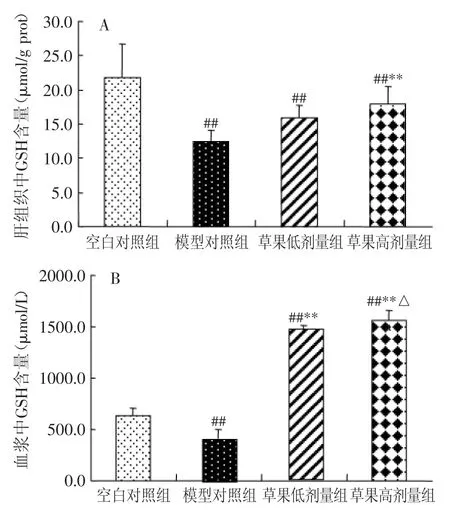
图4 不同饲料组小鼠肝组织及血浆中GSH含量的变化Fig.4 The content of GSH in mice fed the control and experimental diets
图5表示对小鼠肝组织及血浆中GSH-Px活力的影响。由图5(A)可见,模型对照组肝组织GSH-Px活力与空白对照组相比极显著降低(p<0.01),与模型对照组相比,草果低、高剂量组均能升高肝组织GSHPx活力水平,且均存在极显著差异(p<0.01),此外,与草果低剂量组相比,草果高剂量组可显著提高肝组织GSH-Px活性(p<0.05)。由图5(B)可见,模型对照组血浆GSH-Px活力与空白对照组相比极显著降低(p<0.01),与模型对照组相比,草果低剂量组有升高血浆GSH-Px活力水平的趋势,但无显著性差异(p>0.05),草果高剂量组能极显著升高血浆GSH-Px活力水平(p<0.01),此外,与模型对照组相比,草果高剂量组可显著提高血浆GSH-Px活性(p<0.05),说明血浆GSH-Px活性与草果甲醇溶出物的用量关系密切。
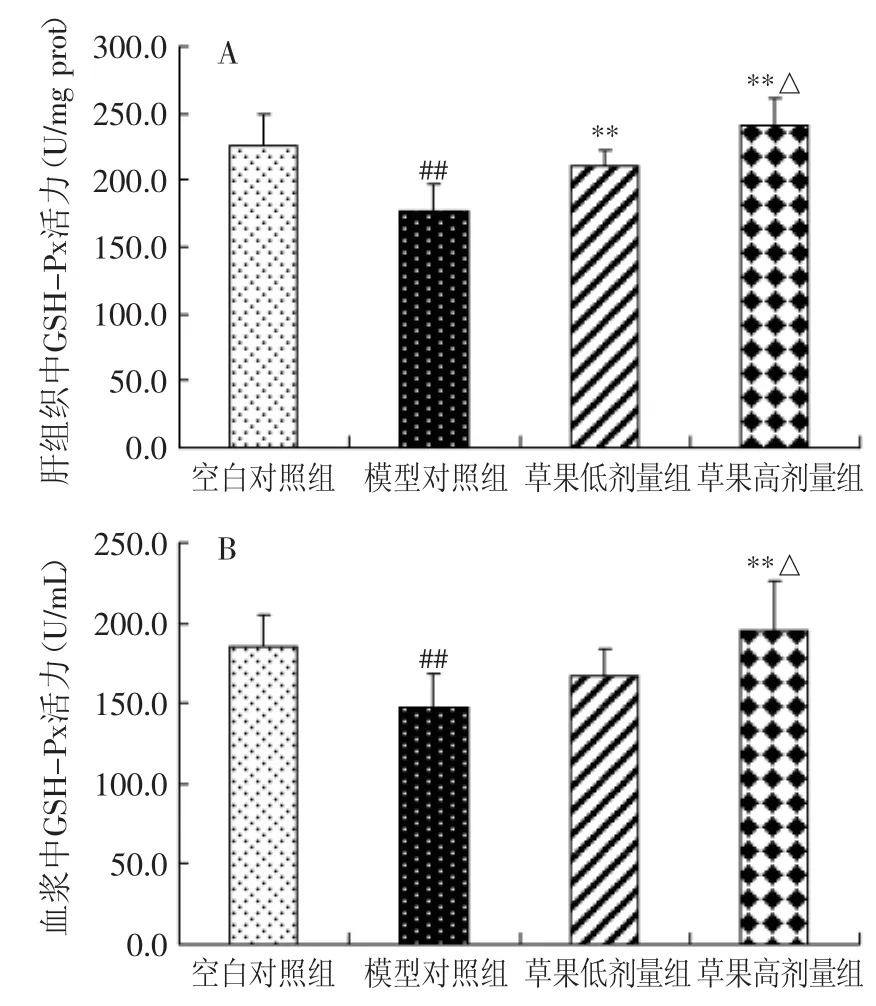
图5 不同饲料组小鼠肝组织及血浆中GSH-Px活力的变化Fig.5 GSH-Px activity in mice fed the control and experimental diets
图6表示对小鼠肝组织和血浆中MDA含量及小鼠血浆中8-ISO-PGF2α含量的影响。由图6(A)可见,模型对照组肝组织脂质过氧化物MDA含量与空白对照组相比极显著升高(p<0.01),与模型对照组相比,草果低、高剂量组均能显著降低肝组织MDA含量(p<0.05)。由图6(B)可见,模型对照组血浆MDA含量与空白对照组相比极显著升高(p<0.01),与模型对照组相比,草果低剂量组、高剂量组均能极显著降低血浆MDA含量(p<0.01)。由图6(C)可见,模型对照组血浆8-ISO-PGF2α含量与空白对照组相比极显著升高(p<0.01),与模型对照组相比,草果低剂量组有降低血浆8-ISO-PGF2α含量的趋势,但无显著性差异(p>0.05),草果高剂量组能显著降低血浆8-ISO-PGF2α含量(p<0.05)。
3 讨论
对小鼠长期注射D-半乳糖是制备小鼠衰老模型的经典方法[18-19]。小鼠对高脂饲料的摄入将导致其甘油三酯和总胆固醇升高,增加肝脏代谢的负担,会加速机体衰老进程或引发相关疾病[20-21]。本实验利用D-半乳糖联合高脂饲料建立小鼠衰老模型,与空白对照组相比,模型对照组小鼠呈现明显衰老体征,血脂指标存在差异,抗氧化指标差异显著(p<0.05),说明该方法建立的小鼠衰老模型效果良好,可应用于抗衰老保健品的研究。如图2所示,与模型对照组相比,草果低剂量组的TG含量明显降低,并有显著性差异,而高剂量组差异不明显;草果低剂量组、高剂量组均有降低血脂LDL-C、TC含量的趋势和升高HDL-C含量的趋势,但无显著性差异。这与我们前期研究结论一致,即草果不仅能够降低血糖,还具有降血脂和减肥的功效,其甲醇溶出组分中的特殊极性脂溶性物质可降低甘油三酯[6]。另外,吕美[32]通过ABTS、DPPH和FRAP法对17种常见香辛料的抗氧化作用的研究表明,草果具有较好的清除自由基的能力。李婷[22]以16种香辛料为研究对象,准确称取各香辛料5g,与乙醇按照1∶50(g/mL)进行浸泡6h,超声波萃取60min,抽滤,60℃恒温下烘干,对香辛料提取物进行DPPH清除率测定,发现草果的DPPH清除率最高,为0.82790,表明草果具有很好的抗氧化活性。我们前期的研究结果也表明草果具有很好的抗氧化活性[23-24]。宋启示[25]将草果干果(5.0kg)经捣碎后用甲醇加热回流提取3次。提取液合并后减压浓缩至无甲醇,混悬于水,依次用石油醚、氯仿、乙酸乙酯和正丁醇萃取,得到石油醚萃取物(74g)、氯仿萃取物(69g)、乙酸乙酯萃取物(28g),正丁醇萃取物(28g)和水层部分(99g)。氯仿、乙酸乙酯和正丁醇萃取物分别用硅胶和反相硅胶柱层析进行反复分离,分离到13个化学成分,经鉴定,其中3个为结构类型不同的新化合物,即草果素(tsaokoin)为具有双环壬烷新骨架的新颖结构类型化合物;草果酮(tsaokone)为新的二苯庚烷类化合物;草果甙(tsaokoside)为新的半日花烷型二萜配糖体,并证明草果中的酚类物质具有较强的抗脂质过氧化作用。
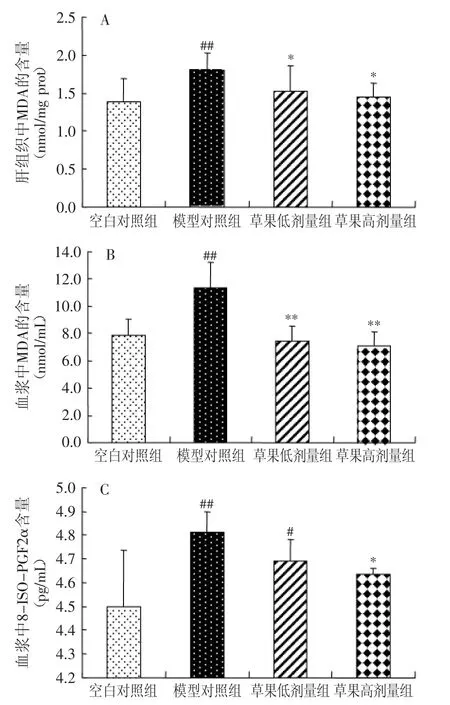
图6 不同饲料组小鼠肝组织和血浆中MDA及血浆中8-ISO-PGF2α含量的变化Fig.6 The content of MDA and 8-ISO-PGF2α in mice fed the control and experimental diets
在异常情况下,机体防御机制失衡,会导致自由基的大量产生,对机体产生毒害作用,从而导致机体的衰老和死亡[22]。国内外研究表明,多数香辛料具有较强的抗氧化性能,其主要的抗氧化成分为多酚类及其衍生物、黄酮类、豆香精类等。胡忠泽等[23]通过从姜黄属植物提取出的姜黄素进行小鼠抗氧化研究,证明添加姜黄素的饲料具有升高小鼠血清和组织SOD活性及降低MDA含量的作用。李远坤等[24]发现生姜的提取物姜油树脂可以升高小鼠肝组织SOD活性,降低肝组织MDA含量。何文珊等[25]从生姜中分离出一种新的环状二苯基庚烷类化合物亦可降低小鼠肝组织中MDA的含量。在本实验结果中,由图3和图6(A)、图6(B)可看出,与模型对照组比较,草果实验组均能显著降低小鼠血浆与肝组织中MDA含量,提高SOD活性,与上述研究结果一致。此外,与草果低剂量组相比,草果高剂量组可显著提高血浆SOD活性,证明体内SOD活性与草果甲醇溶出物的摄取量有关。
GSH与GSH-Px均可衡量机体的抗氧化能力。张迪等[26]进行了熟地黄对慢性温和性应激小鼠的抗氧化作用的研究,表明其具有提高小鼠肝组织GSH含量的作用。张元菊等[27]发现姜科植物姜黄的提取物姜黄素具有提高小鼠脑组织GSH-Px活性的作用。曹亚军等[28]通过生姜醇提取物对亚急性衰老小鼠抗脂质过氧化作用的研究,证实该提取物能显著提高衰老小鼠血清、肝脏及脑组织中的GSH-Px的活性。夏道宗等[29]从另一姜科植物提取出的高良姜素可提高小鼠脑组织与肝组织的GSH-Px活性。本实验与上述研究结果相一致,由图4、图5可见,与模型对照组比较,草果实验组可显著提高小鼠血浆及肝组织中GSH含量及GSHPx活性。除肝组织GSH外,草果高剂量组与低剂量组之间均有统计学差异,说明草果甲醇溶出物的用量对体内GSH含量及GSH-Px活性均产生显著的影响。
8-ISO-PGF2α被认为是反映自由基和脂质过氧化反应的特异性、可靠的指标[30]。师玲玲等[19]对心肌缺血大鼠的研究表明,急性心肌缺血时存在氧自由基损伤,8-ISO-PGF2α含量明显增加。由图6(C)可看出,与模型对照组相比,草果高剂量组能显著降低血浆8-ISO-PGF2α的含量,表明草果甲醇溶出物能够较好的抑制体内8-ISO-PGF2α含量增高。
综上,姜黄、生姜等多种姜科植物均有很好的抗氧化活性,而同属姜科植物的草果可能含有与其他姜科植物类似的功效成分,这些成分通过增强机体清除氧自由基的能力,减少体内自由基产生,进而保护细胞免受氧化损伤[31]。与模型对照组相比,草果实验组能显著提高血浆及肝组织GSH含量、SOD与GSH-Px活力,并能显著降低MDA与8-ISO-PGF2α含量,说明草果甲醇提取物具有良好的抗衰老作用。与空白对照组相比,草果实验组的血浆SOD活力和GSH含量亦有显著提高,说明草果甲醇溶出物还能延缓正常小鼠的衰老进程,随着这些结果进一步解明,草果的生理活性物质将可应于第三代保健食品的研究开发。
4 结论
本研究通过测定小鼠血浆及肝组织中SOD、GSHPx活力,血浆及肝组织中GSH、MDA含量,以及血浆中8-ISO-PGF2α含量来评价草果甲醇溶出物的抗氧化能力。本次实验结果证明,体内SOD活性与草果甲醇溶出物的摄取量有关;草果甲醇溶出物的用量对体内GSH含量及GSH-Px活性均产生显著的影响;草果甲醇溶出物能够较好的抑制体内8-ISO-PGF2α含量增高。以上研究结果说明草果含有多种生理活性成分和作用,尤其是抗老化作用非常突出,但有关草果功效成分的构效、量效关系及作用机理研究,目前国内外还处于空白状态,在今后的研究中应逐步得到解明。
[1]丁艳霞,谢欣梅,崔秀明.不同方法提取草果挥发油的化学成分[J].河南大学学报:医学版,2009,28(4):284-287.
[2]代敏,彭成.草果的化学成分及其药理作用研究进展[J].中药与临床,2011,2(4):55-59.
[3]俞龙泉,王惠英,段书德,等.草果中乙醇提取物对小白鼠生理调节的影响[J].食品科技,2012(10):182-186.
[4]郑建仙.功能食品[M].北京:中国轻工业出版社,1995.
[5]敬璞,丁晓雯,苏晔.柑桔皮水提液在小鼠体内的抗氧化作用研究[J].西南农业大学学报:自然科学版,2003,25(3):265-266.
[6]Yu L,Shirai N,SUZUKI H.Effects of some Chinese spices on body weights,plasma lipids,lipid peroxides,and glucose,and liver lipids in mice[J].Food Sci Technol Res,2007,13(2):155-161.
[7]中国食品药品监督管理局.保健食品抗氧化功能评价方法[S].2012.
[8]Trinder P.Triglycerides estimation by GPO-PAP method[J]. Ann Clin Chem,1969(6):24-27.
[9]袁德辉,林革,陈坚泳.直接法测定低密度脂蛋白胆固醇[J].生物化学与生物物理进展,2000,27(5):562-564.
[10]渠巍,张华,鲁力.直接法测定高密度脂蛋白胆固醇(HDL-C)试剂性能评价[J].江西医学检验,2007,25(5):479-480.
[11]李勇.酶标仪比色法测定血清三酰甘油,总胆固醇方法探讨[J].检验医学与临床.2010,7(16):1748-1750.
[12]Peskin AV,Winterbourn CC.A microtiter plate assay for superoxide dismutase using a water-soluble tetrazolium salt(WST-1)[J].Clin Chim Acta,2000,293(1-2):157-166.
[13]Smith IK,Vierheller TL,Thorne CA.Assay of glutathione reductase in crude tissue homogenates using 5,5’-dithiobis(2-nitrobenzoic acid)[J].Anal Biochem,1988,175(2):408-413.
[14]Fernandez J,Perez-Alvarez J,Fernandez-Lopez J. Thiobarbituric acid test for monitoring lipid oxidation in meat[J]. Food Chem,1997,59(3):345-353.
[15]Wendel A.Glutathione peroxidase[J].Method Enzymol,1981,77:325.
[16]Brown RE,Jarvis KL,Hyland KJ.Protein measurement using bicinchoninic acid:elimination of interfering substances[J]. Anal Biochem,1989,180(1):136-139.
[17]陈玲玲,肖昕,向军俭.8-异前列腺素f2α的检测及其临床价值[J].国外医学(临床生物化学与检验学分册),2004,25(5):408-410.
[18]秦红兵,杨朝晔,范忆江,等.D-半乳糖诱导衰老小鼠模型的建立与评价[J].中国组织工程研究与临床康复,2009,13(7):1275-1278.
[19]师玲玲,肖昕,刘誉,等.心肌缺血大鼠血浆8-异前列腺素F2α水平及N-乙酰半胱氨酸干预作用[J].中国当代儿科杂志,2005,7(1):8-11.
[20]Yang R-l,Li W,Shi Y-H,et al.Lipoic acid prevents highfat diet-induced dyslipidemia and oxidative stress:A microarray analysis[J].Nutrition,2008,24(6):582-588.
[21]文静,林志伟,周绪霞,等.枯草芽孢杆菌B10对饲喂高脂日粮小鼠抗氧化功能的影响[J].中国兽医学报,2012,32(1):111-114.
[22]李婷.草果抗氧化活性成分提取分离,鉴定及应用研究[D].海口:海南大学,2008.
[23]YU L,SHIRAI N,SUZUKI H,et al.Effect of lipid extracted from tsao-ko(Amomum tsao-ko Crevost et Lemaire)on digestive enzyme activity,antioxidant activity,plasma and liver lipids,and blood glucose levels of mice[J].J Nutr Sci Vitaminol,2008,54(5):378-383.
[24]YU L,SHIRAI N,SUZUKI H,et al.The Effect of Methanol Extracts of Tsao-ko(Amomum tsao-ko Crevost et Lemaire)on Digestive Enzyme and Antioxidant Activity In Vitro,and Plasma Lipids and Glucose and Liver Lipids in Mice[J].J Nutr Sci Vitaminol,2010,56(3):171-176.
[25]宋启示.几种热带植物的化学生态学研究[D].昆明:中国科学院昆明植物研究所,2003.
[26]王书华,杨国栋,饶娜,等.金莲花中荭草苷和牡荆苷对D-半乳糖致衰小鼠体内抗氧化作用的影响[J].中国老年学杂志,2012,31(24):4818-4820.
[27]胡忠泽,王立克,杨久峰,等.姜黄素对小鼠抗氧化酶活性及NO含量的影响[J].安徽技术师范学院学报,2005,18(6):5-7.
[28]李远坤,彭景,徐迪波.姜油树脂各部位体外抗氧化活性的比较[J].江苏调味副食品,2010(4):6-9.
[29]何文珊,李琳,李炎,等.生姜中一种新化合物的抗氧化活性[J].中国病理生理杂志,2001,17(5):78-80.
[30]张迪.熟地黄及其不同部位的抗氧化作用研究[D].济南:山东大学,2009.
[31]张元菊,王琦,李玲,等.次声对小鼠脑组织氧化状态的影响及姜黄素的脑保护效应观察[J].中华物理医学与康复杂志,2007,29(2):104-106.
[32]曹亚军,马建慧,陈虹,等.生姜醇提取物对亚急性衰老小鼠抗脂质过氧化作用的研究[J].现代预防医学,2007,34(12):2253-2254.
[33]夏道宗,励建荣,刘杰尔,等.高良姜总黄酮的超声萃取及其体外抗氧化作用研究[J].中国食品学报,2009,9(3):63-69.
[34]王兆钺,张磬,韩崇旭,等.8-表氧-前列腺素F2α放射免疫分析及其临床应用[J].中华核医学杂志,1999,19(4):240-242.
[35]栾海云.左卡尼汀对D-半乳糖致衰老小鼠抗氧化作用的研究[J].湖北农业科学,2012,51(1):129-130.
[36]吕美.香辛料的抗氧化性及其对煎烤牛肉饼中杂环胺形成的影响[D].无锡:江南大学,2011.
Study on mechanism of antioxidant effect of methanol extracts from tsao-ko(amomum tsao-ko crevost et lemaire)in aged mice induced by D-galactose
YAN Qian1,YU Long-quan2,*,CHEN Ye1,WANG Hong-tao3,ZHANG Qiu-yan3,WEI Gang3
(1.College of Food Engineering and Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China;2.School of Chemical Engineering,Shijiazhuang University,Shijiazhuang 050035,China;3.Yiling Medicinal Academy,Shijiazhuang 050035,China)
Objective:To investigate the antioxidant effect of bioactive substances from tsao-ko in the aged ICR mice induced by D-galactose.Methods:Aged mice induced by high fat diet and D-galactose were feeding separately with different kinds of diets.High dose of tsao-ko was 200mg/kg,low dose of tsao-ko was 100mg/kg. The level of SOD,GSH,GSH-Px,MDA and 8-ISO-PGF2α in plasma,liver was investigated in aged mice in the experiment of the antioxidant activity in vivo.Results:Compared with the control group about the data of plasma,the activity of SOD in the aged mice conducted with tsao-ko was significantly improved(p<0.01),the content of GSH of mice deposed with tsao-ko was significantly improved(p<0.01),the activity of GSH-Px in the aged mice conducted with high dose of tsao-ko was significantly improved(p<0.01),the content of MDA in the aged mice conducted with tsao-ko was lower(p<0.05),the content of 8-ISO-PGF2α in the aged mice conduced with high doses of tsao-ko was lower(p<0.05).Compared with the control group about the data of liver,the activity of SOD of mice conducted with low dose of tsao-ko was improved(p<0.05)and significantly improved with high dose(p<0.01),the content of GSH in the aged mice conducted with high dose of tsao-ko was significantly improved(p<0.01),the activity of GSH-Px of mice conducted with tsao-ko was improved significantly(p<0.01),the content of MDA in the aged mice conducted with tsao-ko was lower significantly(p<0.01).Conclusion:The methanol extract of tsao-ko could increase the level of SOD,GSH,GSH-Px and reduce MDA and 8-ISO-PGF2α.
tsao-ko;methanol extract;D-galactose;antioxidant effect;mice
TS201.4
A
1002-0306(2014)06-0351-07
2013-08-28 *通讯联系人
闫倩(1989-),女,硕士研究生,研究方向:食品营养。

