米糠蛋白肽制备过程中褐变控制及脱色工艺研究
刘 颖,窦博鑫,李 坤,张 帅,韩春然
(哈尔滨商业大学食品工程学院,黑龙江哈尔滨150076)
米糠蛋白肽制备过程中褐变控制及脱色工艺研究
刘 颖,窦博鑫,李 坤,张 帅,韩春然
(哈尔滨商业大学食品工程学院,黑龙江哈尔滨150076)
对酶解法制备得到的米糠蛋白肽进行精制,先后抑制制备过程中褐变反应发生、对米糠蛋白肽进行澄清及脱色工艺研究。确定浓度0.15%柠檬酸、0.15%L-半胱氨酸及3.0%抗坏血酸的复配抑制剂为米糠蛋白酶解制备过程中的最佳褐变抑制剂,此时蛋白肽色素抑制率达80.80%、水解度7.42%、氮溶解指数92.46%。灭酶过程的最佳澄清条件为pH4.0、温度100℃、加热10min、3000r/min离心20min,肽液透光度达89.12%。粉末活性炭为最优的脱色吸附剂,其脱色适宜工艺条件:粉末活性炭用量3.0%、pH=4.0、脱色温度60℃、吸附时间50min,此时米糠蛋白肽脱色率达81.45%,肽损失率10.11%。
米糠蛋白肽,抑制褐变,脱色,澄清
米糠蛋白是一种必需氨基酸种类齐全、低过敏性的高营养价值植物性蛋白。经一定条件酶解,可以得到具有调节人体生理节律、增强机体免疫、抵抗疾病等生物功能的活性多肽—米糠蛋白肽[1-2]。它兼具米糠蛋白的优点,同时吸收速率更快[3-7]。然而,酶解法制备米糠蛋白肽的过程中常常发生褐变反应。其中一种为酶促褐变,发生在底物、酶类物质和氧共存的情况下,酚类物质在多酚氧化酶(Polyphenol oxidase,PPO)的作用下被氧化生成醌类物质,醌类聚合形成褐色物质而导致组织色泽加深[7-9]。另外一种是非酶促褐变,即在没有酶参与的情况下发生褐变,氧化和聚合成为黑色素,包括美拉德反应、焦糖化反应、抗坏血酸氧化分解、多元酚氧化缩合[9-11]。目前主要的抑制褐变的总体方法包括:控制加工机贮存条件、添加褐变抑制剂、采用大孔吸附树脂和活性炭脱色等,随着近年来对非酶褐变抑制方法研究越来越深入,大大地扩展了研究发展空间[12-13],其中常用的褐变抑制剂包括柠檬酸、L-半胱氨酸、抗坏血酸等。应用化学物质防止褐变发生是重要的方法之一,其中酸处理是利用酸有效控制酶促褐变,从而降低体系pH以减弱酚酶活力。酚酶的活性在pH=4.5以上开始增强,在pH5.0~7.0时逐渐达到最高,pH低于2.5时几乎完全失活。柠檬酸在抑制酶促褐变方面具有双重作用,不但可以作为酸味剂降低体系pH,而且还可作为络合剂,与从多酚氧化酶上解离下来的铜离子作用,形成络合物,降低酚酶的活性。抗坏血酸不但能降低体系pH,而且具有还原剂的作用,可将体系中醌类及其衍生物还原成酚,并通过自身过高或添加的抗坏血酸过少,会使抗坏血酸完全氧化并与氨基酸反应导致非酶褐变。
近些年国外对抑制蛋白肽制备过程中的褐变已有研究[6-7,12],本实验针对酶解法制备米糠蛋白肽过程中的褐变进行了深入研究,并对鲜有报道的柠檬酸、L-半胱氨酸、抗坏血酸的复配进行了初步研究。首先针对酶解法制备米糠蛋白肽工艺条件,对制备过程进行了褐变抑制作用研究,其主要针对总体褐变抑制反应;然后对灭酶过程中的米糠蛋白肽进行了澄清实验以提高其透光度,最后对蛋白肽液进行了吸附脱色实验研究,得到色泽及品质均较佳的米糠蛋白肽成品。
1 材料与方法
1.1 材料与仪器
米糠蛋白 实验室碱法自制;木瓜蛋白酶、碱性蛋白酶、中性蛋白酶、复合蛋白酶、风味蛋白酶 诺维信公司北京办事处提供;磷酸氢二钠、磷酸二氢钠 哈尔滨市新春化工厂;盐酸 哈尔滨市新达化工厂;氢氧化钠 天津市大陆化学试剂厂;考马斯亮蓝G-250 Amresco公司;抗坏血酸、柠檬酸、L-半胱氨酸 天津市风船化学试剂科技有限公司;福林试剂 实验室自制;碳酸钠 天津市天新精细化工开发中心;磷酸 天津市化学试剂六厂分厂;X-5大孔树脂、乙醇 天津市天新精细化工开发中心;牛血清蛋白 北京奥博星生物技术责任有限公司;颗粒活性炭、粉末活性炭 天津市科密欧化学试剂有限公司。
80-2离心机 上海浦东物理光学仪器厂;SY-2-4恒温水浴锅 天津市欧诺仪器仪表有限公司;Spectrum721E紫外可见分光光度计 上海光谱仪器有限公司;HEQ-C空气振荡器 哈尔滨东联电子技术开发公司;BS224S电子分析天平 赛多利斯科学仪器有限公司;pHS-3C精密pH计 上海雷磁仪器厂;JJ-l电动搅拌器 常州国华电器有限公司;XWC-100/1制冷式样品粉碎机 上海思尔达科学仪器有限公司;HNY-100B恒温培养箱、EMS-9A磁力搅拌器 天津市欧诺仪器仪表有限公司;ZHWY恒温摇床培养箱 上海智城分析仪器制造有限公司;DRTG-81分体式透光率测试仪 广州市东儒电子科技有限公司。
1.2 实验方法
1.2.1 褐变抑制剂对米糠蛋白肽制备过程中的褐变控制 以水解度、氮溶解指数、色素抑制率为实验指标,底物浓度3.0%米糠蛋白溶液中,分别添加如下褐变抑制剂:a.浓度分别为0.10%、0.15%、0.20%的L-半胱氨酸;b.浓度分别为2.0%、3.0%、4.0%的抗坏血酸;c.浓度分别为0.15%、0.3%、0.45%的柠檬酸;d.0.15%半胱氨酸、3.0%抗坏血酸、0.15%柠檬酸三者复配抑制剂,添加1500U/g碱性蛋白酶,酶解温度50℃,pH为8.5,酶解4h。
1.2.2 米糠蛋白肽液灭酶过程中的澄清实验
1.2.2.1 加热温度对灭酶过程中米糠蛋白肽液透光率的影响 0.5mol/mL HCl调节米糠蛋白酶解液pH至4.5,分别在80、85、90、95、100℃条件下,恒温加热15min,3000r/min离心15min,保留上清液并测其透光率。
1.2.2.2 加热时间对灭酶过程中米糠蛋白肽液透光率的影响 0.5mol/mL HCl调节酶解液pH至4.5,分别于100℃恒温加热10、15、20、25、30、35、40、45min,3000r/min分别离心15min,保留上清液并测其透光率。
1.2.2.3 离心时间对灭酶过程中米糠蛋白肽液透光率的影响 0.5mol/mL HCl调节酶解液pH至4.5,在100℃下分别加热10min,3000r/min分别离心5、10、15、20、25min,保留上清液并测其透光率。
1.2.2.4 pH对灭酶过程中米糠蛋白肽液透光率的影响 0.5mol/mL HCl调酶解液pH分别至7.0、6.5、6.0、5.5、5.0、4.5、4.0、3.5、3.0,100℃加热10min,3000r/min离心20min,保留上清液并测其透光率。
以上米糠蛋白肽液灭酶过程中的澄清实验的对照组条件均为:0.5mol/mL HCl调节米糠蛋白酶解液pH至4.5,分别在80℃条件下,恒温加热15min,3000r/min离心15min。
1.2.3 筛选米糠蛋白肽的脱色吸附剂
1.2.3.1 大孔树脂对米糠蛋白肽的脱色效果 温度25℃,按比例1∶10(g∶mL)采用X-5树脂与米糠蛋白酶解液进行脱色吸附,振荡速度120r/min,吸附2h后[3,10,16],测上清液脱色率。
1.2.3.2 活性炭对米糠蛋白肽的吸附脱色效果 取三等份米糠蛋白酶解液,用1.0mol/L HCl调其pH均至4.0,按3.0%添加量分别加入大颗粒活性炭、小颗粒活性炭、粉末活性炭[14-17]。50℃恒温吸附30min,用2.0mol/L NaOH调pH至9.0,过滤,测滤液脱色率。
1.2.4 粉末活性炭对米糠蛋白肽的吸附脱色实验
1.2.4.1 粉末活性炭添加量对米糠蛋白肽脱色效果的影响 调蛋白酶解液pH至4.0,粉末活性炭添加量分别为1.0%、1.5%、2.0%、2.5%、3.0%、3.5%,50℃恒温吸附30min。调节脱色液pH至9.0,考察滤液的脱色率、肽损失率。
1.2.4.2 吸附时间对米糠蛋白肽脱色效果的影响 调蛋白酶解液pH至4.0,活性炭用量2.5%,温度50℃恒温吸附时间分别为30、40、50、60、70、80min。调节脱色液pH至9.0,考察滤液的脱色率、肽损失率。
1.2.4.3 pH对米糠蛋白肽脱色效果的影响 调节蛋白酶解液pH分别至3.0、4.0、5.0、6.0、7.0、8.0,活性炭用量为2.5%,50℃恒温吸附30min。调节脱色液pH至9.0,考察滤液的脱色率、肽损失率。
1.2.4.4 温度对米糠蛋白肽脱色效果的影响 调蛋白酶解液pH至4.0,活性炭用量2.5%,温度分别为30、40、50、60、70、80℃进行恒温脱色30min。调节脱色液pH至9.0,考察滤液的脱色率、肽损失率[18-22]。
1.2.4.5 米糠蛋白肽脱色的正交实验优化 根据单因素实验,粉末活性炭的添加量、吸附时间、脱色pH和脱色温度这四个因素对米糠蛋白肽脱色实验均具有显著性影响(p<0.05)。选取四因素三水平正交表安排正交实验,如表1所示。
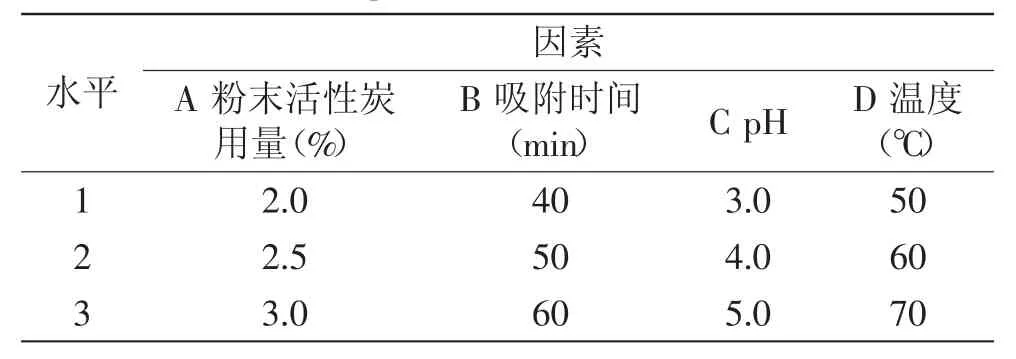
表1 粉末活性炭吸附脱色的因素水平表Table.1 Factors and levels of powdered activated carbon adsorption and decolorization
1.2.5 相关实验指标的测定
1.2.5.1 水解度的测定 采用pH-state法测定米糠蛋白酶解产物的水解度(DH)[23]。即用0.5mol/L的NaOH分别将水解开始及结束时的反应体系pH调至7.0,记录所消耗碱液体积。水解度的计算式为:
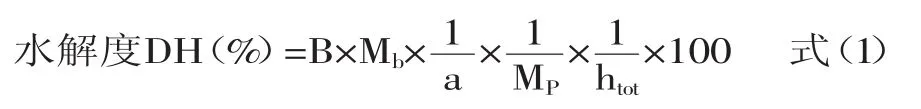
式中:B-碱液NaOH的消耗体积,mL;Mb-碱液NaOH的摩尔浓度,0.5mol/L;1/α=在pH=7.0,50℃实验条件下,1/α=2.26;MP-样品蛋白质的总量,g;htot-每克原料蛋白质中肽键的毫摩尔数,htot=8.20mmol/g。
1.2.5.2 氮溶解指数的测定 根据刘海梅等的研究结果[24],取米糠蛋白酶解物溶液10mL,用1.0mol/L的HCl或NaOH调节pH至7.0,静置20min后,4000r/min离心20min,取上清液测总氮量。
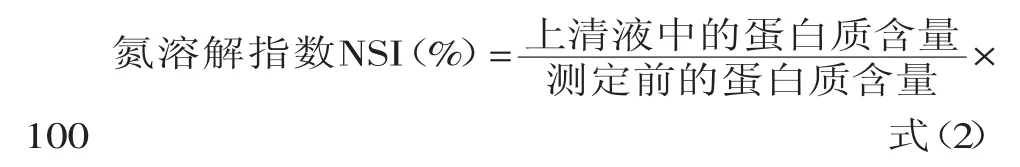
1.2.5.3 色素抑制率的测定 计算公式如下:
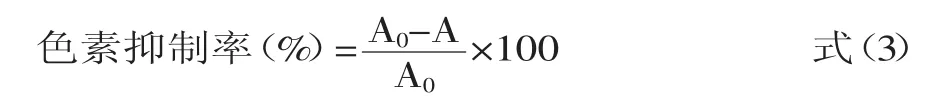
式中,A0—未经抑制色变的蛋白水解液于波长360nm处的吸光度;A—经抑制色变的蛋白水解液于波长360nm处的吸光度。
1.2.5.4 脱色率的测定 计算公式如下:

式中,脱色前A360—未经抑制色变的蛋白水解液于波长360nm处的吸光度;脱色后A360—经抑制色变的蛋白水解液于波长360nm处的吸光度。
1.2.5.5 肽损失率的测定 计算公式如下:

1.2.5.6 透光率的测定 计算公式如下:

式中:I-脱色前的透光度;I0-脱色后的透光度。
1.2.5.7 蛋白质含量的测定 采用GB/T 5009.5-2003中叙述的凯氏定氮法测定制备出的米糠蛋白及其蛋白水解物的总氮含量,然后换算成蛋白质含量。
2 结果与讨论
2.1 确定米糠蛋白肽中色素物质的最大吸收波长
由波长340~450nm扫描图谱1可知,米糠蛋白肽的色素物质在360nm处有最大吸收波长,故后续测褐变度时所用波长为360nm。
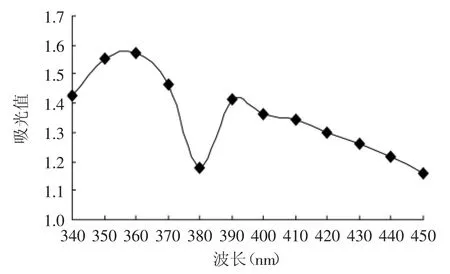
图1 米糠蛋白肽色素物质的最大吸收峰图谱Fig.1 The maximum absorption peak of rice bran protein peptide
2.2 褐变抑制剂对制备米糠蛋白肽过程中的褐变控制
2.2.1 L-半胱氨酸对制备米糠蛋白肽过程中的褐变控制 添加不同浓度的L-半胱氨酸反应后,测得蛋白肽液各指标如图2所示。L-半胱氨酸等含硫氨基酸是醌类物质能够与半胱氨酸形成无色的复合物,中断了醌类物质集合形成色素物质;其次,L-半胱氨酸可通过与PPO活性位点的铜离子不可逆结合而抑制酶活性,或者代替PPO活性位点的组氨酸残基;最后,L-半胱氨酸阻止酚类的聚合,抑制效果因抑制剂的种类及其浓度不同而有所差异。半胱氨酸浓度0.15%时,米糠蛋白肽的色素抑制率、水解度、氮溶解指数均达到最大,分别为73.91%、7.21%、88.09%。故确定L-半胱氨酸对制备米糠蛋白肽过程中褐变的最佳浓度为0.15%。
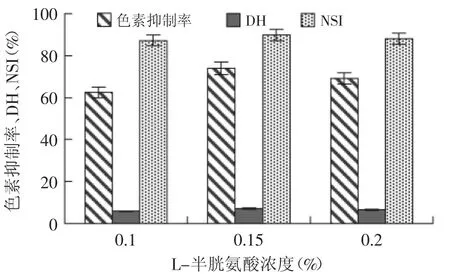
图2 L-半胱氨酸对制备米糠蛋白肽过程中的褐变控制Fig.2 Using L-cysteine to inhibite browning for the preparation rice bran protein peptides
2.2.2 抗坏血酸对制备米糠蛋白肽过程中的褐变控制 制备米糠蛋白肽过程中添加抗坏血酸反应后,测得各指标如图3所示。抗坏血酸具有还原性,作为还原剂将氧化的醌类物质及其衍生物还原成酚类物质,阻止醌类物质进一步自发聚合形成色素物质;同时抗坏血酸还可降低体系pH,并通过自身氧化来减少体系的含氧量,抗坏血酸也是使用最多的褐变抑制剂。抗坏血酸浓度3.0%时,酶解产物色素抑制率、水解度,分别为64.35%、6.61%,均比其浓度在2.0%和4.0%时水平高;氮溶解指数也达到了86.78%,符合实验要求。因此综合考虑各指标,确定抗坏血酸对制备米糠蛋白肽过程中褐变的最佳浓度为3.0%。
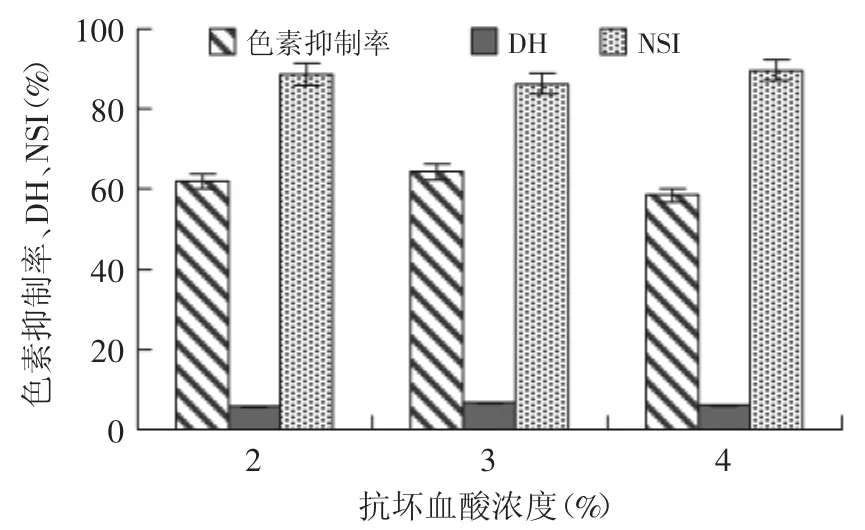
图3 抗坏血酸对制备米糠蛋白肽过程中的褐变控制Fig.3 Using ascorbic acid to inhibite browning in the preparation process of rice bran protein peptides
2.2.3 柠檬酸对制备米糠蛋白肽过程中的褐变控制
制备米糠蛋白肽过程中添加柠檬酸反应后,测得各指标如图4所示。多酚氧化酶活性在pH4.5以上条件下开始增强,pH5~7时逐渐达到最高,低于2.5时几乎完全失活。通过使用酸化剂降低pH抑制酶促褐变已得到广泛地应用。柠檬酸是最常用的酸化剂,它能降低产品的pH,同时与从PPO上解离下来的铜离子发生络合作用,形成配合化合物可抑制PPO的活性。柠檬酸浓度0.15%时,酶解产物色素抑制率、氮溶解指数分别为76.85%、91.78%,均达到最高水平;水解度为5.54%,符合制备蛋白肽的实验要求。当柠檬酸浓度继续升高或降低时,可能是由于与铜离子络合效果不好或离子强度不够,色素抑制率反而降低。综合考虑,确定柠檬酸对制备米糠蛋白肽过程中褐变的最佳浓度为0.15%。
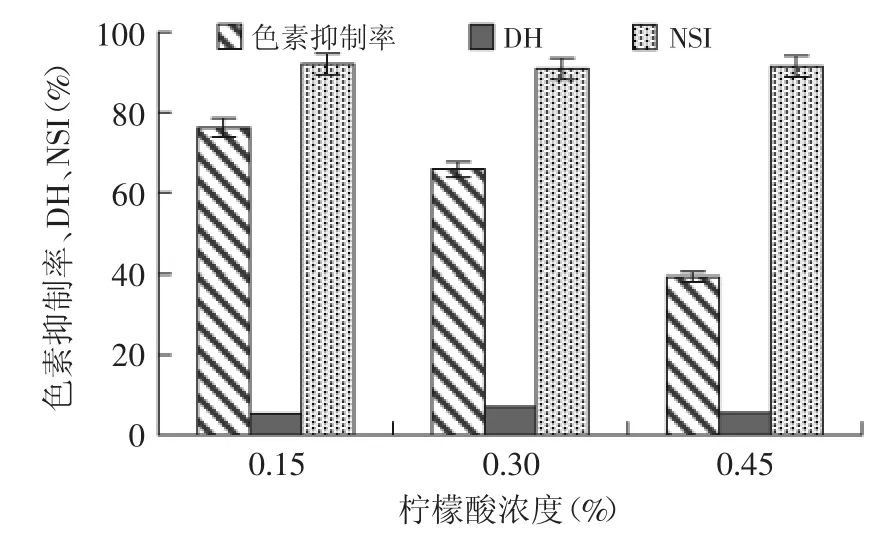
图4 柠檬酸对制备米糠蛋白肽过程中的褐变控制Fig.4 Using citric acid to inhibite browning in the preparation process of rice bran protein peptides
2.2.4 复合抑制剂对制备米糠蛋白肽过程中的褐变控制 将复合褐变抑制剂添加至米糠蛋白溶液,蛋白酶酶解后测定各指标,发现色素抑制率和氮溶解指数明显改善,水解度也得到较好的控制。实验最终确定采用0.15%柠檬酸、3.0%抗坏血酸、0.15%半胱氨酸这三种褐变抑制剂复合,用此复合褐变抑制剂对制备米糠蛋白肽过程中的褐变控制,此时色素抑制率80.8%、水解度7.42%、氮溶解指数92.46%。
2.3 米糠蛋白肽液灭酶过程中的澄清实验
2.3.1 加热温度对灭酶过程中米糠蛋白肽液透光率的影响 由图5可知,灭酶过程的温度从80℃上升至100℃时,肽液澄清度随温度的增加而显著增加(p<0.05),加热10min对肽液澄清度既有明显改善,颜色呈澄清淡棕色;另一方面,实际生产过程中,如若温度继续升高就需考虑设备加压及生产的安全性,成本大幅度提升,所以确定灭酶温度为100℃。
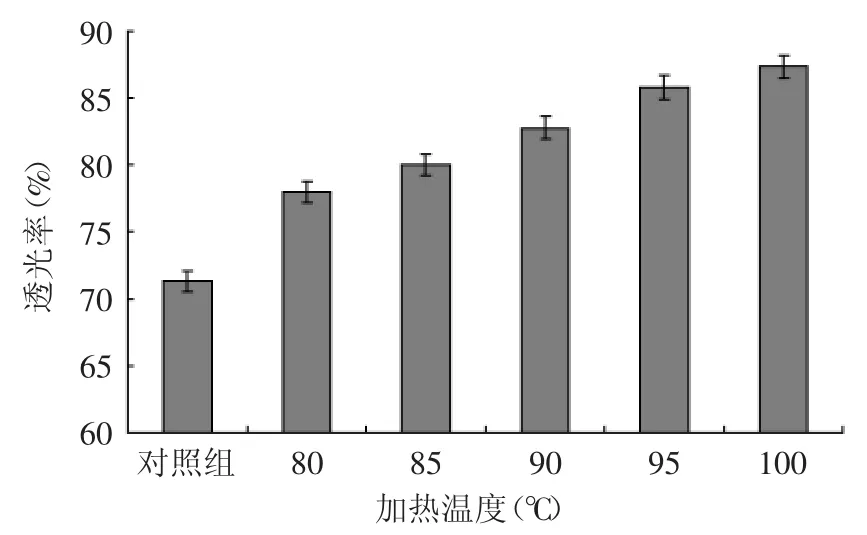
图5 加热温度对米糠蛋白肽液透光率的影响Fig.5 Effect of heating temperature on transmittance of rice bran protein peptides
2.3.2 加热时间对灭酶过程中米糠蛋白肽液透光率的影响 从图6可知,加热对米糠肽液澄清度影响显著(p<0.05),表明加热对肽液透光度影响显著。加热至10min时,肽液透光率已为86.91%,达到预期的澄清目标;加热时间继续升高,肽液的澄清效果变化不明显,同时还增加实验成本及实际生产的成本,故加热时间确定为10min。
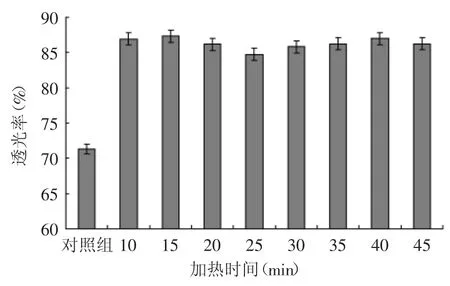
图6 加热时间对米糠蛋白肽液透光率的影响Fig.6 Effect of heating time on transmittance of rice bran protein peptides
2.3.3 离心时间对灭酶过程中米糠蛋白肽液透光率的影响 图7表明灭酶过程中离心时间对肽液透光率影响显著(p<0.05),随着离心时间延长,肽液透光度越高,肽液越澄清,但离心时间延长至20min时的透光率已无明显提升,综合考虑确定离心时间为20min。
2.3.4 pH对灭酶过程中米糠蛋白肽液透光率的影响由图8可知,米糠蛋白肽液透光率随着pH升高而呈现先升高,后略微降低;当pH在5.0~7.0时,肽液的离心上清液外观浑浊不清,可能还残存未能聚集沉淀的大分子量蛋白,对蛋白肽液的透光度改善效果不佳;pH在3.0~4.5范围时,肽液澄清度透明,透光度均保持在85.0%以上,当pH=4.0时的透光率达到最高为89.12%。
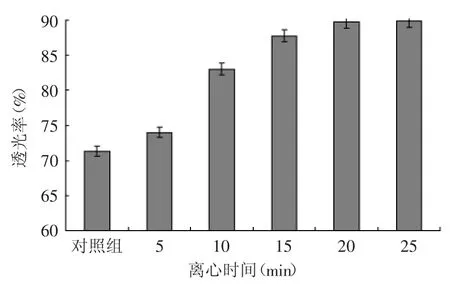
图7 离心时间对米糠蛋白肽液透光率的影响Fig.7 Effect of centrifugation time on transmittance of rice bran protein peptides
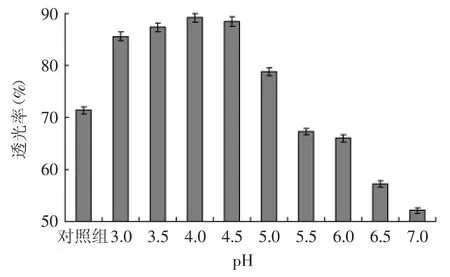
图8 pH对米糠蛋白肽液透光率的影响Fig.8 Effect of pH on transmittance of rice bran protein peptides
2.4 筛选米糠蛋白肽的脱色吸附剂
粉末活性炭脱色效果明显优于颗粒活性炭及X-5大孔树脂,其脱色率为71.4%,故本实验选取粉末活性炭对米糠蛋白肽进行吸附脱色,并优化其脱色吸附工艺。
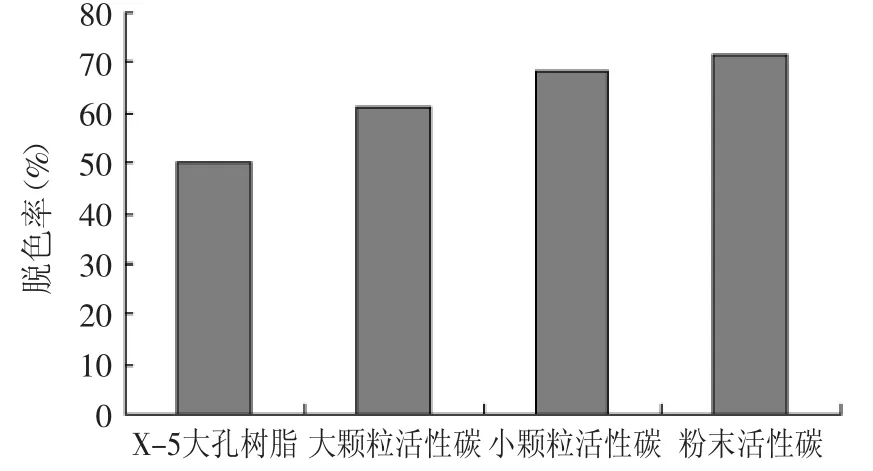
图9 比较不同吸附剂对米糠蛋白肽的脱色效果Fig.9 Comparison of different adsorbents on removal effect of rice bran protein peptide
2.5 粉末活性炭对米糠蛋白肽的吸附脱色研究
2.5.1 粉末活性炭添加量对米糠蛋白肽脱色的影响
米糠蛋白酶解液中添加粉末活性炭,脱色效果如图10所示。随着粉末活性炭用量增加至2.5%时,脱色率显著增加(p<0.05),最大达到72.64%,此时肽损失率13.12%;随着蛋白肽以及色素物质与粉末活性炭接触时间的延长,会增大肽损失率,故确定粉末活性炭对米糠蛋白肽吸附脱色的添加量为2.5%。
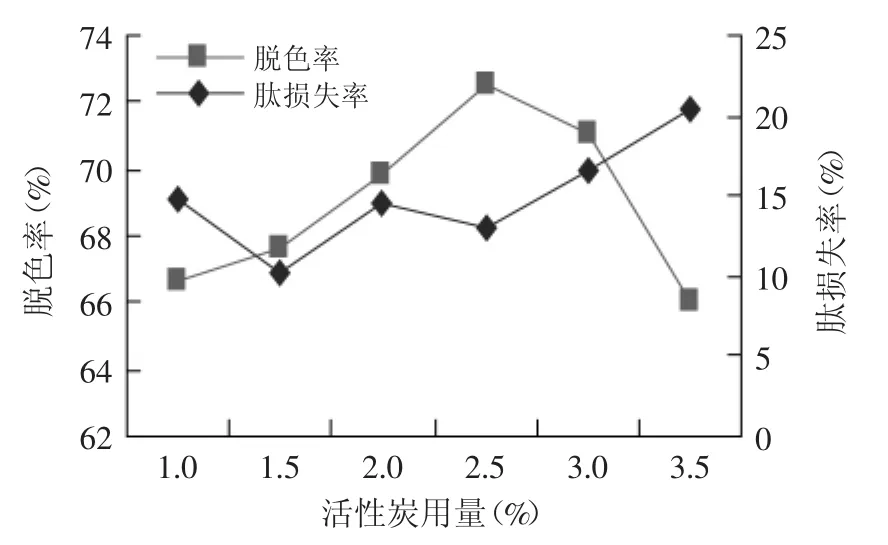
图10 粉末活性炭用量对米糠蛋白肽脱色效果的影响Fig.10 Influence of powder activated carbon dosage on the decolorization of rice bran protein peptide
2.5.2 吸附时间对米糠蛋白肽脱色效果的影响 比较不同时间内活性炭的脱色效果如图11所示,随着脱色时间延长,色素和米糠蛋白肽与活性炭表面接触越来越充分,前40min的肽液脱色率显著升高(p<0.05),肽损失率先呈平缓趋势,50min时脱色率达到75.3%,肽损失率仅8.9%;70min后肽损失显著上升(p<0.05),此时脱色率与50min时相当,故选择50min为最佳吸附时间。

图11 吸附时间对米糠蛋白肽脱色效果的影响Fig.11 Influence of adsorption time on the decolorization of rice bran protein peptide
2.5.3 pH对米糠蛋白肽脱色效果的影响 不同pH对米糠蛋白肽脱色效果的影响结果见图12,脱色率随着pH增高而不断降低,酸性条件下粉末活性炭吸附色素的效果明显优于碱性环境;酶解液酸性越高,脱色效果越好。在pH=5.0左右时,由于在米糠蛋白等电点附近,肽分子相互聚集,容易被吸附除去,故肽损失率最大[25];而后随着pH升高,肽损失率及脱色率均显著减小(p<0.05),为达到脱色目的,最终确定pH=4.0为粉末活性炭对米糠蛋白肽吸附脱色的最佳pH,此时肽液脱色率76.13%、肽损失率21.07%。
2.5.4 温度对米糠蛋白肽脱色的影响 比较不同温度对粉末活性炭吸附米糠蛋白肽的色素效果影响由图13所示,活性炭脱色是一个吸热过程,随着温度提升,液体粘度降低,有利于溶液中色素分子的扩散,与活性炭颗粒充分接触,脱色效果显著上升(p<0.05),而此加热过程中的肽损失率则呈现先上升、再下降、随即再上升的变化趋势,温度不当会对肽液品质产生不良影响[26-27]。综合考虑,确定吸附温度为60℃,此时肽液脱色率79.90%、肽损失率12.74%。

图12 pH对米糠蛋白肽脱色效果的影响Fig.12 Influence of pH on the decolorization of rice bran protein peptide
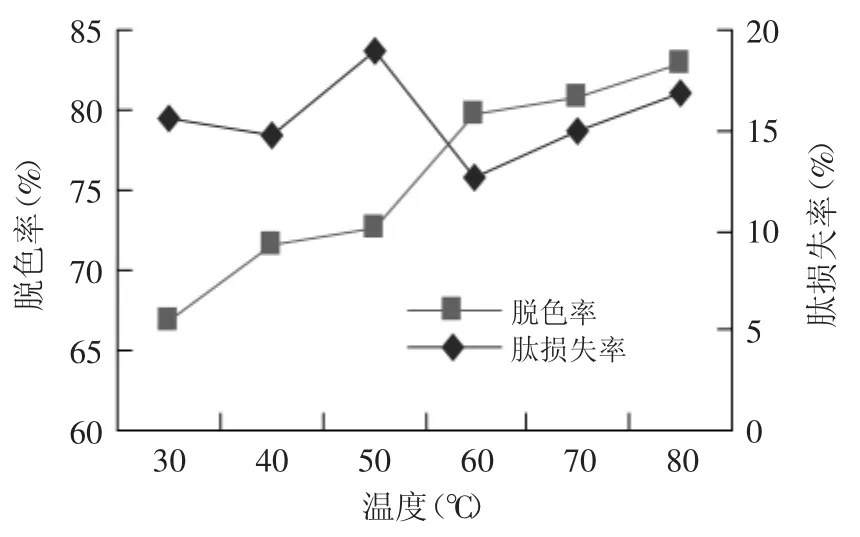
图13 吸附温度对米糠蛋白肽脱色效果的影响Fig.13 Influence of adsorption temperature on the decolorization of rice bran protein peptide
2.5.4 粉末活性炭对米糠蛋白肽脱色的正交实验 从正交表中得出结果,对脱色率影响顺序:粉末活性炭用量>pH>吸附温度>吸附时间,最佳工艺条件A3B2C2D2,即粉末活性炭添加量3.0%、pH=4.0、吸附温度60℃、吸附时间50min;对肽损失率影响顺序:粉末活性炭用量>pH>吸附温度>吸附时间,最佳工艺条件A1B3C2D1,即粉末活性炭添加量2.0%、pH=4.0、吸附温度50℃、吸附时间60min。本实验主要目的是探究米糠蛋白肽制备过程中的抑制褐变作用及其脱色作用效果,故此部分以脱色率为主要指标,最终确定粉末活性炭吸附脱色米糠蛋白肽的适宜条件:粉末活性炭用量3.0%、pH=4.0、脱色温度60℃、吸附时间50min,此时米糠蛋白肽液脱色率81.45%、肽损失率仅为10.11%。
3 结论
本实验先后抑制了酶解法制备米糠蛋白肽过程中褐变反应发生、对蛋白肽进行澄清及脱色实验研究,针对米糠蛋白肽进行了精制,得到以下实验结论:
3.1 底物浓度3.0%、加酶量为1500U/g、酶解温度50℃、pH=8.5、酶解时间4h的酶解制备条件下,确定复配抑制剂即浓度0.15%柠檬酸、0.15%L-半胱氨酸及3.0%抗坏血酸,作为米糠蛋白肽酶解制备时添加的最佳褐变抑制剂,此时得到的米糠蛋白肽的色素抑制率为80.8%、水解度为7.42%、氮溶解指数为92.46%。
3.2 米糠蛋白肽液在灭酶过程中的最佳澄清工艺条件:在100℃、pH4.0、加热10min、3000r/min离心20min时,米糠蛋白肽液透光度可达89.12%。
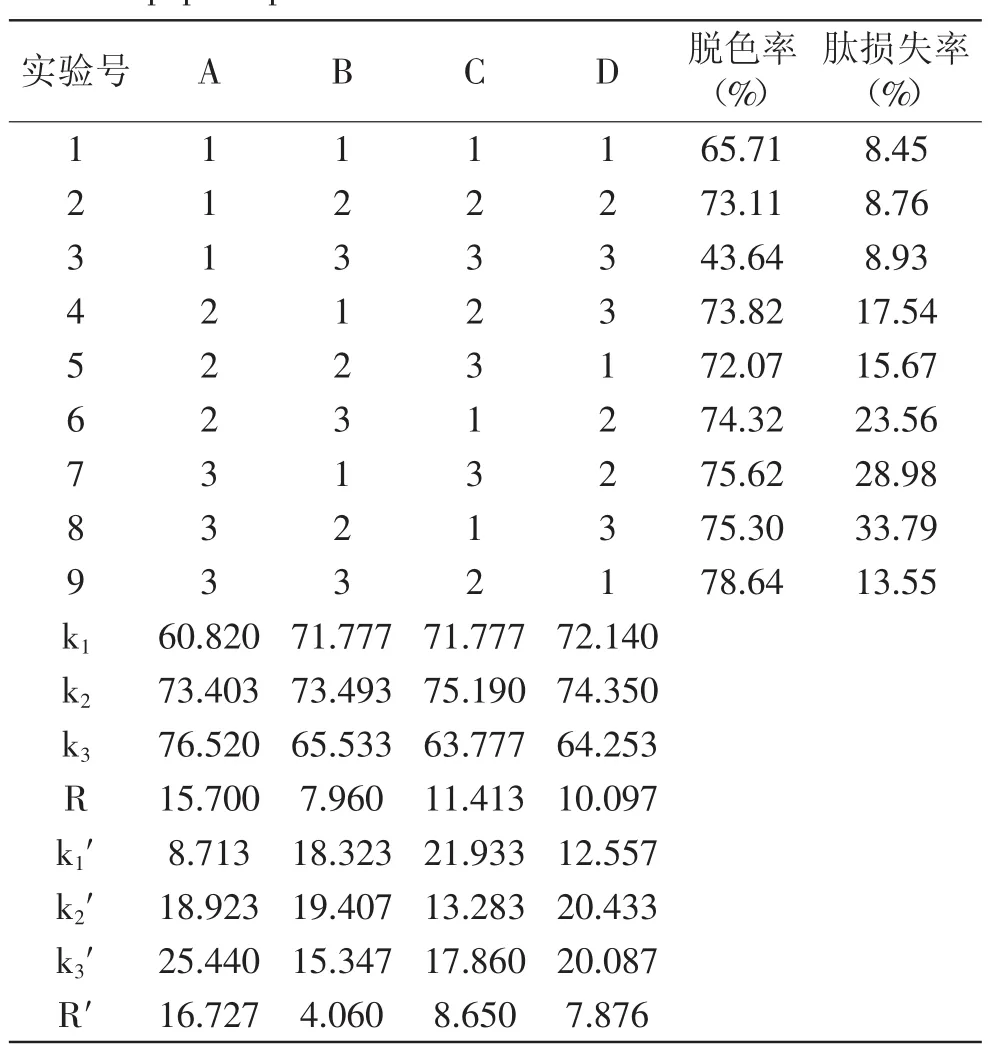
表2 粉末活性炭对米糠蛋白肽脱色的正交实验结果Table.2 The results of orthogonal test for rice bran protein peptide powder activated carbon decolorization
3.3 粉末活性炭为米糠蛋白酶解液脱色实验的最佳吸附剂,其最佳吸附脱色工艺条件为:粉末活性炭用量3.0%、pH=4、脱色温度60℃、吸附时间50min,在此条件下米糠蛋白肽液脱色率为81.45%,肽损失率10.11%。
[1]许均华.花生分离蛋白肽酶解制备工艺优化及其功能特性研究[D].长沙:中南大学,2012.
[2]王慧.酶法提取米糠蛋白及其褐变抑制[D].哈尔滨:东北农业大学,2008.
[3]朱海峰,班玉凤,赵薇,等.大豆蛋白酶解制寡肽过程中褐变的抑制[J].食品科技,2004(5):14-17.
[4]Clare DA,Swaisgood HE.Bioactive Milk Peptides:A Prospectus [J].Journal of Dairy Science,2000,83(6):1187-1195.
[5]周利亘,王君虹,陈新峰,等.大豆多肽脱色工艺优化研究[J].食品科技,2004(12):22-25.
[6]Hamada JS.Characterization of protein fractions of rice bran to devise effective methods of protein solubilization[J].Cereal Chemistry,2000,74(5):662-668.
[7]Yoshikawa M,Kishi K,Takahashi M,et al.Immunomodulating peptide derived from soybean protein[J].New york Acad of Sci,1993(3):375-376.
[8]吕磊.大枣多糖的提取分离与脱色研究[D].西安:西北大学,2003.
[9]李小蓉,黄毓娟,权彦.倒卵叶五加多糖脱色工艺研究[J].食品工业科技,2013,34(4):296-299.
[10]袁红波,张劲松,贾薇.利用大孔树脂对低分子灵芝多糖脱色的研究[J].食品工业科技,2009,30(3):204-205.
[11]刘大川,周俊梅.富硒菜籽蛋白肽的精制研究[J].食品科学,2008,29(1):129-133.
[12]Sukhontha S,Chockchai T.Effect of commercially defatted rice bran extract on browning ofvegetable and fruit puree[J]. Natural Science,2011,45(4):730-735.
[13]左莹,张萍.果胶脱色技术研究进展[J].安徽化学通讯,2010,16(20):44-46.
[14]王芙蓉,黄文,陈红秀,等.谷氨酸菌体蛋白酸水解及脱色工艺研究[J].食品科学,2005,26(7):155-157.
[15]何新华,郑青松,刘玲,等.菊芋菊粉纯化中脱蛋白和脱色工艺条件研究[J].南京农业大学学报,2009,32(3):83-87.
[16]王跃生,汪洋.大孔吸附树脂研究进展[J].中国中药杂志,2006,31(12):961-965.
[17]夏翠,熊双丽,彭天蓉,等.夏枯草多糖脱色工艺研究[J].安徽农业科学,2009,37(6):2552-2603.
[18]赵振国.吸附作用应用原理[M].北京:化学工业出版社,2005.
[19]王颉,张子德,刘彩莉.鸭梨汁加工过程中褐变的控制及澄清方法研究[J].中国食品学报,2002,2(4):61-64.
[20]尤久勇.牡蛎蛋白饮料色泽变化及其控制技术研究[D].湛江:广东海洋大学,2011.
[21]周小华,汤正延.褐变蚕蛹分离蛋白脱色与改性研究[J].天然产物研究与开发,2001,14(3):30-34.
[22]高雪.柑橘钙结合蛋白基因的克隆及其在果皮褐变中的表达分析[J].生物技术通报,2011(3):53-57.
[23]袁斌,吕桂善,刘小玲.蛋白质水解度的简易测定方法[J].广西农业生物科学,2002,21(2):113-115.
[24]刘海梅,熊善柏,谭汝成.脱脂菜籽粕中蛋白质的分步酶水解研究[J].中国油脂,2003,28(7):15-17.
[25]朱新鹏,蔡晓华,谢香洁,等.蚕蛹蛋白脱色精制工艺研究[J].包装与食品机械,2011,29(4):13-16.
[26]YAN Chunyu,TIAN Yang,QIAN Qian,et al.Independent losses of function in a polyphenol oxidase in rice:Differentiation in grain discoloration between subspecies and the role of positive selection under domestication[J].The Plant Cell,2008,20(11):2946-2959.
[27]Kunwadee K,Chockchai T,Keith RC.Effect of preparation conditions on composition and sensory aroma characteristics of acid hydrolyzed rice bran protein concentrate[J].Journal of Cereal Science,2009,2(5):56-60.
Inhibiting browning in preparation process of rice bran protein peptides and bleaching
LIU Ying,DOU Bo-xin,LI Kun,ZHANG Shuai,HAN Chun-ran
(College of Food Engineering,Harbin University of Commerce,Harbin 150076,China)
Rice bran protein peptides were prepared by enzyme hydrolyzing protein isolates,that were refined by inhibiting browning reaction occurred in the preparation process,clarification and decolorization.The optimal browning inhibitor was with 0.15%citric acid,0.15%L-cysteine and 3.0%ascorbic acid in rice bran protein solution during the preparation process,the pigment inhibition rate was 80.8%,the degree of hydrolysis was 7.42%and nitrogen solubility index was 92.46%.Best clarifying conditions of enzyme inactivation process were as follows:pH=4.0,temperature 100℃for 10min,centrifugal time was 3000r/min 20min,transmittance of peptides was 89.12%.Optimum conditions of decolorizing adsorbent with powdered activated carbon were as follows:the dosage of powdered activated carbon was 3.0%,pH=4.0,decolorization temperature was 60℃,adsorption time was 50min.Under these conditions,the decoloration rate reached 81.45%,the loss rate of peptides was 10.11%.
rice bran protein peptides;inhibite browning;discolouration;clarification
TS253.4
B
1002-0306(2014)06-0245-07
2013-06-21
刘颖(1968-),女,博士,教授,研究方向:食品生物技术。
黑龙江省高校科技创新团队建设计划项目(2010td04);黑龙江省科技厅攻关项目(GC12B403)。

