α-乳白蛋白单克隆抗体的制备及斑点印迹定性检测方法的建立
龙彩云,郑义成,程芬芬,杨安树,*,陈红兵
(1.南昌大学食品科学与技术国家重点实验室,江西南昌330047;2.南昌大学中德联合研究院,江西南昌330047)
α-乳白蛋白单克隆抗体的制备及斑点印迹定性检测方法的建立
龙彩云1,2,郑义成1,2,程芬芬1,2,杨安树1,2,*,陈红兵1,2
(1.南昌大学食品科学与技术国家重点实验室,江西南昌330047;2.南昌大学中德联合研究院,江西南昌330047)
以α-乳白蛋白为抗原免疫Balb/c小鼠,采用淋巴细胞杂交瘤技术制备抗α-乳白蛋白单克隆抗体;采用碳二亚胺法,并通过工艺优化,将单抗与量子点高效偶联;在此基础上,建立了基于斑点印迹技术定性检测乳制品中过敏原α-乳白蛋白的方法。结果表明:采用杂交瘤技术制备的单克隆抗体特异性好,与牛奶中其他蛋白无交叉反应;当量子点、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、N-羟基丁二酰亚胺(NHS)、单抗摩尔比为1∶10∶6∶4时,量子点与单抗有较好的偶联效果;以量子点标记单抗建立的斑点印迹方法可直观、快速的定性分析乳制品中过敏原α-乳白蛋白。因此,该方法具有一定的实用价值。
α-乳白蛋白,单克隆抗体,量子点,斑点印迹,定性检测
牛乳及其乳制品中含有丰富的营养成分,是人们摄取蛋白质的重要来源;同时,牛乳又是主要的过敏食物之一[1]。其中,牛乳中α-乳白蛋白与人乳α-乳白蛋白的氨基酸残基有很高的相似度,对初生婴儿来说是一种很重要的蛋白质来源,但该蛋白又被认为是牛乳中主要的过敏原之一[2]。据报道,超过19%的牛乳过敏均是由α-乳白蛋白引起[3]。因此,开展针对食品中α-乳白蛋白的检测研究具有重要的理论和现实意义。
目前,用于过敏原检测的主要方法为酶联免疫吸附法(ELISA),该法具有高的灵敏度,但检测步骤繁琐、费时。在DNA检测水平上,聚合酶链反应法(PCR)因其更高的灵敏度而被报道是最有可能替代ELISA的方法,然而利用PCR法检测过敏原也存在一定的缺陷,即DNA和过敏原的含量之间没有确切的相关性,从而易导致过敏原检测的假阳性或假阴性。
单克隆抗体因其高特异性和灵敏度而广泛应用于医学诊断、食品安全检测等众多领域[4-6]。在食品安全快速检测中,免疫技术结合荧光分析具有快速、简单、灵敏等特点。近年来,在医学、生物学领域,量子点常代替传统的荧光标记物用于免疫学检测[7-12]。基于单克隆抗体识别抗原的特异性和量子点荧光的灵敏性,本文以α-乳白蛋白为抗原免疫小鼠制备单抗,利用碳二亚胺法将抗α-乳白蛋白单抗与CdSe/ZnS量子点偶联,再以量子点标记的抗体构建斑点印迹法来定性检测乳制品中过敏原α-乳白蛋白,弥补了我国基于量子点标记单抗技术快速检测乳制品中过敏原的空白。
1 材料与方法
1.1 材料与仪器
雄性BALB/c小鼠 (20±2)g,6周龄,南昌大学动物实验中心;α-乳白蛋白(纯度≥95%) 实验室自制;α-乳白蛋白标准品、EDC、NHS、明胶、弗氏佐剂 Sigma公司;CdSe/ZnS量子点、Sp2/0小鼠骨髓瘤细胞 江苏无锡中德伯尔生物有限公司;奶茶1、花生牛奶1、奶茶2、酸酸乳、纯牛奶、花生牛奶2 市购;超滤离心管 美国Millipore公司;Sephadex-G200 美国GE公司;其他试剂 均为分析纯。
微量蛋白核酸测定仪、凝胶成像系统 Bio-Rad公司;960CRT荧光分光光度计 上海精科公司;高速冷冻离心机 美国Thermo Fisher公司。
1.2 实验方法
1.2.1 单克隆抗体的制备与纯化 抗α-乳白蛋白单克隆抗体的制备参照Richter等[13]方法。首次免疫将弗氏完全佐剂(CFA)与等体积α-乳白蛋白乳化后皮下多点注射小鼠,剂量为50μg/只,以后每隔14d以弗氏不完全佐剂(IFA)与等体积α-乳白蛋白乳化后免疫小鼠,剂量为50μg/只,共免疫4次。期间采用间接ELISA方法测定小鼠血清效价,待血清效价达到一定水平后,用25μg不加佐剂的抗原采用尾静脉注射途径每只加强免疫1次。于3d后取小鼠脾细胞与生长旺盛期Sp2/0小鼠骨髓瘤细胞通过PEG介导融合并培养,当杂交瘤细胞的培养液开始变黄,或细胞长至孔底1/4时,利用间接ELISA方法检测上清液以筛选出阳性杂交瘤细胞,再以有限稀释法对阳性孔进行亚克隆培养,直至得到100%阳性孔。将得到的单克隆株进行扩大培养后,或通过冻存液处理后转入液氮冻存,或将杂交瘤细胞株注入小鼠腹腔制备腹水单抗,然后采用辛酸-硫酸铵法纯化腹水单抗[14]。利用间接ELISA方法和蛋白微量测定仪分别测定抗体效价和浓度。
1.2.2 免疫印迹检测单克隆抗体的特异性 取乳清及纯化后的α-乳白蛋白进行SDS-PAGE电泳(浓缩胶4%,分离胶12%);电泳结束后,将胶取出置于电印迹缓冲液(10mmol/L CAPS,10%甲醇,pH11.0)中10min,利用半干法于50mA下恒流转膜1h;电转结束后,将PVDF膜置于1%明胶中37℃封阻1h。封阻结束后取出膜,TBST洗涤三次,每次10min,然后于纯化单抗溶液(1∶2000)中4℃孵育反应过夜。转入TBST洗涤三次,加入1∶5000稀释的羊抗鼠酶标二抗溶液(1∶5000)中,37℃下孵育1h。37℃避光显色20min。电转结束后的每一步反应均需用TBST洗涤三次,10min/次。
1.2.3 量子点偶联标记单克隆抗体 采用碳二亚胺法将CdSe/ZnS量子点与抗α-乳白蛋白单抗进行偶联[11,15]。具体方法如下:取0.32nmol的CdSe/ZnS量子点,依次加入EDC和NHS的PBS溶液(pH7.4)活化,分别反应5min,然后加入单抗于37℃摇床上避光反应2h。偶联产物用超滤离心管(MWCO:3000u)离心分离,取上清液用Sephadex-G200层析柱纯化,并在紫外成像系统下观察分析。
1.2.4 样品前处理 对于液态奶制品,取1mL样品于8000r/min下离心10min,去除脂肪层后,分别取10μL稀释100倍后作为检测样品。对于固态奶制品,可用PBS缓冲液配成0.1g/mL的溶液,离心去沉淀,取10μL上清液稀释100倍后作为检测样品。
否则的话,如果认为著作权也如同物权一样,除了赋予著作权人禁止及许可他人以法律规定的方式利用其作品外,还赋予了著作权人以法律规定的方式利用自己作品的自由,那将得出一些荒谬的结论。作者对自己作品的利用,本来就是每个公民的自由,无须法律授权。著作权法中未规定的权利,是著作权人所不能控制的,公众合理利用作品的自由。而保护著作权人自己使用作品的自由不被侵害,根本不是著作权法所要解决的问题。
1.2.5 斑点印迹定性检测 剪取适宜大小的硝酸纤维膜,用铅笔划格,置于PBS缓冲液中活化20min;取出放置一定时间至适宜湿度后,分别吸取3μL倍比稀释的α-乳白蛋白、处理后样品以及PBS缓冲液缓慢点于膜上,在一定湿度、37℃下孵育1h后,再用1%明胶封闭1h;随后吸取等体积量子点标记的单抗分别与抗原反应,37℃下孵育2h。以上每一步骤均须用TBST洗涤三次。完成后,将膜置于紫外成像系统下观察其荧光强度。
2 结果与讨论
2.1 单抗的制备及表征
小鼠免疫过程中抗血清效价的变化趋势见图1,由图1可知,初次免疫后小鼠血清未见明显效价,随着免疫进程的进行,抗血清效价逐渐上升,小鼠免疫4次后,1、3号小鼠血清效价达十万,3号小鼠血清效价上升最为平稳,满足融合实验的要求,因此选取3号小鼠的脾细胞进行细胞融合。
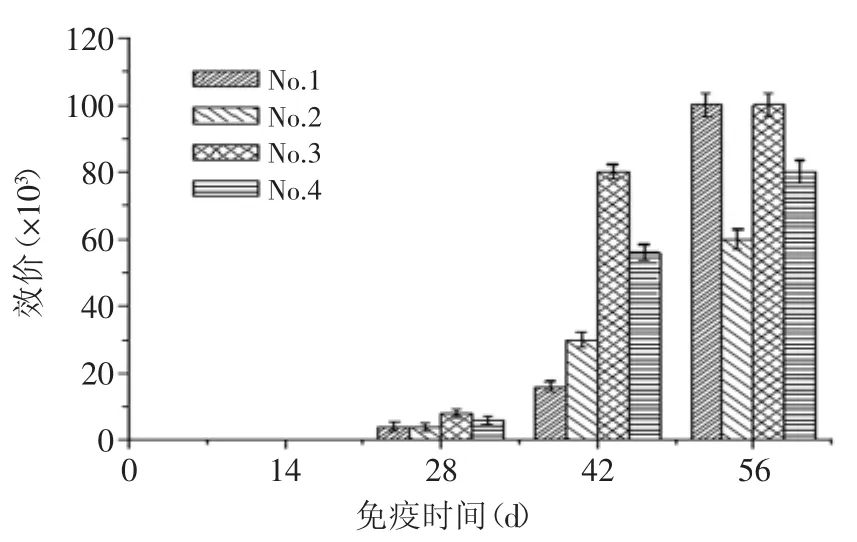
图1 免疫过程中抗血清效价的变化Fig.1 Change of the titer of serum during immunization by ELISA
经过细胞融合、筛选、有限稀释等过程,共得到22株单克隆抗体。根据其亲本细胞所来源的初始细胞孔,挑选4株扩大培养,分别命名为A1G8、K1E1H1、K1E3F6和K1E7。各细胞株通过体内培养诱生法大量制备单抗腹水,测定其效价为3×105。小鼠腹水中还含有白蛋白、脂肪、脂蛋白、转铁蛋白等杂质,本实验选择辛酸-硫酸铵联合沉淀的方法纯化腹水单抗。在酸性(pH4.5)下,非IgG类蛋白成分能被辛酸等短链脂肪酸沉淀,则上清中剩余蛋白主要为IgG类抗体,再用45%饱和硫酸铵溶液沉淀上清液能得到高纯度的IgG抗体。纯化后所得的抗体稀释一定倍数后测定其浓度,结果见表1,从表1中可知纯化所得抗体浓度较高,最低可达3.2mg/mL,可满足后续实验要求。
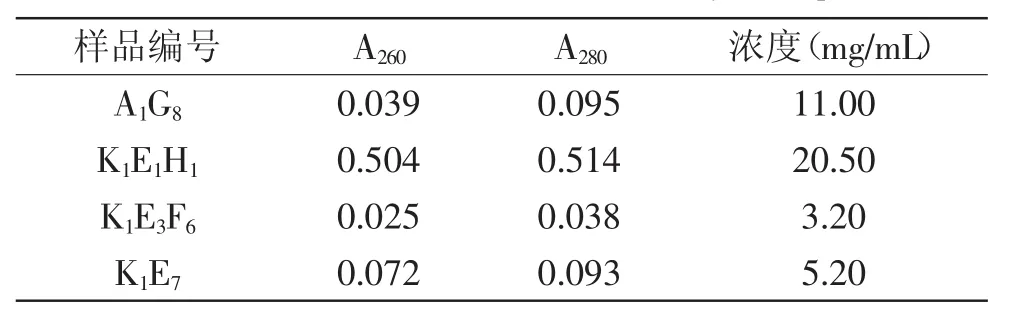
表1 纯化后单克隆抗体浓度Table.1 Concentration of monoclonal antibody after purification
蛋白电泳图及免疫印迹结果如图2所示,从电泳图2(a)中可见,牛乳清蛋白中主要为α-乳白蛋白及β-乳球蛋白条带;而经转膜印迹结果如图2(b)所示,可见在14ku左右有印迹条带,即为α-乳白蛋白印迹条带,而未见β-乳球蛋白等乳清中其他蛋白的印迹条带,表明得到的单克隆抗体对乳白蛋白具有较好的特异性,与乳清中其他蛋白无交叉反应。
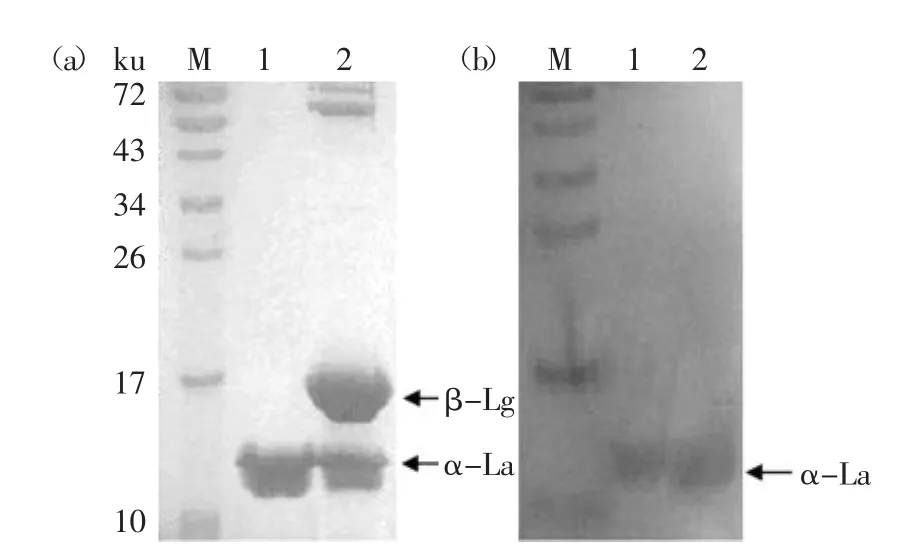
图2 牛乳α乳白蛋白和乳清蛋白SDS-PAGE电泳(a)及免疫印迹(b)Fig.2 SDS-PAGE patterns(a)and western blotting(b)of mAbs with α-La and whey protein注:M:标准蛋白Marker;1:α-乳白蛋白;2:乳清蛋白。
2.2 量子点偶联单抗条件的优化
在偶联反应体系中,当选用摩尔比为量子点∶EDC∶NHS∶单抗=1∶1000∶1000∶2时,反应结束后溶液中有沉淀,通过离心、超滤后,分别取该沉淀及超滤截留液于紫外灯下成像观察,如图3(A)所示,沉淀有较强荧光,而超滤截留液荧光很弱。推测可能是由于EDC、NHS量太高导致量子点完全沉淀或荧光淬灭。减少体系中EDC、NHS的使用量,以量子点∶EDC∶NHS∶单抗=1∶100∶6∶2比例偶联,结果发现溶液中仍然有沉淀,经同样处理后,发现沉淀有较强荧光,超滤截留液有较弱荧光(图3B),说明此次量子点未完全沉淀,但EDC的量仍过多。因此,进一步减少EDC的使用量,按量子点∶EDC∶NHS∶单抗=1∶10∶1∶2比例进行偶联时,没有沉淀出现,偶联物和超滤截留液于紫外下观察(图3C),均有较强荧光,但强度不均匀,这可能是EDC和NHS的比例不合适,或单抗量少,从而造成偶联反应混乱,偶联率低。因此,选用量子点∶EDC∶NHS∶单抗=1∶10∶6∶4比例偶联,同样未发现沉淀,从图3(D)中可见,偶联产物经超滤浓缩后滤液无荧光,截留液荧光较强且均匀,可见在此比例下偶联效果较好。
EDC与NHS是常用的偶联试剂[16-17],在中性条件下,EDC可与量子点表面羧基反应,生成酯类活性中间体QD-EDC,该中间体的酯键不稳定、易水解;而在NHS存在的情况下,该中间体可与NHS反应生成另一活性中间体QD-NHS,QD-NHS较QD-EDC更稳定。在有氨基存在下,QD-NHS的酯键可水解,并与蛋白质表面的氨基共价结合形成肽键。通过优化偶联条件发现EDC的使用量过多会造成量子点沉淀或荧光淬灭,原因可能在于反应过程中交联混乱而形成高聚合物[18]。另外,单抗的量对偶联也有影响,结果发现:量子点与单抗两者摩尔比为1∶2时,其偶联物荧光强度不如摩尔比为1∶4时的均匀,这可能是随着单抗量的增加,量子点能更多的参与偶联反应,偶联效率提高。

图3 偶联产物紫外成像图Fig.3 Ultraviolet imagery of the conjugates
利用凝胶过滤层析分子筛作用原理,可将偶联物与游离抗体及量子点分离;同时,还可除去少量的EDC和NHS,从而保证偶联产物有较高的纯度和均一性,满足后续检测分析的要求。
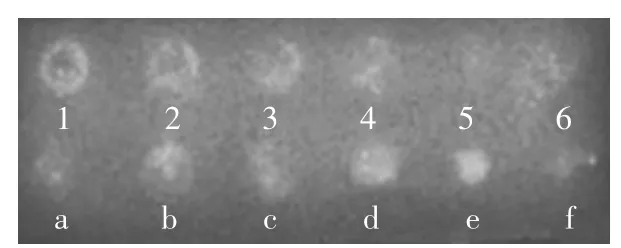
图4 斑点印迹定性检测不同乳制品中α-乳白蛋白Fig.4 Qualitative detection for α-La in different dairy products by using dot blotting
2.3 斑点印迹定性检测
量子点具有宽激发、窄发射等荧光特性,因此,量子点标记单抗的偶联物在紫外光激发下能产生荧光。以建立的斑点印迹法定性检测不同乳制品中α-乳白蛋白,结果如图4所示。由图4可知,随着α-乳白蛋白点样量减少,其对应的斑点荧光强度也逐渐减弱,且空白处斑点未见明显的荧光本底,因此可见该偶联物可特异性结合过敏原α-乳白蛋白。通过斑点强度的不同可定性检测各种乳制品中α-乳白蛋白含量的高低。在6种待检测乳制品中,纯牛奶及酸酸乳中α-乳白蛋白含量最高,其次为花生牛奶1,而奶茶1中α-乳白蛋白含量很低。斑点印迹过程操作简便且时间短,对仪器要求不高。综上所知,该量子点标记抗体是一种可行的快速检测材料,通过斑点印迹法可直观、快速、准确的定性分析乳制品中过敏原α-乳白蛋白。
3 结论
通过细胞杂交瘤技术和体内诱生腹水法可大量制备抗α-乳白蛋白单克隆抗体,经辛酸-硫酸铵沉淀所得抗体的浓度较高,且特异性好,几乎无交叉反应,满足后续实验的要求。采用碳二亚胺法将量子点与单抗偶联,通过工艺优化,结果表明:量子点∶EDC∶NHS∶单抗=1∶10∶6∶4时,偶联效果最佳;经凝胶层析纯化后保证了该偶联物具有较高的纯度和均一性。在此基础上,构建了基于量子点标记单抗的斑点印迹技术,该方法快速、便捷、特异性强,借助紫外成像系统可直观、定性检测乳制品中α-乳白蛋白。
[1]Wal J M.Structure and function of milk allergens[J].Allergy,2001,56(S67):35-38.
[2]Farrell J H,Jimenez F R,Bleck G,et al.Nomenclature of the proteins of cows’milk-sixth revision[J].Dairy Sci,2004,87(6):1641-1674.
[3]Wal J M.Cow’s milk proteins/allergens[J].Ann Allergy Immunnol,2002,89(S6):3-10.
[4]Makiko Y,Yoshinroi K,Sanetaka S,et al.Recent advances in the generation of human monoclonal antibody[J].Cytotechnology,2007,55(2-3):55-60.
[5]肖国平,陈飞,邵景东,等.盐酸克仑特罗单抗检测试剂盒的研制[J].动物科学与动物医学,2003,20(11):33-34.
[6]Ma X,Sun P,He P L,et al.Development of monoclonal antibodies and a competitive ELISA detection method for glycinin,an allergen in soybean[J].Food Chemistry,2010,121(2):546-551.
[7]Thakur M S,Karanth N G.Research and development on biosensors for food analysis in india[J].Advances in Biosensors,2003,5:131-160.
[8]Ding S Y,Chen J X,Jiang H Y,et al.Application of quantum dot-antibody conjugates for detection of sulfamethazine residue in chicken muscle tissue[J].Journal of Agricultural and Food Chemistry,2006,54(17):6139-6142.
[9]Wang X L,Tao G H,Meng Y H.Nanogold hollow microspherebased electrochemcial immunosensor for the detection of ferritin in human serum[J].Chemistry and Materials Science,2009,167(1-2):147-152.
[10]Yang C,Gu B X,Xu C X,et al.Self-assembled ZnO quantum dot bioconjugates for direct electrochemical determination of allergen[J].Journal of Electroanalytical Chemistry,2011,660(1):97-100.
[11]Goldman E R,Anderson G P,Tpan P T,et al.Conjugation of luminescent quantum dots with antibodies using an engineered adaptor protein to provide new reagents for fluoroimmuno assays [J].Anal Chem,2002,74(4):841-847.
[12]Wang H,Li Y B,Slavik M.Rapid detection of Listeria monocytogenes using quantum dots and nanobeads-based optical biosensor[J].Rapid Methods&Automation in Microbiology,2007,15(1):67-76.
[13]Richter J D,Evers D C.A monoclonal antibody to an oocytespecific poly(A)RNA-binding protein[J].The Journal of Biological Chemistry,1984,259:2190-2194.
[14]余鹏博,王敬军,张家驹,等.汉坦病毒核蛋白原核表达纯化及其单抗制备[J].中国公共卫生,2008,25(12):1445-1447.
[15]Watanabe M,Fujioka K,Akiyama N,et al.Conjugation of quantum dots and JT95 IgM monoclonal antibody for thyroid carcinoma without abolishing the specificity and activity of the antibody[J].IEEE Trans Nanobioscience,2011,10(1):30-35.
[16]Sun B Q,Xie W Z,Yi G S,et al.Microminiaturized immunoassays using quantum dots as fluorescent label by laser confocal scanning fluorescence detection[J].Journal of Immunol Methods,2001,249(1-2):85-89.
[17]Huang C P,Liu H W,Tsao C Y,et al.Plate-based biochemical assay using quantum dots as a fluorescent labeling agent[J]. Sensors and Actuators B:Chemical,2005,108(1-2):713-720.
[18]Hermanson G T.Bioconjugate Techniques[M].2th ed. Rockford,lllinois:Thermo Fisher Scientific,1996.
Development of monoclonal antibodies against α-lactalbumin and establishment of qualitative detection for α-lactalbumin with dot blotting assay
LONG Cai-yun1,2,ZHENG Yi-cheng1,2,CHENG Fen-fen1,2,YANG An-shu1,2,*,CHEN Hong-bing1,2
(1.State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China;2.Sino-German Joint Research Institute,Nanchang University,Nanchang 330047,China)
The monoclonal antibodies(mAbs)against bovine α-lactalbumin(α-la)were prepared by immunning Balb/c mice and the lymphocyte hybridoma technique.The mAbs were covalently conjugated with the CdSe/ ZnS quantum dots(QDs)by the carbodiimide crosslinking method,and then the coupling conditions were optimized.Furthmore,a dot blotting method based on QD-mAb conjugates was established to qualitatively detect α-La in different commercial dairy products.The results showed that the prepared mAbs had high specificity and no cross-reaction.A good coupling effect was confirmed when the molar ratio of QD,N-(3-Dimethylaminopropyl)-N’-ethylcarbodiimide hydrochloride(EDC),N-Hydroxysuccinimide(NHS),monoclonal antibody was 1∶10∶6∶4.The developed method based on QD-mAb conjugates could be used to visual,rapid qualitative analyze α-La in dairy products.Accordingly,the method possesses certain practical value.
α-lactalbumin;monoclonal antibody;quantum dots;dot blotting;qualitative detection
TS252.7
A
1002-0306(2014)06-0185-04
2013-07-19 *通讯联系人
龙彩云(1989-),女,硕士研究生,研究方向:生物化工。
国家高技术研究发展计划(863计划)(2013AA102205);国家科技支撑计划项目(2011BAK10B03);江西省青年科学家培养对象计划(20122BCB23006);江西省自然科学基金资助项目(20122BAB204001)。

