红松树皮多酚的提取工艺及其抗氧化活性的研究
黄雨洋,王振宇
(1.东北林业大学林学院,黑龙江哈尔滨150040;2.黑龙江粮食职业学院,黑龙江哈尔滨150080;3.哈尔滨工业大学食品科学与工程学院,黑龙江哈尔滨150090)
红松树皮多酚的提取工艺及其抗氧化活性的研究
黄雨洋1,2,王振宇1,3,*
(1.东北林业大学林学院,黑龙江哈尔滨150040;2.黑龙江粮食职业学院,黑龙江哈尔滨150080;3.哈尔滨工业大学食品科学与工程学院,黑龙江哈尔滨150090)
采用酶解预处理结合乙醇浸提法提取红松树皮多酚化合物,并对其抗氧化活性进行了研究。以多酚得率和羟自由基清除率为指标,在单因素实验基础上,采用响应曲面法对红松树皮多酚的提取工艺进行优化,确定最优提取工艺为:加酶量116.70U/g,酶解时间2.60h,酶解温度53.00℃,乙醇添加量49.30%。在该最优提取条件下多酚得率和羟自由基清除率的分别高达11.84%和76.91%。应用电子自旋共振(ESR)法测定抗氧化活性,多酚提取物对羟自由基的清除能力随加入浓度的增加而增加,表明高浓度多酚提取物会提高其抗氧化活性。
红松树皮,多酚,提取,抗氧化活性
红松(Pinus koraiensis),亦称果松、海松。常绿乔木,高达40m。叶五针一束,长6~12cm。分布于我国东北长白山到小兴安岭地区,常与鱼鳞松、红皮云杉等组成混交林,是重要的农林资源,其果实红松种子以其颗粒饱满,营养丰富而闻名,自古就是食疗佳品,具有较高的药用价值及保健功能。研究表明,松属植物中含有萜类、多酚类、生物碱等多种生物活性成分[1],具有抗氧化[2-3]、抗肿瘤及抗菌等生物活性[4-5]。其中多酚类成分是重要的抗氧化剂,具有很大的开发潜力。自由基大量积累会导致多种疾病,如动脉硬化、癌症[6-7]、心脏病、糖尿病等。近年来,天然抗氧化剂的研究备受关注,其中多酚类是主要的抗氧化活性成分之一。多酚类抗氧化成分可以清除自由基,防治过氧化引起的多种疾病[8]。
自由基是含有一个或多个不对称电子的原子,分子或离子。生物体内的自由基种类繁多,以活性氧为主,其中包括超氧阴离子,过氧化氢,羟自由基及单线态氧[9-10]。自由基及其诱导的氧化反应引起的膜脂质氧化性损伤是导致人体衰老和某些疾病的重要因素[11],如癌症、白内障、心血管疾病等。另外,许多研究表明一些天然抗氧化剂可以作自由基清除剂[12]。因此,这些天然高效的食品抗氧化剂与人类健康的关系是研究的热点[13]。近年有研究表明,红松多酚具有抗氧化和清除自由基的作用[14],但用电子自旋共振(ESR)技术直接检测其清除效能尚未见报道。
本实验采用酶解预处理结合乙醇浸提法提取红松树皮多酚化合物,应用电子自旋共振(ESR)分析法测定多酚化合物的抗氧化活性,探究不同提取工艺条件对多酚得率和抗氧化性的影响,并对红松树皮多酚化合物的提取工艺条件进行优化,以期为进一步开发此天然抗氧化剂资源用于研制防治癌症及心血管疾病的新药提供理论依据。
1 材料与方法
1.1 材料与仪器
红松树皮 收集于黑龙江省伊春;纤维素酶(30u/mg) 厦门星隆达化学试剂有限公司;电子捕获剂DMPO Sigma公司;福林试剂 天津华特化研科技有限公司;没食子酸、碳酸钠、浓盐酸、氢氧化钠、硫酸亚铁、双氧水、无水乙醇 均为国产分析纯。
高速万能粉碎机 天津泰斯特仪器公司;恒温水浴锅 北京医疗电子仪器厂;酸度计 上海大中分析仪器厂;T6新世纪紫外可见分光光度计 北京普析通用公司;R-205B旋转蒸发仪 上海申胜仪器公司;电子天平 西安兴成智仪器;E R 200D SRC ESR光谱测定仪 德国布鲁克公司。
1.2 实验方法
1.2.1 工艺流程 红松树皮→40℃条件下烘干→粉碎后过40目筛→准确称取5.0g松壳粗粉于四颈中加入酶液→在不同酶解条件下(加酶量、酶解时间、酶解温度)进行酶解处理→加入浓度为95%的乙醇溶液→水浴振荡浸提→4000r/min离心取上清液→测定多酚含量。
1.2.2 红松树皮多酚提取工艺的单因素实验 固定加酶量为120U/g、酶解时间为2h、酶解温度为50℃、乙醇添加量为50%,在其他条件不变的条件下,以多酚得率(%)和羟自由基清除率(%)为指标,选取加酶量为60、90、120、150、180U/g,酶解时间为1、1.5、2、2.5、3h,酶解温度为30、40、50、60、70℃,乙醇添加量为30%、40%、50%、60%、70%,进行单因素实验,每组实验进行3次平行。
1.2.3 红松树皮多酚提取工艺的优化实验 采用响应曲面分析法对实验进行设计。在单因素实验的基础上,根据中心组合设计原理,设计响应面分析实验,利用Design-Expert软件对实验进行过程优化,以多酚得率R1(%)和羟自由基清除率R2(%)为响应值,选择加酶量A(U/g)、酶解时间B(h)、酶解温度C(℃)和乙醇添加量D(%)为影响因素,每个因素设定5个水平进行实验。其因素水平编码表见表1。
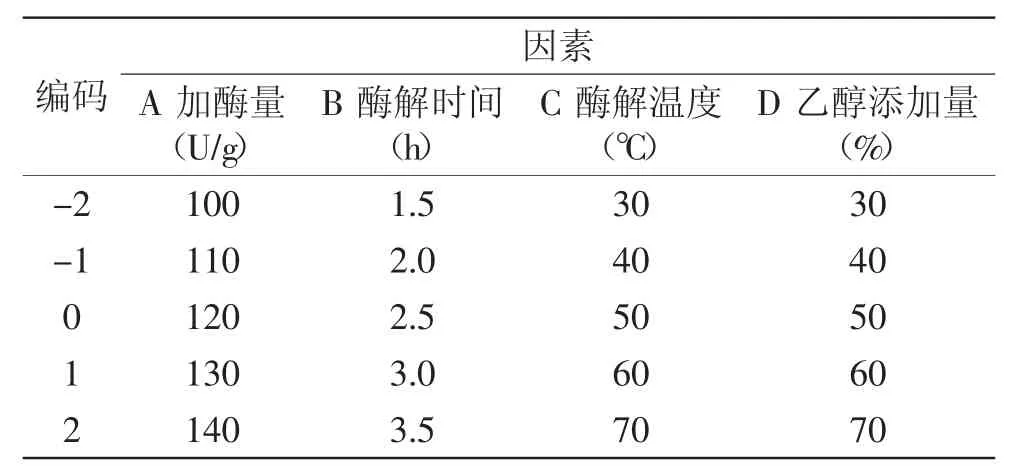
表1 因素水平编码表Table.1 Encode Table.of factors and levels
1.2.4 红松树皮多酚得率的测定 采用福林酚法测定提取液中多酚含量。以没食子酸为标准对照品,精确量取100μg/mL的没食子酸溶液0.05、0.10、0.15、0.20、0.25、0.30、0.35mL置于10mL比色管中,加蒸馏水至2mL,摇匀后加1.0mL福林酚试剂,4min后加入1.0mL 10%的碳酸钠溶液,25℃水浴下保持2h后测定溶液在765nm处的吸光值,得到标准曲线方程,y= 0.0534x+0.1529,式中,x表示多酚含量(mg/g干重);y表示吸光度。
准确吸取适量体积的红松树皮提取液1mL于10mL比色管中,加蒸馏水定容至2mL。加入1.0mL福林试剂后摇匀,4min后加入1.0mL10%碳酸钠溶液,25℃水浴下保持2h后测定溶液在765nm处的吸光度值。将吸光度值代入标准曲线方程计算样品中多酚类成分含量。
1.2.5 红松树皮多酚提取物清除羟自由基能力的测定 参照Rosen等的方法[15]。羟基自由基由Fenton反应产生。加入25μmol/L的硫酸亚铁50μL,样品50μL(空白用水),蒸馏水170μL,浓度为300mmol/L的DMPO 33μL,双氧水200μmol/L,100μL。将反应体系吸入密封的毛细管中。2.5min后用E R 200D SRC ESR光谱仪记录ESR图谱。测定条件如下:中心场强为3000G,扫描宽度为100G,微波频率为9.858GHz,功率为2.25mW。
松多酚对羟基自由基的清除作用以清除率(%)表示,计算公式为:
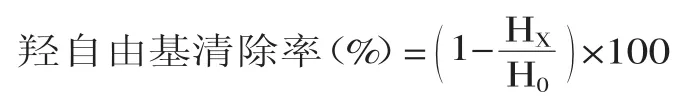
式中:HX和H0分别为不同浓度松多酚和不添加多酚物质的ESR图谱第二峰信号强度(高度)。
1.3 数据处理
原始数据的整理采用Microsoft Excel(Office 2003)和Origin8.5完成;采用统计学软件SPSS17.0对实验数据进行统计分析;采用Design-Expert中心组合及混合中心设计进行数据分析及方差分析。
2 结果与分析
2.1 单因素实验结果及分析
2.1.1 加酶量对多酚得率和羟自由基清除率的影响
图1为加酶量对多酚得率和羟自由基清除率的影响。由图1可知,随着加酶量的增加,多酚得率和羟自由基清除率先逐渐增加,随后保持平缓。当加酶量为120U/g时,多酚得率和羟自由基清除率达到最佳,再继续增加加酶量,多酚得率和羟自由基清除率没有明显变化。这可能是由于纤维素酶会破坏红松树皮的细胞壁,使更多的多酚物质释放,从而使多酚得率提高,而羟自由基清除率随着多酚含量的增加而增加。综合考虑,选取最佳加酶量为120U/g。
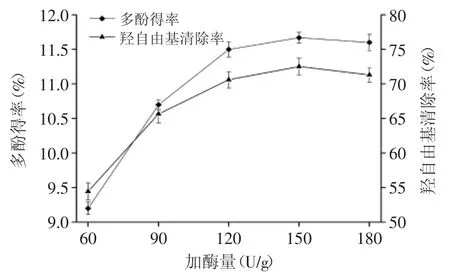
图1 加酶量对多酚得率和羟自由基清除率的影响Fig.1 Effect of enzyme additive amount on the yield of polyphenols and free radical scavenging rate
2.1.2 酶解时间对多酚得率和羟自由基清除率的影响 图2为酶解时间对多酚得率和羟自由基清除率的影响。由图2可知,随着酶解时间的延长,多酚得率和羟自由基清除率先缓慢增加,再迅速增加,而后保持平缓。当酶解时间为2.5h时,多酚得率和羟自由基清除率达到最高,再继续延长酶解时间,多酚得率和羟自由基清除率没有明显变化。这可能是由于酶解达到一定时间后,细胞内的多酚物质几乎全部释放出来,再继续延长酶解时间,对反应没有影响。综合考虑,选取最佳酶解时间为2.5h。
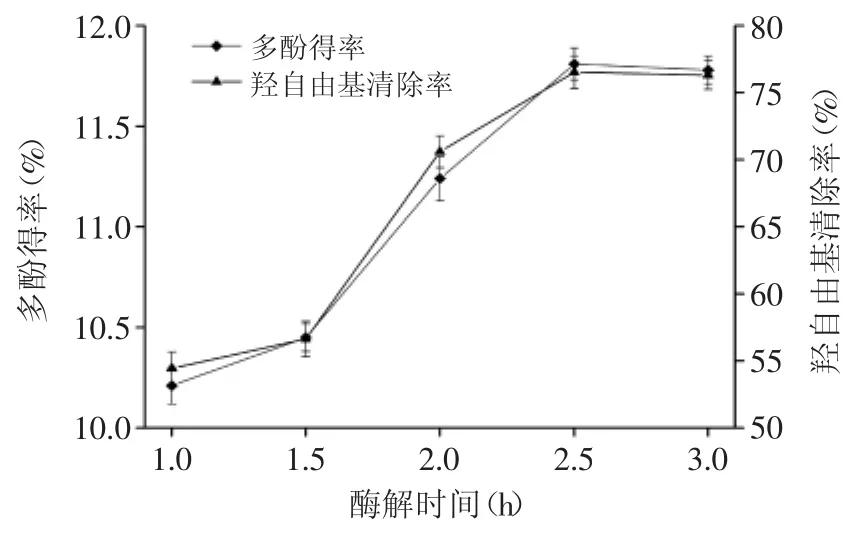
图2 酶解时间对多酚得率和羟自由基清除率的影响Fig.2 Effect of enzymatic hydrolysis time on the yield of polyphenols and free radical scavenging rate
2.1.3 酶解温度对多酚得率和羟自由基清除率的影响 图3为酶解温度对多酚得率和羟自由基清除率的影响。由图3可知,随着酶解温度的增加,多酚得率和羟自由基清除率呈先增加后降低的趋势。当酶解温度为50℃时,多酚得率和羟自由基清除率达到最高,再继续增加酶解温度,多酚得率和羟自由基清除率反而下降。这可能是由于纤维素酶在其最适酶解温度范围内有较高的酶解活性,超出最适范围酶解能力下降,多酚得率和羟自由基清除率相应降低。综合考虑,选取最佳酶解温度为50℃。
2.1.4 乙醇添加量对多酚得率和羟自由基清除率的影响 图4为乙醇添加量对多酚得率和羟自由基清除率的影响。由图4可知,随着乙醇添加量的增加,多酚得率和羟自由基清除率呈先增加后降低的趋势。当乙醇添加量为50%时,多酚得率和羟自由基清除率达到最高,再继续增加乙醇添加量,多酚得率和羟自由基清除率反而下降。这可能是由于乙醇添加量在适合的范围内,传质阻力小,多酚溶解性好,会使多酚得率和羟自由基清除率增加;而乙醇添加量过多会影响多酚得率和羟自由基清除率。综合考虑,选取最佳乙醇添加量为50%。
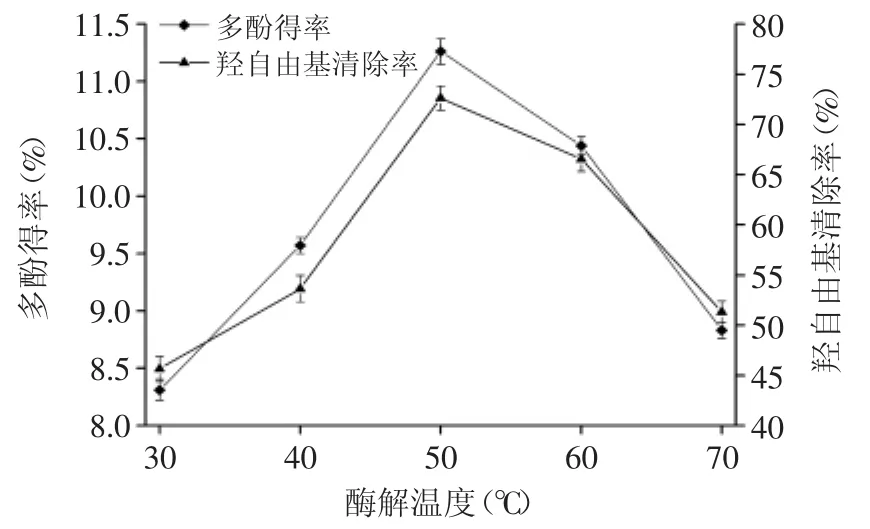
图3 酶解温度对多酚得率和羟自由基清除率的影响Fig.3 Effect of enzymatic hydrolysis temperature on the yield of polyphenols and free radical scavenging rate
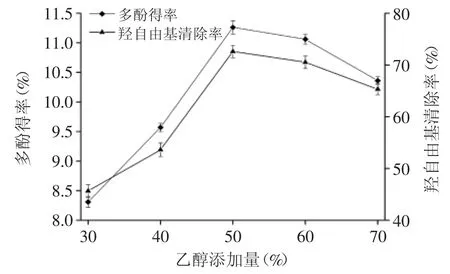
图4 乙醇添加量对多酚得率和羟自由基清除率的影响Fig.4 Effect of ethanol additive amount on the yield of polyphenols and free radical scavenging rate
2.2 响应面优化实验
实验采用响应曲面法进行过程优化,实验设计与数据处理采用统计软件Design-Expert来完成。以加酶量A(U/g)、酶解时间B(h)、酶解温度C(℃)和乙醇添加量D(%)分别代表的因素为自变量,以多酚得率R1(%)和羟自由基清除率R2(%)为响应值,响应面实验方案及结果见表2。实验号1~24为析因实验,25~36为12个中心实验,用以估计实验误差。
多酚得率R1通过统计分析软件Design-Expert进行数据分析,建立二次响应面回归模型如下:
R1=11.98-0.15A+0.046B+0.060C+0.061D+0.083AB-0.0056AC+0.21AD+0.29BC-0.27BD+0.034CD-0.19A2-0.33B2-0.15C2-0.33D2
采用Design-Expert软件对方程进行方差分析,多酚得率R1的方差分析结果见表3。
由表3可知,方程因变量与自变量之间的线性关系明显,该模型回归显著(p<0.0001),失拟项不显著(p>0.05),并且该模型R2=95.91%,R2Adj=93.19%,说明该模型与实验拟合良好,自变量与响应值之间线性关系显著,可以用于该反应的理论推测。由F检验可以得到因子贡献率为:A>D>C>B,即加酶量>乙醇添加量>酶解温度>酶解时间。交互项AD、BC、BD交互作用显著,其对多酚得率影响的响应面分析见图5。
羟自由基清除率R2通过统计分析软件Design-Expert进行数据分析,建立二次响应面回归模型如下:
R2=77.19-1.09A+0.23B+0.53C+0.38D+0.66AB-0.091AC+1.67AD+2.30BC-1.98BD+0.22CD-2.02A2-3.11B2-1.72C2-2.93D2
采用Design-Expert软件对方程进行方差分析,羟自由基清除率R2的方差分析结果见表4。
由表4可知,方程因变量与自变量之间的线性关系明显,该模型回归显著(p<0.0001),失拟项不显著(p>0.05),并且该模型R2=97.21%,R2Adj=95.35%,说明该模型与实验拟合良好,自变量与响应值之间线性关系显著,可以用于该反应的理论推测。由F检验可以得到因子贡献率为:A>C>D>B,即加酶量>酶解温度>乙醇添加量>酶解时间。交互项AD、BC、BD交互作用显著,其作用(显著项)对羟自由基清除率影响的响应面分析见图6。
应用响应面寻优分析方法对回归模型进行分析,通过分析软件Design-Expert寻找最优响应结果。当加酶量、酶解时间、酶解温度和乙醇添加量对应的编码值分别为-0.33、0.16、0.30和-0.07时,多酚得率和羟自由基清除率有最大值分别为12.03%和77.40%。红松树皮多酚最优提取工艺为:加酶量116.70U/g,酶解时间2.60h,酶解温度53.00℃,乙醇添加量49.30%。
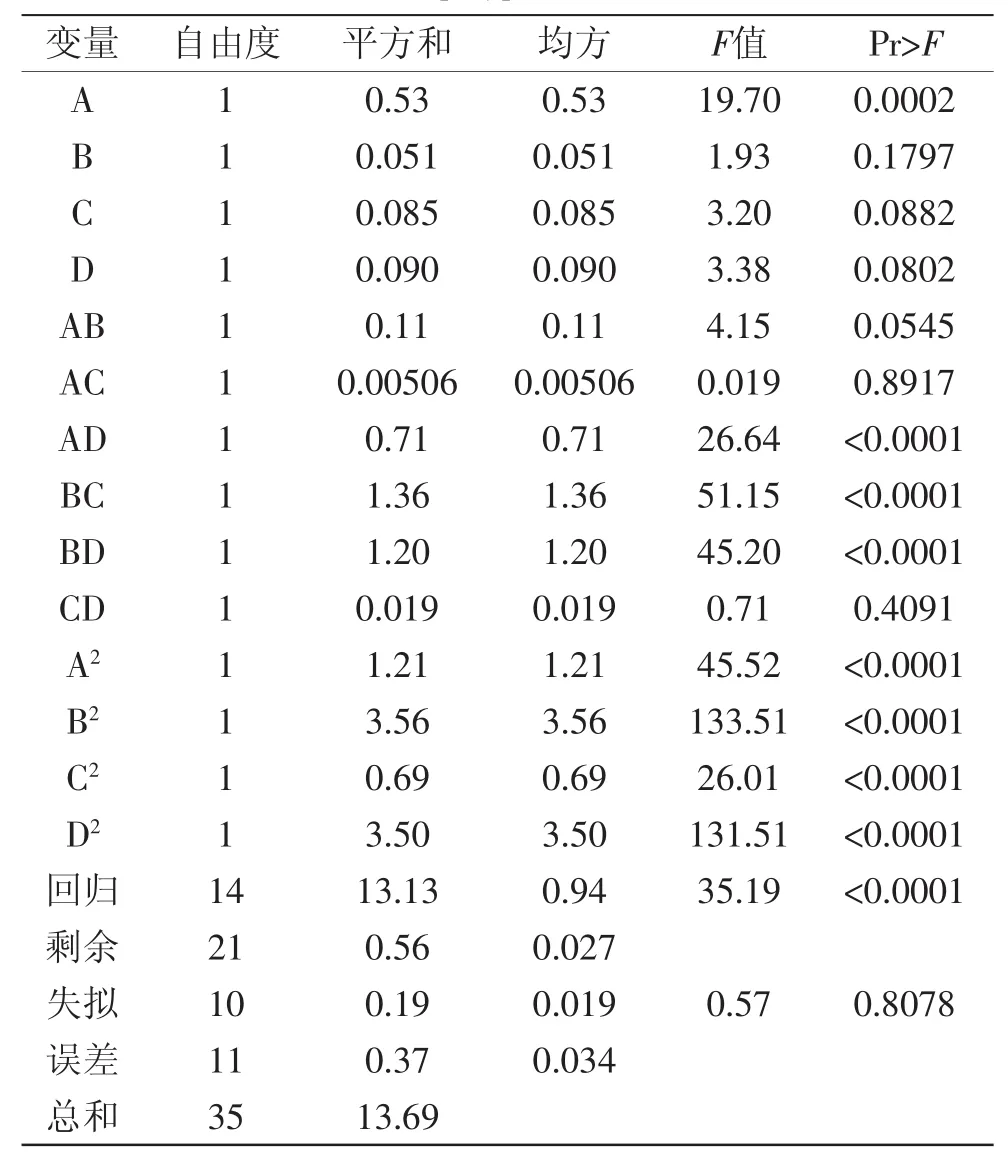
表3 多酚得率的方差分析结果Table.3 Results of variance analysis for the yield of polyphenols
为了验证模型预测的准确性,在响应面优化的工艺条件下,即加酶量116.70U/g,酶解时间2.60h,酶解温度53.00℃,乙醇添加量49.30%,进行红松树皮多酚提取实验,重复3次验证实验取平均值,在该最优提取条件下多酚得率和羟自由基清除率的平均值分别为11.84%和76.91%,与预测值12.03%和77.40%较接近,可见该模型能较好地预测红松树皮多酚的提取情况,证明该实验参数准确可靠。最终确定红松树皮多酚最优提取工艺为:加酶量116.70U/g,酶解时间2.60h,酶解温度53.00℃,乙醇添加量49.30%。
2.3 多酚提取物对羟自由基清除作用
多酚提取物具有一定的抗氧化活性,对很多自由基有一定的清除作用,包括羟自由基、DPPH自由基、超氧阴离子自由基、ABTS+自由基等[16]。其中羟自由基是最活泼的化学物质之一,是己知最强的氧化剂,它几乎可以和所有细胞成分发生反应,对机体危害极大[17]。H2O2与Fe2+反应产生的羟自由基能与DMPO形成加合物,该加合物的ESR图的信号峰强度与羟自由基的浓度成正比。图7为不同浓度多酚提取物对羟自由基清除作用的影响,由图7可知,随着多酚提取物浓度的增加,羟自由基清除率逐渐升高,但升高的速率逐渐减慢。这也就是说高浓度多酚提取物会提高其抗氧化活性,在保证高羟自由基清除作用的前提上,控制多酚提取物的浓度,对降低成本、节省资源具有重要的现实意义。
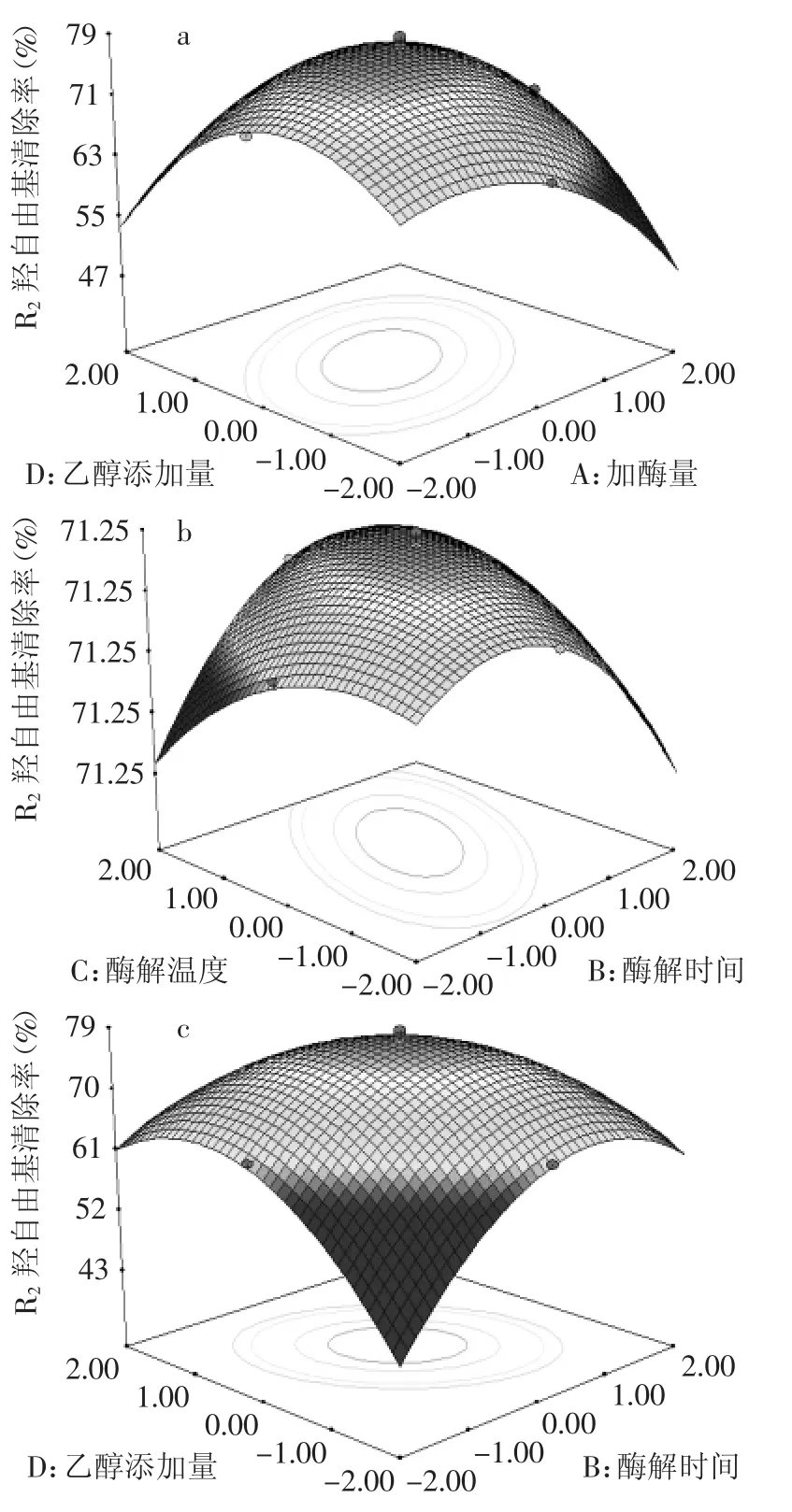
图6 两因素交互作用(显著项)对羟自由基清除率影响的响应面图Fig.6 Response surface for effect of two factor interactions(significant items)on free radical scavenging rate
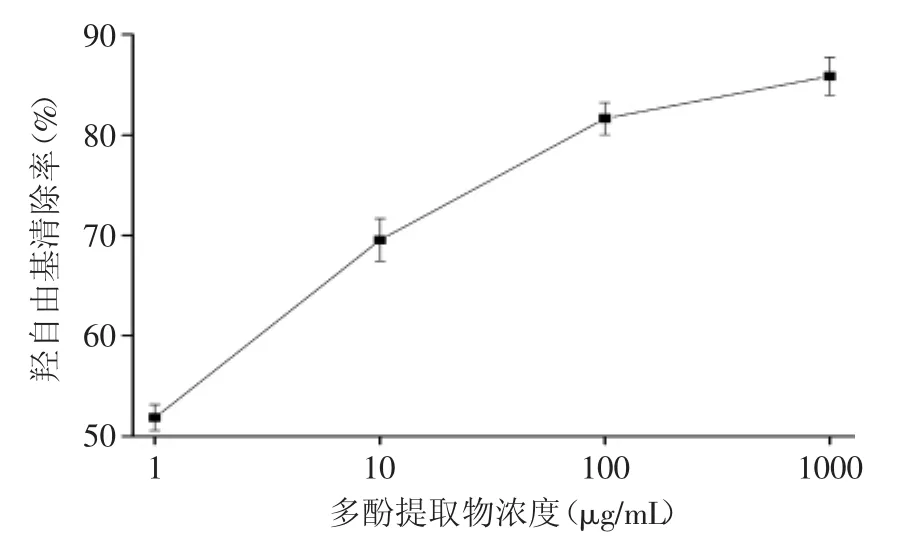
图7 不同浓度多酚提取物对羟自由基清除作用的影响Fig.7 Effect of different concentrations of polyphenols extractive on hydroxyl free radical scavenging
3 结论
本文对红松树皮多酚的提取工艺及其抗氧化活性进行了研究,主要采用酶解预处理结合乙醇浸提法提取红松树皮多酚化合物。以多酚得率和羟自由基清除率为指标,在单因素实验基础上,采用响应曲面法对红松树皮多酚的提取工艺进行优化,确定最优提取工艺为:加酶量116.70U/g,酶解时间2.60h,酶解温度53.00℃,乙醇添加量49.30%,在该最优提取条件下多酚得率和羟自由基清除率的分别高达11.84%和76.91%。应用电子自旋共振(ESR)法测定抗氧化活性,多酚提取物对羟自由基的清除能力随加入浓度的增加而增加,表明高浓度多酚提取物会提高其抗氧化活性。
[1]Arrabal C,Cortijo M,Simon B F,et al.Differentiation among five spanish pinus pinaster provenance based on its oleoresin terpenic composition[J].Biochemical Systematics and Ecology,2005,33:1007-1016.
[2]Aquilano K,Baldelli S,Rotilio G,et al.Role of nitric oxide synthases in parkinson’s disease:A review on the antioxidant and anti-inflammatory activity of polyphenols[J].Neurochemical Research,2008,33(12):2416-2426.
[3]Padilla F C,Rincon A M,Bou-Rached L.Polyphenol content and antioxidant activity of several seeds and nuts[J].Arch Latinoam Nutr,2008,58(3):303-308.
[4]D S Pureswaran,R Gries,H John.Quantitative variation in monoterpenes in four species of conifers[J].Biochemical Systematics and Ecology,2004,32:1109-1136.
[5]C Arrabal,M Cortijo,B F Simon,et al.Differentiation among five spanish pinus pinaster provenance based on its oleoresin terpenic composition[J].Biochemical Systeatics and Ecology,2005,33:1007-1016.
[6]Cabello-Hurtado F,Gicquel M,Esnault M-A.Evaluation of the antioxidant potential of cauliflower(Brassica oleracea)from a glucosinolate content perspective[J].Food Chemistry,2012,132(2):1003-1009.
[7]Ramirez M R,Guterres L,Dickel O E,et al.Preliminary studies on the antinociceptive activity of vaccinium ashei berry in experimental animal models[J].Journal of Medicinal Food,2010,13(2):336-342.
[8]Oueslati S,Trabelsi N,Boulaaba M,et al.Evaluation of antioxidant activities of the edible and medicinal Suaeda species and related phenolic compounds[J].Industrial Crops and Products,2012,36(1):513-518.
[9]魏朝良,于德红,安利佳.黄酮类化合物及清除自由基机制的探讨[J].中成药,2005,27(2):239-241.
[10]崔剑,李兆陇,洪啸吟.自由基生物抗氧化与疾病[J].清华大学学报:自然科学版,2000,4(6):9-12.
[11]M Leone,D Zhai,S Sareth,et al.Cancer prevention by tea polyphenols is linked to their direct inhibition of antiapoptotic bcl-2-family proteins[J].Cancer Research,2003,63:8118-8121.
[12]Bursal E,Gülçin I·.Polyphenol contents and in vitro antioxidant activities of lyophilised aqueous extract of kiwifruit(Actinidia deliciosa)[J].Food Research International,2011,44(5):1482-1489.
[13]Butterfield D A,Casten G A A,Pocernich C B,et al. Nutritional approaches to com bat oxidative stress in Alzheimer’s disease[J].The Journal of Nutritional Biochemistry,2002,13:444-461.
[14]苏晓雨,王振宇.红松子种皮提取物活性成分及抗氧化作用研究[J].林产化学与工业,2010,30(8):99-102.
[15]Rosen G M,Rauckman E J,Packer I L.Spin trapping of superoxide and hydroxyl radicals[J].Methods in Enzymology,1984,105:198-209.
[16]苏晓雨.红松种壳组成及多酚提取分离与抗氧化抗肿瘤功能研究[D].黑龙江:哈尔滨工业大学,2011.
[17]赵晓丹,胡小松.ESR法评价醋蒜提取物的抗氧化活性[J].中国调味品,2011,36(3):46-49.
Study on extraction of polyphenols of red pine bark and their antioxidant activity
HUANG Yu-yang1,2,WANG Zhen-yu1,3,*
(1.School of Forestry,Northeast Forestry University,Harbin 150040,China;2.Heilongjiang Grain Vocational College,Harbin 150080,China;3.College of Food Science and Engineering,Harbin Institute of Technology,Harbin 150090,China)
The extraction of polyphenols compounds of red pine bark using enzymatic hydrolysis pretreatment combined with ethanol immersion extraction was researched.And antioxidant activity of polyphenols was also studied.Yield of polyphenols and hydroxyl free radical scavenging rate as indicators,on the basis of single factor experiment,technological parameters of extracting polyphenols were determined by response surface method to optimize extraction process conditions as following:enzyme additive amount 116.70U/g,enzymatic hydrolysis time 2.60h,enzymatic hydrolysis temperature 53.00℃,ethanol additive amount 49.30%.Under the condition of the extraction process,yield of polyphenols and hydroxyl free radical scavenging rate were 11.84% and 76.91%respectively.Electron spin resonance(ESR)assay was employed to evaluate the antioxidant activity of polyphenols.Hydroxyl free radical scavenging rate of polyphenols improved with the increase of adding polyphenols concentration,which indicated high concentrations of polyphenols could enhance their antioxidant activity.
red pine bark;polyphenols;extraction;antioxidant activity
TS201
A
1002-0306(2014)06-0171-07
2013-09-02 *通讯联系人
黄雨洋(1979-),女,博士研究生,讲师,研究方向:天然产物分离纯化及功能性。
国家自然科学基金资助项目(31170510)。

