丝状真菌对3-苯氧基苯甲酸降解能力及特性的研究
李金永,刘书亮,*,姚 开,李建龙
(1.四川农业大学食品学院,四川雅安625014;2.四川大学轻纺与食品学院,四川成都610065)
丝状真菌对3-苯氧基苯甲酸降解能力及特性的研究
李金永1,刘书亮1,*,姚 开2,李建龙1
(1.四川农业大学食品学院,四川雅安625014;2.四川大学轻纺与食品学院,四川成都610065)
以实验室保存的产黄青霉QH、米曲霉MAY、高大毛霉MHC、黑根霉GH、啤酒酵母Y1和假丝酵母Y2等6株真菌为出发菌株,在PD培养基中振荡培养48h,QH、MAY、MHC和GH对100mg/L 3-苯氧基苯甲酸(3-PBA)的降解率分别为77.12%、77.19%、55.46%和72.38%;而Y1和Y2对3-PBA无降解。在MM培养基中振荡培养48h,6株真菌均未生长,对3-PBA无降解。14株已知霉菌和从环境中分离的12株霉菌及4株酵母菌进行3-PBA降解实验,测试的26株霉菌在PD培养基中对3-PBA均有不同程度的降解,4株酵母菌未有降解,推测丝状真菌可能具有降解3-PBA的共性。由HPLC谱图可知,不同种类霉菌降解3-PBA的产物不同,可能有不同的3-PBA降解途径与机制。此外,3-PBA对本研究所测试的丝状真菌的生长都有一定的抑制作用。
丝状真菌,3-苯氧基苯甲酸,降解特性
拟除虫菊酯类农药是一种广泛使用的杀虫剂,而它的降解中间产物3-苯氧基苯甲酸(3-PBA)则是一种潜在的环境污染物[1-2],因为3-PBA比拟除虫菊酯类农药更加稳定。研究发现,3-PBA是一种潜在的环境雌激素类物质[3],对环境和人类的健康存在着一定的威胁。此外,3-PBA还能导致拟除虫菊酯类农药生物矿化作用受阻,切断该类农药彻底转化为无毒小分子的生物降解途径[4],从而间接地使农药残留问题更加严峻。如何降低或消除环境及农产品中3-PBA的污染,受到人们的广泛关注。
微生物降解作用是降解有机污染物的一种重要方式,目前已有较多相关的研究报道[5-8]。微生物降解农药一直是国内外研究的热点,但微生物作用尤其是真菌降解3-PBA的研究少见报道。目前,对于微生物降解3-PBA的研究多为降解菌种的筛选及其特性分析,并且研究对象主要以细菌为主[9-13]。霉菌对环境的净化具有重要作用,其对二苯醚键结构化合物降解具有一定优势[14],然而将霉菌用于3-PBA降解的研究却鲜见报道。本研究采用实验室保存的10余种已知丝状真菌以及从土壤、茶叶、醋醅等环境中分离的一些真菌对3-PBA进行降解实验,探讨了其对3-PBA的降解情况,为进一步开展丝状真菌对3-PBA的降解途径及其开发利用提供铺垫。
1 材料与方法
1.1 材料与仪器
产黄青霉(Penicillium chrysogenum)QH、米曲霉(Aspergillus oryzae)MAY、高大毛霉(Mucor mucedo)MHC、黑根霉(Rhizopus nigricans)GH四种常用霉菌,啤酒酵母(Saccharomyces cerevisiae)Y1、产朊假丝酵母(Candida utilis)Y2,黑曲霉(Aspergillus niger)CICC40188、米曲霉CICC2279等菌株 由四川农业大学食品微生物实验室收集保存;米曲霉M3、米曲霉M4、土曲霉(Aspergillus terreus)M12、米曲霉M13、黑曲霉YAT、绿色木霉(Trichoderma viride)315、康氏木霉(Trichoderma koningii)316、紫红曲霉(Monascus purpureus)318、产黄青霉LJ1、点青霉(Penicillium notatum)LJ5、产黄青霉LJ2-1、灰黄青霉(P. griseofulvum)JLG等菌株 由本实验室分离保存;土样 从四川雅安不同茶园采集土样两份,每份500g;两种茯砖茶 产地:湖南,2011和2012,市售,每种200g;醋醅两份 从四川某酿造企业采集,每份200g;土豆蔗糖培养基(PD) 新鲜土豆300g,蔗糖20g,蒸馏水1000mL,吐温80 2.0g,pH6.0,121℃灭菌15min;土豆蔗糖固体培养基(PDA) 在PD培养基的基础上添加2%的琼脂;基础盐培养基(MM) (NH4)2SO41.5g,KH2PO40.5g,K2HPO41.5g,MgSO4·7H2O 0.2g,NaCl 0.5g,Tween 80 2.0g,蒸馏水1000mL,pH7.0,121℃灭菌15min;3-苯氧基苯甲酸 纯度98%,美国Sigma公司;检测用乙腈 色谱纯,德国CNW Technologies GmbH公司;乙腈 分析纯,天津科密欧化学试剂有限公司。
LC-10A2010C HT型液相色谱仪 日本Shimazu公司;AS10200A型超声波清洗器 天津奥特赛恩斯公司;HZQ-X100型振荡培养箱 哈尔滨市东联电子技术开发有限公司。
1.2 实验方法
1.2.1 菌株分离 将收集的土壤、茶叶和醋醅样品粉碎,称量10g,分别转移到含0.1%吐温80和0.1%琼脂的90mL无菌生理盐水中,充分摇匀后静置。采用稀释分离法,将样液进行适当稀释,取100μL稀释液涂布于添加50μg/mL氯霉素的PDA平板上,30℃倒置培养,待长出单个菌落后挑选分离,30℃倒置培养。经多次分离并镜检观察至纯化后,采用PDA试管斜面培养后于4℃保存,备用。
1.2.2 孢子(菌)悬液的制备 将产黄青霉QH、米曲霉MAY、高大毛霉MHC、黑根霉HG 4株霉菌和啤酒酵母Y1、假丝酵母Y2 2株酵母菌分别接种于PDA平板上30℃培养72h,分别转接于PDA试管斜面,30℃培养72h后在无菌条件下分别用无菌生理盐水(含0.1%琼脂和0.1%吐温80)制成孢子(菌)悬液,采用平板稀释计数法调节孢子(菌)浓度为5.0×108个/mL。
1.2.3 接种培养 将4株霉菌和2株酵母菌的孢子(菌)悬液各1mL分别接种于30mL含100mg/L 3-PBA的PD(PD-3-PBA)和MM(MM-3-PBA)培养基中,并用无菌生理盐水1mL代替孢子(菌)悬液作空白对照。于30℃、180r/min振荡培养48h,测定各培养液中3-PBA的残留量。
1.2.4 培养液中3-PBA的提取与测定 培养后取整瓶培养液,加入等体积乙腈,40kHz、300W超声30min,辅助提取培养液中3-PBA。取2.0mL超声提取液用乙腈定容至10mL,混匀,取1.5mL混匀后的提取液于2mL EP管中,12000r/min离心10min,上清液用0.45μm有机相滤膜过滤,弃去初滤液,HPLC检测续滤液中3-PBA残留质量浓度[15]。色谱条件:色谱柱为Gemini 100Å C18柱(5.0μm,150mm×4.60mm(i.d.));流动相为乙腈-磷酸水(pH2.5)(55∶45,v/v),流速为0.7mL/min;紫外检测器波长为210nm;柱温为25℃;进样量为10μL[16-17]。3-PBA的浓度与HPLC测定的相应峰面积呈正比,用HPLC测定的相应峰面积表示3-PBA的浓度。
3-PBA降解率按下式计算:

式中:C0为空白对照中3-PBA总质量浓度(mg/L);C为样品培养液中3-PBA残留质量浓度(mg/L)。
1.2.5 实验室保存菌株和分离菌株对3-PBA的降解实验 将实验室保存的已知14株霉菌和分离的菌株按1.2.4方法测定各菌株对100mg/L 3-PBA的降解率,根据菌种特性确定不同培养时间。
1.2.6 代表性菌株对3-PBA的降解曲线及生长曲线测定 根据种属不同以及降解产物的差异从中选择几株菌作为代表性菌株,并测定其对3-PBA的降解曲线及生长曲线。将选择的代表性菌株种子液各1mL分别接种于PD和PD-3-PBA(3-PBA质量浓度为100mg/L)培养基中。并同时设置空白对照组(接种等量的无菌生理盐水)。30℃、180r/min振荡培养,采用全量取样的方式进行间隔取样,分别测定3-PBA残留质量浓度及菌体生物量,菌体生物量(g/L)以干重计。
2 结果与分析
2.1 4株霉菌及2株酵母菌对3-PBA的降解情况
经过HPLC检测,四株霉菌(产黄青霉QH、米曲霉MAY、高大毛霉MHC、黑根霉GH)在添加100mg/L 3-PBA的PD培养基中振荡培养48h后,对3-PBA的降解率分别为77.12%、77.19%、55.46%、72.38%;在MM-3-PBA培养基中菌株均不生长、对3-PBA无降解。微生物对异生化合物的降解主要以矿化作用和共代谢方式为主。矿化作用即微生物利用目标异生化合物作为其生长的唯一碳源和能源,使之彻底降解为无毒小分子(二氧化碳和水等)[18];而共代谢作用是一种不彻底的降解作用,是指微生物必须借助其他物质为其提供生长所需的碳源或能源和降解异生化合物所需的能量[19]。供试霉菌不能利用3-PBA作为唯一碳源,而是在其他碳源或能源存在的情况下降解3-PBA,说明供试霉菌以共代谢的方式降解3-PBA。而啤酒酵母Y1和假丝酵母Y2在PD和MM培养基中对3-PBA均无降解,且在MM培养基中不生长。
通过HPLC谱图(图1)可以看出四株霉菌降解3-PBA产生的新物质存在差异。图1中吸收峰保留时间为7.18min处的A物质为3-PBA,MHC降解3-PBA可能产生了新物质C(吸收峰保留时间为3.71min),GH降解3-PBA可能产生了新物质B(吸收峰保留时间为6.65min),QH降解3-PBA可能产生了物质C和物质D(吸收峰保留时间为3.11min),MAY降解3-PBA可能产生了物质B和物质C,说明不同的霉菌降解3-PBA的机制和途径不同。

图1 四种霉菌降解3-PBA产物的HPLC谱图Fig.1 HPLC chromatogram of 3-PBA degraded by four kinds of molds
2.2 供试菌株对3-PBA的降解情况
2.2.1 菌株分离结果 根据菌落特征及显微镜观察,从土壤、茶叶和醋醅样品中共分离、筛选到16株真菌。初步鉴定有12株为霉菌,其中4株为冠突散囊菌,编号为E1、E2、E3、E4;4株曲霉,编号为A1、A2、A3、A4;3株毛霉,编号为R1、R2、R3和1株木霉T1。并分离到4株酵母菌,编号为S1、S2、S3、S4。
2.2.2 供试菌株对3-PBA降解情况 由表1可知,供试30株菌中,26株霉菌对3-PBA均有不同程度的降解,其中康氏木霉316降解率最低为22.23%,其余霉菌降解率均超过50%,部分菌株几乎可将100mg/L的3-PBA完全降解;而分离的4株酵母菌对3-PBA均不降解。通过2.1实验结果和表1可以推断丝状真菌—霉菌对3-PBA均有不同程度的降解作用。
2.3 代表性霉菌对3-PBA的降解曲线及生长曲线
由图2可知,培养72h后产黄青霉LJ1在两种培养基中的细胞干重有明显差异。LJ1在PD培养基中,经过5h的延滞期后开始生长,50h后生长趋于平缓,最终细胞干重为5.52g/L。LJ1在PD-3-PBA中培养时,15h后开始缓慢生长,30h后进入快速生长期,50h后生长趋于平缓,最终细胞干重为4.32g/L。通过LJ1在PD和PD-3-PBA中的生长曲线可以看出,3-PBA对LJ1的生长有一定的抑制作用,使其延滞期增长,并且影响了LJ1的最终生物量。
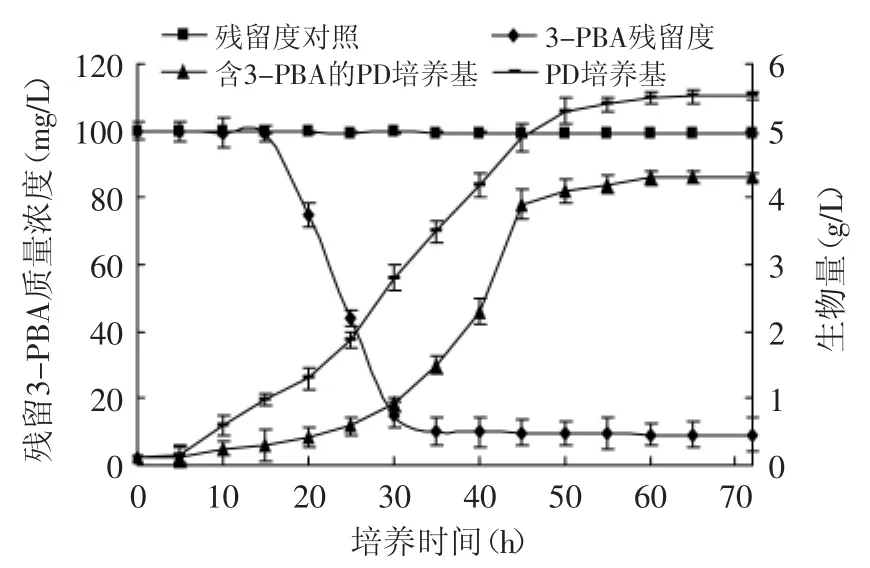
图2 产黄青霉LJ1降解3-PBA曲线Fig.2 Degradation curve of 3-PBA by P.chrysogenum LJ1
由图2的3-PBA降解曲线可知,在本实验条件下,LJ1不能将100mg/L的3-PBA完全降解,培养72h时,3-PBA降解率为89.35%。结合生长曲线,培养5h后3-PBA开始出现降解,培养30~40h降解缓慢,40h后几乎不再降解。而LJ1在25h内生长缓慢,30h后生长加快,对3-PBA的降解有一定的关联,即3-PBA能够抑制LJ1的生长,随着3-PBA的降解,抑制作用逐渐降低,3-PBA的浓度与抑制LJ1生长作用呈正相关。同时通过图3可以看出,随着培养时间的延长,物质A(3-PBA)残留量逐渐减少,而物质C却相应的增加,推测其是3-PBA的代谢产物之一。
米曲霉M13在PD-3-PBA中的生长曲线及对3-PBA的降解曲线如图4所示,由图4可知,3-PBA对米曲霉M13的生长同样存在一定的抑制作用。在PD培养基中,M13在10h后开始缓慢增长,20h后进入快速生长期,40h后生长趋于稳定,培养48h后细胞干重达到6.43g/L。而在PD-3-PBA培养基中,M13在18h后才开始缓慢生长,48h后细胞干重达5.81g/L。

表1 供试菌株对3-PBA的降解情况Table.1 Degradation of 3-PBA by tested strains

图3 不同时间产黄青霉LJ1的PD-3-PBA体系样品的HPLC谱图Fig.3 HPLC chromatograms of samples taken from PD-3-PBA culture systems for P.chrysogenum LJ1 at different incubation
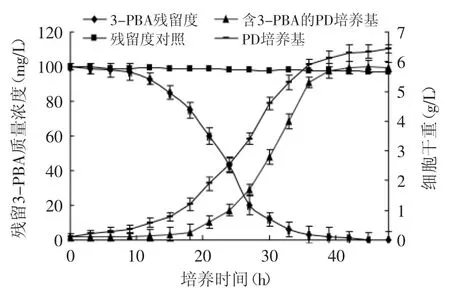
图4 米曲霉M13降解3-PBA曲线Fig.4 Degradation curve of 3-PBA by A.oryzae M13
由图4中的3-PBA降解曲线可知,M13在48h内能将100mg/L的3-PBA完全降解。同时从HPLC谱图(图5)中可以看出,随着3-PBA的降解,有两种新物质出现,即物质B和物质C,3-PBA与物质B和C之间有一定的消长关系,推测是3-PBA的代谢中间产物。

图5 不同时间米曲霉M13的PD-3-PBA体系样品的HPLC谱图Fig.5 HPLC chromatograms of samples taken from PD-3-PBA culture systems for A.oryzae M13 at different incubation
毛霉R3在PD-3-PBA中的生长曲线及对3-PBA的降解曲线如图6所示,毛霉R3的生长同样受到3-PBA的抑制,表现在延滞期的增长以及最终的细胞干重减少。在本实验条件下,R3对3-PBA的降解率为58.02%。

图6 毛霉R3降解3-PBA曲线Fig.6 Degradation curve of 3-PBA by Mucor R3
从其HPLC谱图中(图7)可以看出,菌株R3降解3-PBA产生的物质与米曲霉M13的相同,都有物质B和物质C产生。

图7 不同时间毛霉R3的PD-3-PBA体系样品的HPLC谱图Fig.7 HPLC chromatograms of samples taken from PD-3-PBA culture systems for Mucor sp.R3 at different incubation
冠突散囊菌E1在PD-3-PBA中的生长曲线及对3-PBA的降解曲线如图8所示,冠突散囊菌E1的生长与青霉LJ1、毛霉R3、曲霉M13相比要缓慢的多。E1培养8d后生长才趋于稳定,并且最终细胞干重量也要比其他三种霉菌少,相同的是3-PBA对E1的生长同样存在抑制。

图8 冠突散囊菌E1降解3-PBA曲线Fig.8 Degradation curve of 3-PBA by Eurotium cristatum E1
而E1降解3-PBA的产物与其他三种存在一定的差异,如图9所示,同样有新物质C产生,但在保留时间2.2min处出现了新的吸收峰,即物质E。

图9 不同时间冠突散囊菌E1的PD-3-PBA体系样品的HPLC谱图Fig.9 HPLC chromatograms of samples taken from PD-3-PBA culture systems for Eurotium cristatum E1 at different incubation
通过测试的四种霉菌在PD以及PD-3-PBA中的生长曲线以及对3-PBA的降解情况可以看出,3-PBA对测试的四种霉菌的生长均存在一定的抑制作用,随着3-PBA的降解,抑制作用逐渐减弱,但最终的生长量会有所下降。可以推断3-PBA对霉菌的生长都存在一定的抑制作用,表现为延滞期增长、最终生物量降低,但这种抑制并没有影响菌株对3-PBA的降解。随着菌株的生长,3-PBA残留量不断减少,抑制作用也逐渐降低,菌体生长速度加快和生物量得到积累,其原因可能与菌株不断调整酶与辅酶的合成以适应环境的改变有关,这与3-PBA对真菌具有较强毒性作用的报道相符合[12]。并且通过其降解3-PBA的HPLC谱图可以看出,虽然测试的四种霉菌对3-PBA都有降解,但降解产物却并不相同,可以判断它们降解3-PBA的途径和机制存在一定的差异。根据已有的相关报道[8,20-21],推测其降解途径可能是将3-PBA的二苯醚键断裂,产生单苯环物质或进一步降解;或经过中间转化再将二苯醚键断裂,其降解途径和机制有待进一步研究。
3 结论
本实验通过真菌对3-PBA降解的初步研究,得出实验室保存的和从环境中分离的共30株不同霉菌对3-PBA均有不同程度的降解,而供试的6株酵母菌对3-PBA均无降解能力。推测丝状真菌—霉菌可能具有降解3-PBA的共性。并且通过HPLC谱图可以看出,不同种类的霉菌降解3-PBA的产物不同,说明其降解3-PBA的途径与机制不同,其产生的中间代谢产物能否被进一步降解以及其不同的途径和机制有待进一步研究。同时,实验结果表明3-PBA对真菌的生长具有抑制作用,但这种抑制作用并没有影响其对3-PBA的降解。
[1]Xia W J,Zhou J M,Wang H Y,et al.Effect of nitrogen on the degradation ofcypermethrin and its metabolite 3-phenoxybenzoic acid in soil[J].Pedosphere,2008,18(5):638-644.
[2]胡春容,李君.拟除虫菊酯农药的毒性研究进展[J].毒理学杂志,2005,19(3):239-241.
[3]Sun H,Xu X L,Xu C H,et al.Antiandrogenic activity of pyrethroid pesticides and their metabolite in reporter gene assay [J].Chemosphere,2007,66(3):474-479.
[4]White G F,Russell N J,Tidswell E C.Bacterial scission of ether bonds[J].Microbiologcal Reviews,1996,60(1):216-232.
[5]郑金来,李君文,晁福寰.常见农药降解微生物研究进展及展望[J].环境科学研究,2011,14(2):62-64.
[6]李顺鹏,蒋建东.农药污染土壤的微生物修复研究进展[J].土壤,2004,36(6):577-583.
[7]Maloney S E,Maule A,Smith A R.Transformation of synthetic pyrethroid insecticides by a thermophilic Bacillus sp.[J].Archives of Microbiology,1992,158(4):282-286.
[8]Tallur P N,Meqadi V B,Ninnekar H Z.Biodegradation of cypermethrin by Micrococcus sp.strain CPN 1[J].Biodegradation,2008,19(1):77-82.
[9]Halden R U,Tepp S M,Halden B G,et al.Degradation of 3-phenoxybenzoic acid in soil by Pseudomonas pseudoalcaligenes POB310(pPOB) and two modified Pseudomona strains[J]. Applied and Environmental Microbiology,1999,65(8):3354-3359.
[10]Chen S H,Hu M Y,Yang L,et al.Biodegradation of betacypermethrin and 3-phenoxybenzoic acid by a novel Ochrobactrum lupini DG-S-01[J].J Hazard Mater,2011,187(1-3):433-440.
[11]Topp E,Akhtar M H.Mineralization of 3-phenoxybenzoate by a two-memberd bacterial co-culture[J].Canadian Journal of Microbiology,1990,36(7):495-499.
[12]许育新,孙纪全,李晓慧,等.两株菌对氯氰菊酯及其降解产物3-PBA的协同代谢研究[J].微生物学报,2007,47(5):834-837.
[13]段晓芹,何健,郑金伟,等.3-PBA降解菌BA3的降解特性及基因工程菌构建[J].环境科学,2011,32(1):240-245.
[14]许育新,李晓慧,秦华,等.3-苯氧基苯甲酸降解菌的分离及降解特性的研究[J].微生物学通报,2005,32(5):62-66.
[15]刘书亮,姚开,贾冬英,等.HPLC法检测米曲霉降解体系中氯氰菊酯前处理方法的研究[J].四川大学学报:工程科学版,2011(4):179-183.
[16]赵楠,刘书亮,赖文,等.HPLC-UV法测定微生物降解体系中3-苯氧基苯甲酸含量[J].食品科学,2011,32(14):181-184.
[17]谢文军,周健民,王火焰,等.HPLC法测定土壤中3-苯氧基苯甲酸[J].农业环境科学学报,2007,26(2):608-611.
[18]张锡辉.高等环境化学与微生物学原理及应用[M].北京:化学工业出版社,2001.
[19]Kolaczinski J H,Curtis C F.Chronic illness as a result of low-levelexposure to synthetic pyrethroid insecticdes:a review of the debate[J].Food and Chemical Toxicology,2004,42(5):697-706.
[20]袁怀瑜.黑曲霉YAT1降解氯氰菊酯及3-苯氧基苯甲酸特性和途径的初步研究[D].雅安:四川农业大学,2012.
[21]Guo P,Wang B Z,Hang B J,et al.Cloning of a novel pyrethroid-hydrolyzing carboxylesterase gene from Sphingobium sp.strain JZ-1 and characterization of the gene product[J].Appl Environ Microbiol,2009,75(22):5496-5500.
Study on characteristics and ability of degradation effect of 3-phenoxybenzoic acid by filamentous fungi
LI Jin-yong1,LIU Shu-liang1,*,YAO Kai2,LI Jian-long1
(1.College of Food Science,Sichuan Agricultural University,Ya’an 625014,China;2.College of Light Industry and Food,Sichuan University,Chengdu 610065,China)
Six strains saved in laboratory including Penicillium chrysogenum QH,Aspergillus oryzae MAY,Mucor mucedo MHC,Rhizopus nigricans GH,Saccharomyces cerevisiae Y1 and Candida utilis Y2 were clutured in PD medium of 48h with oscillation.3-phenoxybenzoic acid(100mg/L)were degraded by four mold stains 77.12%,77.19%,55.46%,72.38%respectively.However,stains Y1 and Y2 had no degradation to 3-PBA.The six strains had no growth and no degradation to 3-PBA after oscillating clutured 48h in MM medium.Twelve strains of mold and 4 strains of yeasts isolated from environment,14 strains of known mold were tested for 3-PBA degradation,26 strains of mold had different degrees of degradation to 3-PBA and 4 strains of yeasts have no degradation in PD medium.We could speculate that filamentous fungi had the ability to degrade 3-PBA in common.Result indicated that different mold might have different 3-PBA degradation pathways and result in different degradation products showed in HPLC chromatograms.In addition,3-PBA had inhibitory effect on the growth of filamentous fungi tested in the study.
filamentous fungi;3-phenoxybenzoic acid;degradation characteristics
Q939.5
A
1002-0306(2014)06-0161-06
2013-07-19 *通讯联系人
李金永(1986-),男,硕士研究生,研究方向:食品微生物。
国家自然科学基金资助项目(31371775)。

