超分子凝胶性质与溶剂参数关系的研究进展
赵呈孝 王海涛 李 敏
(1南京林业大学理学院,南京210037;2吉林大学材料科学与工程学院,长春130012)
1 引言
超分子凝胶(也称有机小分子凝胶或分子凝胶)是低分子量有机小分子(称为凝胶因子)通过分子间氢键、范德华力、π-π作用、配位作用、偶极-偶极作用、亲/疏水作用等非共价键作用以及它们之间的协同作用自发地聚集、组装成三维网络结构,并能够包裹住溶剂,使溶剂固定不动的一类软材料.1-5根据不同的性质,超分子凝胶可应用于药物载体、6环境响应材料、7-14传感材料、15,16有机/无机纳米材料合成模板、17,18液晶材料、19,20光电材料21-26以及催化领域27等.虽然超分子凝胶在各个领域都具有很好的应用前景,文献报道也非常多,然而大部分的发现却是通过在各种溶剂中一一尝试的结果.28-30显然一种超分子凝胶的发现具有随机性和不可预测性,因此,设计一种功能性凝胶因子并准确预测其在不同溶剂中的凝胶行为及性质对超分子凝胶的研发具有重要意义.
为了探索一种有效的凝胶设计方案,人们一直努力地研究超分子凝胶形成机理.早期人们认为引起凝胶化的主要因素是凝胶因子结构,因为容易自组装形成网状结构的凝胶因子有利于在溶剂中形成凝胶.5之后较长时间里,人们的研究都主要集中于通过凝胶因子结构的设计来调整凝胶因子间相互作用,试图获得相应功能的有机凝胶,如各种氢键型凝胶因子和π-共轭型凝胶因子.31-37遗憾的是到目前为止,仍然不能仅通过凝胶因子结构设计获得特定的超分子凝胶.另一方面,在一个凝胶系统中,溶剂占据了绝大部分体积,显然溶剂也是影响凝胶性质不可忽略的因素.38,39值得兴奋的是,在2000年Wang等39通过原子力显微镜(AFM)观察到由分子1(结构见示意图1)堆砌的纤维之间填充了约30%的正辛醇,证明了溶剂分子与凝胶因子之间存在相互作用.之后出现了大量关于溶剂-凝胶因子作用影响凝胶行为和性质的报道.由于溶剂参数能在一定程度上直接或间接反映溶剂与凝胶因子的作用,所以有研究者从溶剂参数角度来研究溶剂-凝胶因子作用的影响,并取得了显著成果.本文将介绍目前关于凝胶性质与溶剂参数关系的研究进展.
2 溶剂参数定义及其分类
目前用来研究超分子凝胶性质的溶剂参数主要分为两类.一类为体参数,反映溶剂的整体性质,如溶剂的介电常数(ε)、经验极性参数(ET(30))、Hildebrand 溶度参数(δ)和 Flory-Huggins参数(χ)等.溶度参数(δ)是衡量液体相容性的物理常量,反映了溶剂分子之间作用力的总和,其定义为:物质内聚能密度(单位体积的内聚能)开平方,如式(1)所示;40经验极性参数(ET(30))可描述溶剂分子-凝胶因子作用;Flory-Huggins参数反映聚合物分子和溶剂分子混合时的相互作用能变化.另一类为分参数,反映溶剂的各种作用力,如Hansen溶度参数(HSPs)(δd、δp、δh)、Kamlet-Taft参数(π*、α、β)等.Hansen将内聚能拆分成几个独立的内聚能之和,它们分别源于原子的色散力(δd)、分子的偶极作用(δp)和分子间氢键作用(δh),因此Hildebrand参数与Hansen参数之间存在式(2)的关系,41-44偶极和氢键的协同作用可用δa表示(式(3));45,46Kamlet-Taft参数中的α参数代表溶剂的质子给予能力,β参数为质子接受能力,而π*反映溶剂的广义极性参数.47
示意图1 分子1的结构式Scheme 1 Structure formula of molecule 1

式中V是溶剂的摩尔体积,E是摩尔体积的溶剂的气化能.

3 超分子凝胶性质与溶剂参数的关系
3.1 超分子凝胶性质与溶剂体参数的关系
由于溶剂参数代表了溶剂的溶剂化能力,所以溶剂参数可用来描述溶剂对超分子凝胶性质的影响.在最初的研究中,人们只是简单地将溶剂体参数与凝胶各种性质相结合建立相应的关系,间接反映溶剂对凝胶性质的影响规律.如凝胶因子2能在醇溶剂中形成热稳定性不同的超分子凝胶,且其凝胶-溶胶转变温度(Tgel)与溶剂介电常数(ε)呈线性递减关系(图1);48凝胶因子3(结构见示意图2)在苯、甲苯、氯苯和硝基苯中形成凝胶的Tgel与ε呈指数递减关系,与δ和ET(30)呈线性递减关系(图2(a,b,c)).49同样的,凝胶能力与溶剂参数之间也存在着类似的关系,如凝胶因子4a和4b(结构见示意图2)在各类溶剂中的凝胶能力(gelation number,GN,平均每个凝胶因子所能捕获的溶剂分子数目)会随着δ值的增加而逐渐减弱(图3(a,b,c)).50这些结果表明溶剂的溶剂化能力越弱,溶剂-凝胶因子作用就越小,得到的超分子凝胶就更稳定.
3.2 超分子凝胶性质与溶剂分参数的关系
溶剂的溶度参数、电介质常数、经验极性参数等这些体参数仅能代表溶剂的整体极性,而不能在分子水平上准确地反映溶剂化作用.51因此,在后来的研究中为了深入地探索溶剂对超分子凝胶性质影响的本质,人们在数据分析中引入了Hansen参数(δd、δp、δh)和 Kamlet-Taft参数(π*、α、β)等分参数,如在凝胶因子5(结构见示意图2)的凝胶性质研究中,Hirst和Smith52比较了ε、ET(30)和Hansen参数(δd、δp、δh、δa)与凝胶热稳定性(Tgel)的关系.相比于ε、ET(30)参数,用δp、δh和δa参数更能准确描述溶剂对凝胶Tgel值的影响,如图4(d,e,f)所示.这一结果说明溶剂和凝胶因子间的偶极作用和氢键作用是溶剂影响凝胶稳定性的主要因素.为了更准确地区分凝胶因子5受哪类氢键型溶剂的影响(氢键受体溶剂和氢键给体溶剂),作者结合溶剂的α、β参数对凝胶Tgel值进行分析,发现凝胶因子5在氢键受体溶剂(如,四氢呋喃)中能形成凝胶,而在氢键给体溶剂(如,二氯甲烷)不能形成超分子凝胶,说明氢键给体溶剂很可能与枝状肽中的羰基作用阻碍纤维的形成,进而影响凝胶的形成.
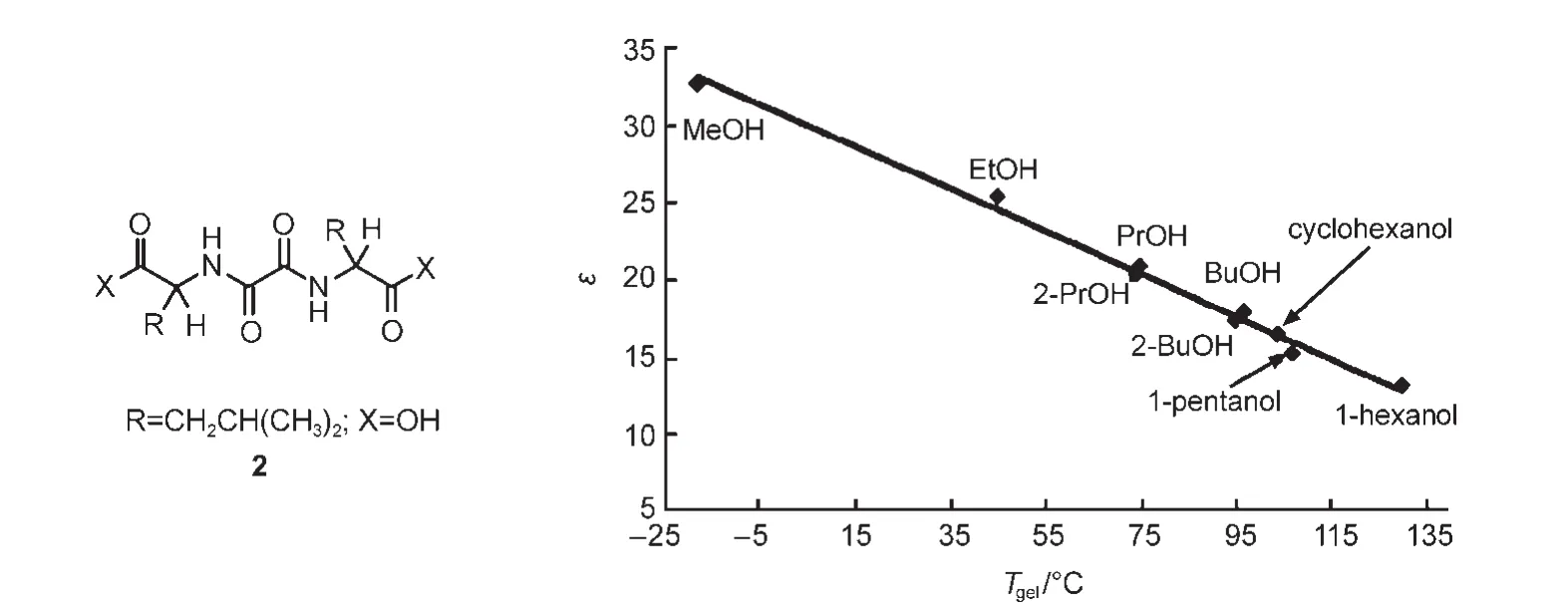
图1 分子2/醇溶剂的凝胶-溶胶转变温度(Tgel)与溶剂介电常数(ε)的线性关系48Fig.1 Linear correlation of gel-sol phase transition temperature(Tgel)and solvent dielectric constant(ε)for molecule 2/alcohol solvents48

示意图2 分子3-5的结构式Scheme 2 Structure formulas of molecules 3-5
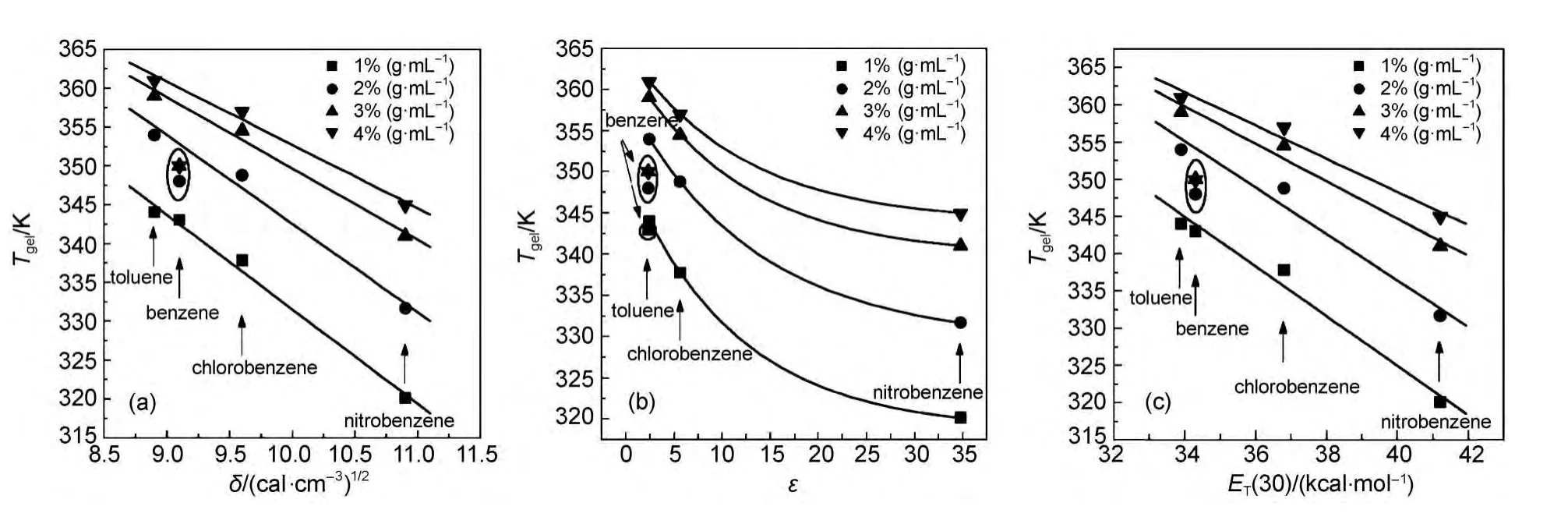
图2 不同溶剂极性参数对凝胶因子3在苯、甲苯、氯苯和硝基苯中形成凝胶的Tgel的影响49Fig.2 Effects of different polarity parameters on the Tgelvalues of gelator 3 in benzene,methylbenzene,chlorobenzene,and nitrobenzene solvents49
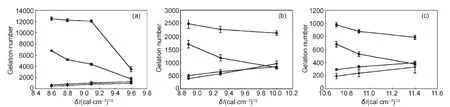
图3 凝胶因子4a-4d的凝胶能力(GN)与Hildebrand溶解度参数的关系(δ)50Fig.3 Relationship between Hildebrand solubility parameter(δ)and gelation number(GN)of gelators 4a-4d50

图4 双组分凝胶因子5的Tgel值与各种溶剂参数的关系52Fig.4 Relationship between Tgelof the two-component gelator 5 and solvent polarity parameters52
目前,这种利用分参数研究溶剂影响凝胶性质的方法主要用于氢键型超分子凝胶的研究.一般来说,溶剂氢键结合能力对氢键型超分子凝胶性质影响比其他分子间作用力更为显著:溶剂的氢键结合能力越强,越容易与凝胶因子形成氢键,凝胶的稳定性就越差.如氢键型凝胶因子6在甲苯(TOL)、苯(BZ)、邻二氯苯(DCB)、乙二醇二甲醚(DME)、乙酸乙酯(EtOAc)等α=0的溶剂里形成稳定的凝胶,而在乙腈(CAN,α=0.19)和二氯甲烷(DCM,α=0.30)等中等α值溶剂中形成不稳定的凝胶,在α值更高的溶剂中(氯仿、甲醇)保持溶液状态.53此外,在α=0这类溶剂中,凝胶因子6在π*和β值很小的TOL和BZ中形成热稳定性最好的凝胶,在π*值很大的DCB中形成热稳定性较差的凝胶,而在β值很大的DME和EtOAc中形成热稳定性最差的凝胶(图5).
利用溶剂参数研究溶剂对超分子凝胶性质的影响是近几年才引起人们的注意,因此,大多数研究者研究了凝胶热稳定性(凝胶-溶胶转变温度)、凝胶强度(临界凝胶浓度)等凝胶基本性质与溶剂参数的关系.而凝胶流变学性质(如剪切模量)与溶剂参数的关系只有少数文献报道,如Fang等72将P7(结构见示意图3)的混合溶剂(四氢呋喃/水)凝胶的流变学性质与HSPs参数进行了关联,发现凝胶的储存模量(G′)与其损耗模量(G″)的比值(G′/G″)与溶剂溶度参数δ、δd、δp和δh之间存在图6所示的关系.G′/G″在δ=38.06 MPa1/2处出现最大值(图6(a)),表明适当的溶剂-凝胶因子作用使P7凝胶具有最佳的力学稳定性.虽然G′/G″与各个分参数(δd、δp、δh)曲线中没有出现最大值(图6(b,c)),但是从曲线的变化可以看出G′/G″值的变化主要受δh值影响,即P7凝胶的力学稳定性主要受氢键作用的影响.
4 凝胶行为预测
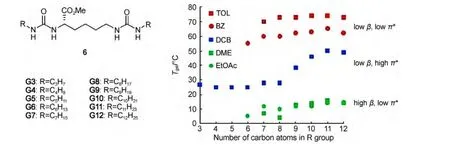
图5 不同链长的分子6在TOL、BZ、DCB、DME、EtOAc等溶剂中形成凝胶的Tgel值53Fig.5 Tgelvalues of molecule 6 with different alkyl chain lengths in TOL,BZ,DCB,DME,and EtOAc solvents53
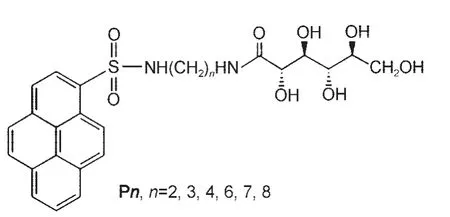
示意图3 分子Pn的结构式Scheme 3 Structure formula of molecule Pn
超分子凝胶形成的关键在于溶剂-凝胶因子作用和凝胶因子-凝胶因子作用需满足合适的平衡条件(它们之间没有太大竞争),使凝胶因子达到某一溶解-析出平衡状态.在实验中,如果确定这一平衡状态,则可以对凝胶因子的凝胶行为进行预测,这对凝胶的研究及应用具有重要意义.由文献40,41,45-47可知,溶剂参数是衡量溶剂-凝胶因子的作用相对大小的物理量,因此,通过溶剂性质与溶剂参数的关系,可建立凝胶因子的凝胶行为预测模型.目前已报道的凝胶行为预测模型可分为三类:一维模型、Teas图模型和Hansen空间模型.
4.1 一维模型
一维模型就是将凝胶行为数据与某个溶剂参数的简单关联.如Li等54对分子2-(3,4-二(烷氧基)苯基)-5-(4-吡啶)-1,3,4-噁二唑(4-POXD-Bn)在不同溶剂中的凝胶行为与各种溶剂参数做了统计分析,发现能被4-POXD-B8和4-POXD-B12凝胶化的溶剂参数ET(30)分别位于 43.3-55.7 kcal∙mol-1和 43.3-50.4 kcal∙mol-1(1 kcal∙mol-1=4.184 kJ∙mol-1)(图7),低于该范围则表现出“solution”行为,而高于该范围则表现“precipitation”或“insoluble”行为.类似的研究有天津大学的Fan和Song课题组55建立了凝胶因子2,4-(3,4-二氯苯)-D-山梨糖(DCBS)在乙醇/环己烷的混合溶剂中的凝胶行为与混合溶液的χ参数之间的关系(图8(a)):χ<3.24,DCBS溶于混合溶剂,χ>12.64,DCBS不溶于的混合溶剂,而在3.96<χ<5.20区域内的混合溶剂形中形成部分凝胶,在4.79<χ<11.59区间的混合溶剂中形成凝胶,利用这一关系成功地预测了DCBS在乙醇/四氯化碳、乙醇/苯等混合溶剂中的凝胶行为.55根据该方法,该课题组还建立了双组分凝胶因子(2-乙基己基二磷酸和三聚氰胺,PM)的凝胶行为与混合溶剂(乙腈/水、N-甲基甲酰胺/水、乙醇/水、乙二醇/水)的χ参数之间的关系图(图8(b)):PM能在1.32<χ<4.45的混合溶剂中形成凝胶,而低于1.32或高于4.45,PM在混合溶剂中形成溶液或沉淀.56,57

图6 溶剂溶度参数(a)δ和 (b,c)δd、δp、δh对2%P7凝胶的G′/G″值的影响72Fig.6 Effect of sovlent parameter(a)δ and(b,c)δd,δp,δhon G′/G″from gels of 2%P7 gel72

图7 4-POXD-Bn(n=8,12)的凝胶行为与ET(30)值之间的关系54Fig.7 Relationship between ET(30)of the studied solvents and the gelation behaviors of 4-POXD-Bn(n=8,12)54
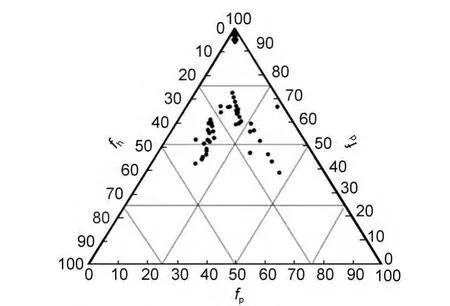
由于Hansen参数和Kamlet-Taft参数比ET(30)、χ等体参数能更详细准确地描述溶剂的各种作用对凝胶性质的影响,因此,在一些凝胶体系中,应用该类溶剂参数能建立更准确的超分子凝胶行为模型.如,凝胶因子R-12-羟基硬酯酸(12HSA),由于存在分子间氢键作用,易与氢键结合能力强的溶剂作用,58所以用Hildebrand和介电常数都不能准确地描述其凝胶行为,但却能用δh参数(反映溶剂的氢键作用能力)描述:12HSA在δh<4.7 MPa1/2的溶剂中形成透明凝胶且随着δh增加(溶剂-凝胶因子氢键作用增强),CGC值增加(图9(c)中插图);在4.7 MPa1/2<δh<5.1 MPa1/2的溶剂中形成不透明凝胶,在5.1 MPa1/2<δh的溶剂中形成溶液(图9).59类似的,Jamart-Grégoire用δh参数成功地描述了氢键型凝胶因子7的凝胶行为.60如图10(c)所示,被凝胶因子7a凝胶化的溶剂都位于δh区域 0.2-1.4(cal∙cm-3)1/2(1 cal∙cm-3=4.184 J∙cm-3)内,并且在该区域不存在其他状态的溶剂(不溶或溶液),这说明该凝胶因子的凝胶行为主要受溶剂的氢键结合能力(氢键给体作用和氢键受体作用)的影响,氢键作用过大(δh>1.4(cal∙cm-3)1/2)将形成溶液,而作用太小(δh<0.2(cal∙cm-3)1/2)则形成沉淀或不溶.该方法同样适用凝胶因子8、9的凝胶行为的预测.
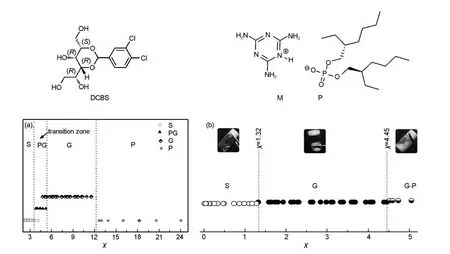
图8 (a)DCBS55和(b)双组分凝胶因子PM56在不同χ值的乙醇/环己烷混合溶剂的凝胶行为Fig.8 Plots of χ parameter versus the gelation behaviors of(a)DCBS55and(b)bi-component PM56 in ethanol/cyclohexane mixed solvents

图9 12HSA在不同溶剂中的临界凝胶浓度(CGC)与溶剂参数之间的关系59Fig.9 Correlations between the critical gelator concentration(CGC)of 12HSAand solvent parameters59

图10 溶剂中凝胶因子7的凝胶行为与Hansen参数的关系60Fig.10 Correlations between Hansen parameter and gelation behaviors of gelators 7a and 7b in solvents60
一维模型的建立,关键在于选择合适的溶剂参数,而溶剂参数的选择却没有具体的标准.因此,在模型建立过程中,需要将凝胶行为数据与各种溶剂参数进行关联,从中选择关联度最高的一种作为凝胶因子的凝胶行为预测工具.同时,这也反映出一个一维模型的适用范围仅限于对该类凝胶因子的凝胶行为预测.此外,以分参数建立的一维模型忽略了溶剂和凝胶因子间的弱相互作用力的影响,因此,在某些凝胶体系中,一维模型不能完全准确地预测其凝胶行为.如图10(c)所示的分子7a的一维凝胶行为预测模型,虽然四氯化碳和甲基萘分别位于7a的凝胶区域内和区域外,但实验结果显示7a在四氯化碳和甲基萘中分别形成了凝胶和溶液.60
4.2 Hansen空间模型
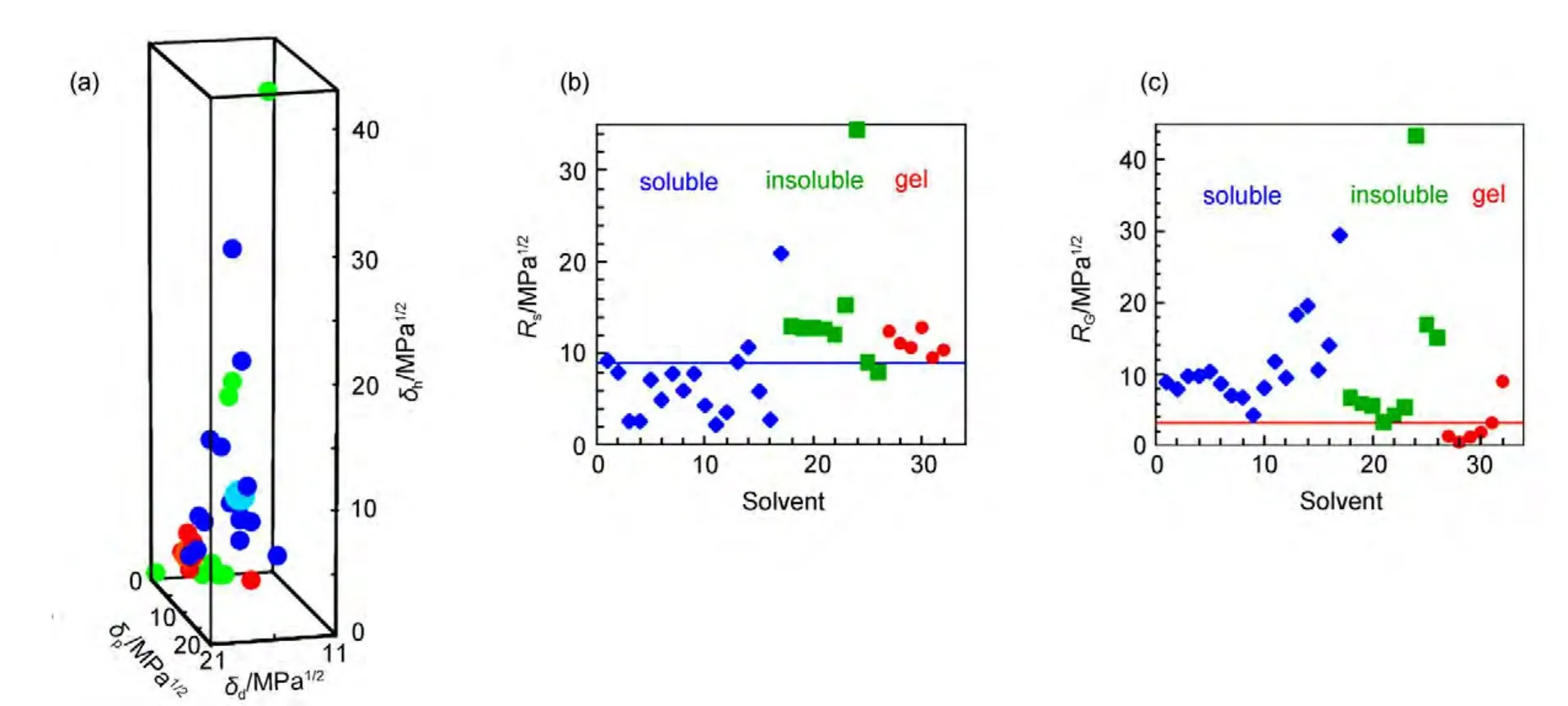
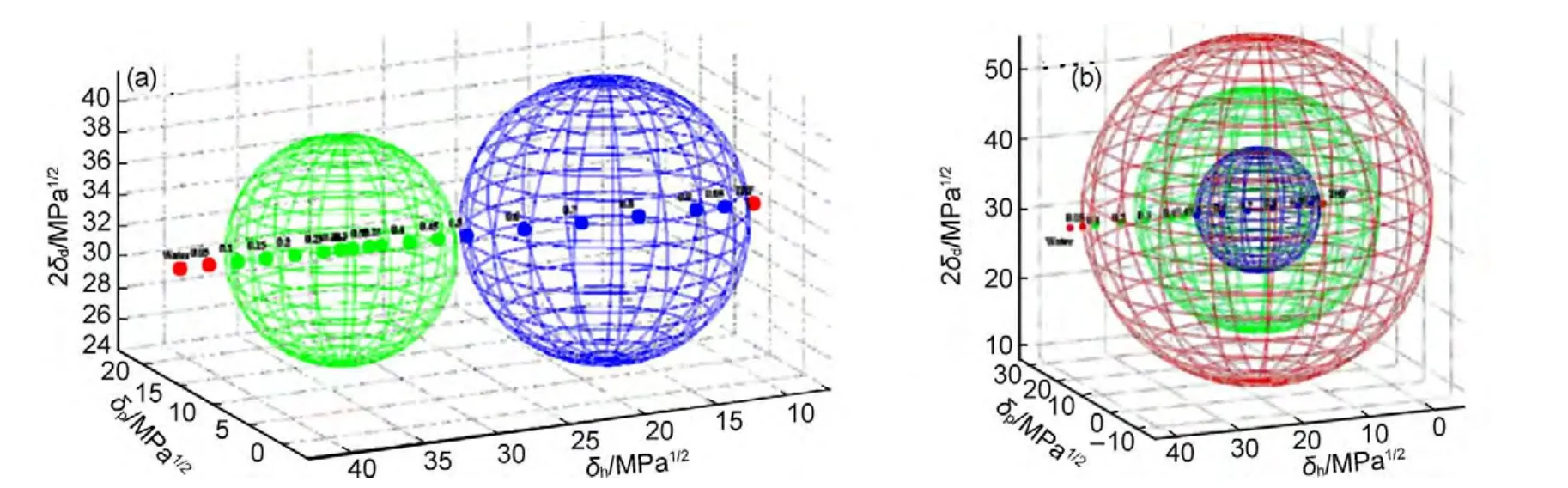
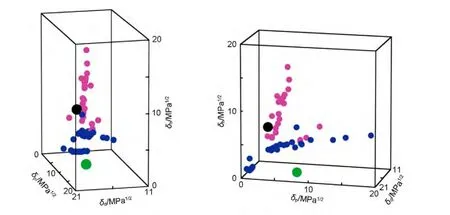
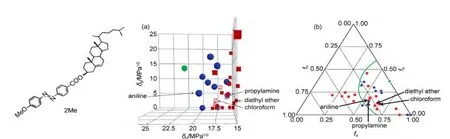
一维模型由于其局限性,不能在研究中广泛采用.因而寻找一种实用性更强的超分子凝胶行为预测方法十分重要.在高分子领域,可用溶度参数法(Hansen solubility parameters,HSPs)预测聚合物在各种溶剂中的溶解性,并且该方法已被广泛地用于涂层材料合适溶剂的选择.40,61HSPs法就是比较溶剂和聚合物在Hansen空间的距离(R),将笛卡尔坐标系中的x、y、z坐标轴分别由HSPs参数的δd、δp和δh替换(图11),形成Hansen空间,故δd、δp和δh也称为三维溶度参数.62在Hansen空间中,聚合物的良溶剂群集在其位置周围的特定区域,大量实验数据显示该区域为一球形,定义为聚合物溶度球,其球心为聚合物HSPs(δd、δp、δh),半径为Rsol.63,64溶剂和聚合物的在Hansen空间的距离R可以根据实验公式(4)计算获得,当R>Rsol,则聚合物不能溶于该溶剂;当R 图11 Hansen空间中的三维溶解度参数球Fig.11 Three-dimensional solubility parameters in Hansen space 其中,δd、δp和δh为溶质的三维溶度参数,为溶剂的三维溶度参数. 超分子凝胶的形成是将凝胶因子加热溶于溶剂中,在降温过程中,如果溶剂-凝胶因子作用和凝胶因子-凝胶因子作用满足合适的平衡条件就能形成凝胶;相反,若溶剂-凝胶因子作用远大于或小于凝胶因子-凝胶因子作用,则会形成溶液或沉淀;因此,研究者们猜测凝胶因子的良溶剂和凝胶化的溶剂会分别群集在Hansen空间的不同区域.Raynal和Bouteiller64做了相应的实验验证,如图12(a)所示.在Hansen空间中,凝胶因子10(结构见示意图4)的良溶剂群集在δp和δh值较大的区域,而能被10凝胶化的溶剂群集在δp、δh值较小和δd值较大的区域.类似的,作者还对其他类型的凝胶因子,如氢键型(11-13)、66,67离子型(14、15)68和π共轭-偶极-范德华力型(16、17)69,70都做了验证,并得到了相似的结果:良溶剂和能被凝胶化的溶剂将分别群集在Hansen空间的不同区域. 图12 (a)凝胶因子10(30 g∙L-1)的凝胶行为数据在Hansen空间中的表述以及与(b)溶度球心和(c)凝胶球心距离分布64Fig.12 Solubility data for LMWG 10(30 g∙L-1)represented in Hansen space(a),and the distances in Hansen space(b)to the centre of the solubility sphere or(c)to the gelation sphere64 为了将这种图形转化为预测凝胶行为的工具,则需要明确各个区域的分界线.可仿照聚合物溶度球模型建立凝胶球模型,即在Hansen空间中确定凝胶因子的凝胶球心和半径(RGel),若待测溶剂坐标位于球内,则形成凝胶;若待测溶剂坐标位于球外,则形成沉淀或溶液.Raynal和Bouteiller通过计算确定了各种类型的凝胶因子10-17的溶度球心和半径以及凝胶球心和半径.64如图12(b,c)所示,大多数的良溶剂都在10的溶解球半径(RSol)内,绝大多数可被凝胶化的溶剂都在凝胶球半径(RGel)内.由此可见,该种方法可应用于各类型凝胶因子的凝胶行为预测.为了便于观察,有研究者通过软件71将Hansen空间中的溶度球和凝胶球进行了模型拟合,如Weiss等通过软件拟合出了凝胶因子P772和1,3:2,4-二亚苄基山梨醇(DBS)73在Hansen空间的溶度球和凝胶球(图13、14). 示意图4 分子10-17的结构式Scheme 4 Structure formulas of molecules 10-17 通过溶度法建立的溶度球或凝胶球模型过程中,凝胶因子的HSPs参数的确定较为关键.文献中通常采用实验法74和基团贡献法75计算获得HSPs值.通过这些方法测得凝胶因子的HSPs参数可以近似于其溶度球心,但是Bouteiller认为该数值不能作为凝胶球心,因为对12HSA通过基团贡献法计算出的HSPs参数值与通过试验得到的凝胶球心不能重合,如图15所示.65由此,在建立模型时可能会出现溶度球和凝胶球相重叠的同心球模型或两者分离的独立球状模型,如DBS在Hansen空间中的凝胶行为数据位于溶度球外层(图14);而凝胶因子P7的溶度球和凝胶球为两个独立的球体(图13(a)),不过对于该种现象可通过修改拟合方程能使其转变为同心球形(图13(b)). Hansen空间模型的建立是基于大量的数据信息和强大的数据处理、图形模拟软件(如MATLAB软件等),这就要求研究者必须熟练使用这类软件,并能正确编写或修改图形处理程序.然而,当获得的凝胶行为数据较少时,则可能无法拟合出准确的溶度球和凝胶球,如双组分凝胶因子PM52在水和有机溶剂的混合溶剂中的凝胶行为数据虽然群集在较高的δp值和中等的δh值区域,但却不能拟合出可行的凝胶球模型(图16).65此外,目前关于Hansen空间模型的文献都集中于对单组分凝胶因子报道,而对双组分或多组分共混凝胶因子的凝胶行为预测模型还有待建全. 为减少对软件的依赖,有研究者用Teas图模型(二维(2D)模型)来替代Hansen空间模型.59,76-78Teas图法就是将HSPs参数归一化(公式(5)),从而使数据能在一个2D的三角形坐标中描绘出来,其坐标分别为fd、fp、fh.与Hansen空间法相似,能被凝胶因子凝胶化的溶剂将聚集在Teas图中的某一特定区域.如能12HSA的凝胶化的溶剂群集在Teas图中的fd>50%,10% Teas图法能在数据点有限的情况下建立模型并且操作简单可行.但需要注意的是Teas图法缺乏理论证明,其数据表述可能会使人产生误解:在Hansen空间中近邻的溶剂在Teas图中也是近邻的;反之,在Teas图中近邻的溶剂在Hansen空间有可能相距较远,如具有不同溶解性质的乙醚(δd=14.5 MPa1/2,δp=2.9 MPa1/2,δh=4.6 MPa1/2)和氯仿 (δd=17.8 MPa1/2,δp=3.1 MPa1/2,δh=5.7 MPa1/2)在Hansen空间中相距较远,而在Teas图中几乎在同一位置(图18).65所以在建立模型时可能会出现这样的情况:凝胶因子的凝胶行为数据和溶解数据在Hansen空间中具有清晰界线,而在Teas图中该界线则比较模糊或者消失.如图18所示,2Me的凝胶化溶剂和良溶剂在Hansen空间分区明显,而在Teas图中则很难划分区域.65因此,Teas图法不能完全代替Hansen空间模型作为凝胶行为预测工具. 图13 P7(2.0%)在Hansen空间拟合的溶度球和凝胶球模型73Fig.13 Solubility ball and gel ball data for P7(2.0%)in liquid mixtures represented in Hansen space73 图14 在Hansen三维空间中DBS(5%)在不同溶剂中的凝胶行为描述74Fig.14 Gelation behavior description for 5%DBS in various solvents plotted in three dimensional Hansen space74 图15 12HSA的凝胶溶解度数据在Hansen空间的描述65Fig.15 Solubility data for 12HSArepresented in Hansen space65 图16 双组分凝胶因子PM的凝胶溶解度数据在Hansen空间的描述65Fig.16 Solubility data for the two-component PM represented in Hansen space65 图17 12HSA在不同溶剂中的凝胶行为在Teas图中的描述59Fig.17 Teas plot of calculated solubility parameters for 12HSAin varying solvents59 图18 2Me在不同溶剂中的凝胶溶解度数据分别在(a)Hansen空间和(b)Teas图中的描述65Fig.18 Solubility data for cholesterol-based LMWG 2Me represented(a)in Hansen space and(b)in a Teas plot65 本文从溶剂参数角度综述了溶剂对超分子凝胶性质的影响.利用溶剂参数研究凝胶性质是一种新型的研究手段,在同一系列凝胶中(由同一凝胶因子在不同溶剂中凝胶化而成的凝胶),凝胶性质(Tgel、CGC 等)与溶剂参数(ε、ET(30)、χ、δ、δd、δp、δh等)存在线性或指数等关系,这些关系反映了溶剂-凝胶因子作用的变化对凝胶性质的影响规律,进一步揭示了超分子凝胶机理.利用这些关系可以预测凝胶因子在待测溶剂中的凝胶性质.基于凝胶行为数据和不同的溶剂参数可建立一维、Teas图和Hansen球状凝胶行为模型,其中Hansen球状模型成功地用于各类型凝胶因子的凝胶行为预测,有助于凝胶的设计和应用.该结果改变了一直以来凝胶行为和性质无法预测的现状,深化了凝胶机理研究,将在分子自组装、纤维尺寸和凝胶形貌调控等研究中起着重要的指导作用. (1) Terech,P.;Weiss,R.G.Chem.Rev.1997,97(8),3133.doi:10.1021/cr9700282 (2) Abdallah,D.J.;Weiss,R.G.Adv.Mater.2000,12(17),1237. (3) Sangeetha,N.M.;Maitra,U.Chem.Soc.Rev.2005,34(10),821.doi:10.1039/b417081b (4) Dastidar,P.Chem.Soc.Rev.2008,37(12),2699.doi:10.1039/b807346e (5) Terech,P.;Weiss,R.G.Molecular Gels:Materials with Self-Assembled Fibrillar Networks;Springer:Dordrecht,2006. (6) Sabadini,E.;Francisco,K.R.;Bouteiller,L.Langmuir2010,26(3),1482.doi:10.1021/la903683e (7) Cravotto,G.;Cintas,P.Chem.Soc.Rev.2009,38(9),2684.doi:10.1039/b901840a (8) Maeda,H.Chem.-Eur.J.2008,14(36),11274.doi:10.1002/chem.200801333 (9) Kawano,S.I.;Fujita,N.;Shinkai,S.J.Am.Chem.Soc.2004,126(28),8592.doi:10.1021/ja048943+ (10)Yagai,S.;Nakajima,T.;Kishikawa,K.;Kohmoto,S.;Karatsu,T.;Kitamura,A.J.Am.Chem.Soc.2005,127(31),11134.doi:10.1021/ja052645a (11) Mukhopadhyay,P.;Iwashita,Y.;Shirakawa,M.;Kawano,S.;Fujita,N.;Shinkai,S.Angew.Chem.Int.Edit.2006,45(10),1592. (12)Matsumoto,S.;Yamaguchi,S.;Ueno,S.;Komatsu,H.;Ikeda,M.;Ishizuka,K.;Iko,Y.;Tabata,K.V.;Aoki,H.;Ito,S.;Noji,H.;Hamachi,I.Chem.-Eur.J.2008,14(13),3977. (13) Piepenbrock,M.O.M.;Lloyd,G.O.;Clarke,N.;Steed,J.W.Chem.Rev.2010,110(4),1960.doi:10.1021/cr9003067 (14) de Jong,J.J.D.;Lucas,L.N.;Kellogg,R.M.;van Esch,J.H.;Feringa,B.L.Science2004,304,278.doi:10.1126/science.1095353 (15) Bardelang,D.;Zaman,M.B.;Moudrakovski,I.L.;Pawsey,S.;Margeson,J.C.;Wang,D.;Wi,X.;Ripmeester,J.A.;Ratcliffe,C.I.;Yu,K.Adv.Mater.2008,20(23),4517.doi:10.1002/adma.v20:23 (16)Yoshimura,I.;Miyahara,Y.;Kasagi,N.;Yamane,H.;Ojida,A.;Hamachi,I.J.Am.Chem.Soc.2004,126(39),12204.doi:10.1021/ja045962a (17) Amabilino,D.B.;Puigmarti-Luis,J.Soft Matter2010,6(7),1605. (18) Jung,J.H.;Parka,M.;Shinkai,S.Chem.Soc.Rev.2010,39(11),4286.doi:10.1039/c002959a (19)Kato,T.;Hirai,Y.;Nakaso,S.;Moriyama,M.Chem.Soc.Rev.2007,36(12),1857.doi:10.1039/b612546h (20)Wan,J.H.;Mao,L.Y.;Li,Y.B.;Li,Z.F.;Qiu,H.Y.;Wang,C.;Lai,G.Q.Soft Matter2010,6(14),3195.doi:10.1039/b925746b (21) Kawano,S.;Fujita,N.;Shinkai,S.Chem.-Eur.J.2005,11(16),4735. (22) George,S.J.;Ajayaghosh,A.Chem.-Eur.J.2005,11(11),3217. (23) Yagai,S.;Kubota,S.;Iwashima,T.;Kishikawa,K.;Nakanishi,T.;Karatsu,T.;Kitamura,A.Chem.-Eur.J.2008,14(17),5246. (24) Babu,S.S.;Praveen,V.K.;Ajayaghosh,A.Chem.Rev.2014,114(4),1973.doi:10.1021/cr400195e (25)Zuo,X.;Cai,F.;Liu,X.M.;Yang,H.;Shen,X.D.Acta Phys.-Chim.Sin.2013,29(1),64.[左 翔,蔡 烽,刘晓敏,杨 晖,沈晓冬.物理化学学报,2013,29(1),64.]doi:10.3866/PKU.WHXB201211023 (26)Yu,W.;Li,Y.G.;Wang,T.Y.;Liu,M.H.;Li,Z.S.Acta Phys.-Chim.Sin.2008,24(9),1535.[于 卫,李远刚,王天宇,刘鸣华,李占双.物理化学学报,2008,24(9),1535.]doi:10.1016/S1872-1508(08)60062-5 (27) Raynal,M.;Portier,F.;van Leeuwen,P.W.N.M.;Bouteiller,L.J.Am.Chem.Soc.2013,135(47),17687.doi:10.1021/ja408860s (28) Terech,P.;Weiss,R.G.Chem.Rev.1997,97(8),3133.doi:10.1021/cr9700282 (29) Dastidar,P.Chem.Soc.Rev.2008,37(12),2699.doi:10.1039/b807346e (30) Dawn,A.;Shiraki,T.;Haraguchi,S.;Tamaru,S.;Shinkai,S.Chem.-Asian J.2011,6(2),266. (31) Engelkamp,H.;Middelbeek,S.;Nolte,R.J.M.Science1999,284(5415),785.doi:10.1126/science.284.5415.785 (32) Pozzo,J.L.;Clavier,G.M.;Desvergne,J.P.J.Mater.Chem.1998,8(12),2575.doi:10.1039/a807237j (33) Srinivasan,S.;Babu,P.A.;Mahesh,S.;Ajayaghosh,A.J.Am.Chem.Soc.2009,131(42),15122.doi:10.1021/ja9072035 (34)Ajayaghosh,A.;Varghese,R.;Praveen,V.K.;Mahesh,S.Angew.Chem.Int.Edit.2006,45(20),3261. (35)Würthner,F.;Hanke,B.;Lysetska,M.;Lambright,G.;Harms,G.S.Org.Lett.2005,7(6),967.doi:10.1021/ol0475820 (36) Zhong,J.L.;Pan,H.;Luo,X.Z.;Hong,S.G.;Zhang,N.;Huang,J.B.Acta Phys.-Chim.Sin.2014,30(9),1688.[钟金莲,潘 虹,罗序中,洪三国,张 宁,黄建滨.物理化学学报,2014,30(9),1688.]doi:10.3866/PKU.WHXB201407041 (37)Xue,M.;Miao,Q.;Fang,Y.Acta Phys.-Chim.Sin.2013,29(9),2005.[薛 敏,苗 青,房 喻.物理化学学报,2013,29(9),2005.]doi:10.3866/PKU.WHXB201306142 (38)Aggeli,A.;Bell,M.;Boden,N.;Keen,J.N.;Knowles,P.F.;McLeish,T.C.B.;Pitkeathly,M.;Radford,S.E.Nature1997,386(6622),259.doi:10.1038/386259a0 (39)Wang,R.;Geiger,C.;Chen,L.;Swanson,B.;Whitten,D.G.J.Am.Chem.Soc.2000,122(10),2399.doi:10.1021/ja993991t (40) Hansen,C.M.Solubility Parameters-An introduction,Hansen Solubility Parameters:aUser′sHandbook,2nd ed.;CRC Press:LLC Boca Raton,FL,2007. (41) Hansen,C.M.;Beerbower,A.Solubility Parameters.InKirk-Othmer Encyclopedia of Chemical Technology,Suppl.Vol.,2nd ed.;Standen,A.Ed.,Interscience:New York,1971;p 889. (42) Hansen,C.M.J.Paint Technol.1967,39(505),104. (43) Hansen,C.M.J.Paint Technol.1967,39(511),505. (44) Hansen,C.M.;Skaarup,K.J.Paint Technol.1967,39(511),511. (45) Barton,A.F.M.Chem.Rev.1975,75(6),731.doi:10.1021/cr60298a003 (46) Hildebrand,J.H.;Scott,R.L.The Solubility of Non-Electrolytes,3rd ed.;Dover Publishing:New York,1964. (47)Kamlet,M.J.;Abboud,J.L.M.;Abraham,M.H.;Taft,R.W.J.Org.Chem.1983,48(17),2877.doi:10.1021/jo00165a018 (48) Makarevic,J.;Jokic,M.;Peric,B.;Tomisic,V.;Kojic-Prodic,B.;Zinic,M.Chem.-Eur.J.2001,7(15),3328. (49) Bielejewski,M.;Łapiński,A.;Luboradzki,R.;Tritt-Goc,J.Langmuir2009,25,8274.doi:10.1021/la900467d (50) Zhu,G.;Dordick,J.S.Chem.Mater.2006,18(25),5988.doi:10.1021/cm0619297 (51) Reichardt,C.Solvents and Solvent Effects in Organic Chemistry,2nd ed.;VCH:Weinheim,Germany,1988. (52) Hirst,A.R.;Smith,D.K.Langmuir2004,20(25),10851.doi:10.1021/la048178c (53) Edwards,W.;Lagadec,C.A.;Smith,D.K.Soft Matter2011,7(1),110.doi:10.1039/c0sm00843e (54) Zhao,C.;Wang,H.;Bai,B.;Qu,S.;Song,J.;Ran,X.;Zhang,Y.;Li,M.New Journal of Chemistry2013,37(5),1454.doi:10.1039/c3nj40648b (55) Tong,C.;Fan,K.;Niu,L.;Li,J.;Guan,X.;Tao,N.;Shen,H.;Song,J.Soft Matter2014,10(5),767.doi:10.1039/c3sm52676c (56) Fan,K.;Niu,L.;Li,J.;Feng,R.;Qu,R.;Liu,T.;Song,J.Soft Matter2013,9(11),3057.doi:10.1039/c3sm27421g (57) Niu,L.;Song,J.;Li,J.;Tao,N.;Lu,M.;Fan,K.Soft Matter2013,9(32),7780.doi:10.1039/c3sm50814e (58) Wu,S.;Gao,J.;Emge,T.J.;Rogers,M.A.Soft Matter2013,9(25),5942.doi:10.1039/c3sm50936b (59) Gao,J.;Wu,S.;Rogers,M.A.J.Mater.Chem.2012,22(25),12651.doi:10.1039/c2jm32056h (60) Curcio,P.;Allix,F.;Pickaert,G.;Jamart-Grégoire,B.Chem.-Eur.J.2011,17(48),13603.doi:10.1002/chem.v17.48 (61) Hansen,C.M.Prog.Org.Coat.2004,51(1),77.doi:10.1016/j.porgcoat.2004.05.004 (62) Hansen,C.M.;Skaarup,K.J.Paint Technol.1967,39,511. (63) Gharagheizi,F.J.Appl.Polym.Sci.2007,103(1),31. (64)Raynal,M.;Bouteiller,L.Chem.Commun.2011,47(29),8271.doi:10.1039/c1cc13244j (65) Bonnet,J.;Suissa,G.;Raynal,M.;Bouteiller,L.Soft Matter2014,10(18),3154.doi:10.1039/c4sm00244j (66)Yan,N.;He,G.;Zhang,H.;Ding,L.;Fang,Y.Langmuir2010,26(8),5909.doi:10.1021/la903853u (67) Liu,J.W.;Ma,J.T.;Chen,C.F.Tetrahedron2011,67(1),85.doi:10.1016/j.tet.2010.11.027 (68) Trivedi,D.R.;Ballabh,A.;Dastidar,P.;Ganguly,B.Chem.-Eur.J.2004,10(21),5311. (69)Murata,K.;Aoki,M.;Suzuki,T.;Harada,T.;Kawabata,H.;Komori,T.;Ohseto,F.;Ueda,K.;Shinkai,S.J.Am.Chem.Soc.1994,116(15),6664.doi:10.1021/ja00094a023 (70) Mukkamala,R.;Weiss,R.G.Langmuir1996,12(6),1474.doi:10.1021/la950666k (71)Abbott,S.J.;Hansen,C.M.;Yamamoto,H.Hansen Solubility Parameters in Practice Software;eBook,datasets,http://www.hansen-solubility.com. (72)Yan,N.;Xu,Z.;Diehn,K.K.;Raghavan,S.R.;Fang,Y.;Weiss,R.G.J.Am.Chem.Soc.2013,135(24),8989.doi:10.1021/ja402560n (73)Diehn,K.K.;Oh,H.;Hashemipour,R.;Weiss,R.G.;Raghavan,S.R.Soft Matter2014,10(15),2632.doi:10.1039/c3sm52297k (74)Brandrup,J.;Immergut,E.H.;Grulke,E.A.Polymer Handbook,4th ed.;Wiley:New York,1999. (75) Stefanis,E.;Panayiotou,C.Int.J.Thermophys.2008,29(2),568.doi:10.1007/s10765-008-0415-z (76) Xu,H.;Song,J.;Tian,T.;Feng,R.Soft Matter2012,8(35),3478. (77)Wu,Y.;Wu,S.;Zou,G.;Zhang,Q.Soft Matter2011,7(19),9177.doi:10.1039/c1sm06240a (78) Aparicio,F.;Garcia,F.;Sanchez,L.Chem.-Eur.J.2013,19(9),3239.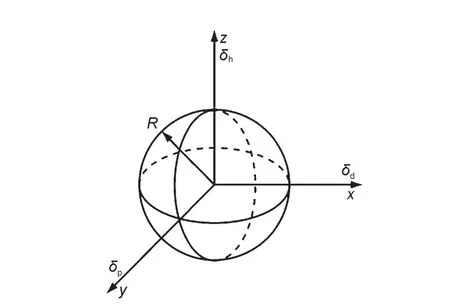

4.3 Teas图模型



5 结论

