泥鳅MSAP 技术反应体系的建立及优化
周贺,徐雯,李雅娟,秦艳杰,李霞,麻天宇,肖逸啸,马海艳
(大连海洋大学 辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁 大连116023)
表观遗传(Epigenetics)是指在基因的DNA序列未发生改变的情况下,基因功能发生可遗传的变化,并最终导致表型的变化[1]。DNA 甲基化(DNA methylation)作为表观遗传学研究的重要内容,是目前表观遗传学研究的热点之一。甲基化敏感扩增多态性(methylation sensitive amplification polymorphism,MSAP)技术,是一种简单、有效、可靠且能在全基因组水平检测胞嘧啶甲基化模式及其变化的方法[2],在生物的DNA 甲基化研究中应用广泛。
多倍化在许多植物和动物中普遍存在[3]。泥鳅Misgurnus anguillicaudatus 存在天然多倍体现象。研究发现,日本的泥鳅除了存在正常有性生殖二倍体外,还存在无性生殖二倍体和杂种生殖三倍体,但未发现天然四倍体[4-7]。中国的泥鳅存在二倍体、三倍体和四倍体3种不同倍性[8-11]。近年来,本研究室人员对中国特有的天然四倍体泥鳅的分布[11]、体细胞染色体核型分析[12]、染色体带型与FISH 研究[13]、减数分裂染色体行为[14]、泥鳅细胞培养及染色体标本制备[15]等方面进行了系统地研究。从细胞及分子遗传学角度证实了天然四倍体泥鳅是含有四套染色体组的同源四倍体,因此,泥鳅是探究同源多倍化机制的理想试材。已有研究证明,自然或人工合成的异源多倍体在其发生与形成后的稳定过程中都常常伴随着快速且有时在进化上保守的表观遗传变化,包括DNA 甲基化、组蛋白修饰、RNA 干扰等[16]。而且,表观遗传修饰在多倍体形成后的二倍化过程中也发挥了重要作用[17]。相对于动、植物异源多倍化现象,对同源多倍化过程中遗传及表观遗传变化特征的研究较少。本研究中,作者以泥鳅为研究对象,利用正交试验建立MSAP 方法的最佳反应体系,并利用该方法对二倍体泥鳅基因组DNA 进行MSAP 分析,旨在为探究同源四倍体泥鳅多倍化过程中基于DNA 甲基化的表观遗传变化特征,为鱼类同源多倍化机制的研究提供新线索。
1 材料与方法
1.1 材料
试验用二倍体泥鳅购自大连市农贸市场,暂养在辽宁省海洋生物资源恢复与生境修复重点实验室水族箱中,暂养温度为(22 ±1)℃。二倍体泥鳅的倍性经血红细胞核测量及流式细胞仪检测确定。
试验用主要试剂有限制性内切酶EcoR I、Hpa II、Msp I(Fermentas),Taq DNA 聚合酶(TaKaRa公司),氯仿-异戊醇(体积比为24∶1)、EDTA、Tris、尿素、TEMED[生工生物工程(上海)股份有限公司],引物、接头[生工生物工程(上海)股份有限公司]。
1.2 方法
1.2.1 基因组DNA 的提取 采用尿素法[18]提取基因组DNA,取适量鱼鳍经尿素缓冲液消化后,使用氯仿-异戊醇等抽提2次后,经100%(体积分数,下同)无水乙醇沉淀,再用70%无水乙醇清洗后获得DNA。
1.2.2 DNA 浓度与质量的检测 用Eppendorf D30核酸蛋白测定仪测定基因组DNA 的浓度并计算260 nm 与280 nm 处OD 值的比值,以确定DNA 的纯度;用8 g/L 琼脂糖凝胶电泳检测基因组DNA(180 V,电泳20 min)的质量。
1.2.3 MSAP 双酶切体系的优化 选取EcoR I/Hpa II和EcoR I/Msp I 两组内切酶分别对基因组DNA 进行酶切。20 μL 体系中包括:800 ng 基因组DNA,10 ×buffer Tango 缓冲液4 μL,EcoR I、Hpa II和Msp I 各10 U,混匀后用PCR 仪温育酶切,将酶切时间分别设定为4、6、8 h,完成后用10 g/L琼脂糖凝胶检测酶切产物的质量。
1.2.4 MSAP 连接体系 连接体系为30 μL,将接头等加入酶切液中,于22 ℃下连接2 h,接头在加入酶切液之前先合为双链。双酶切剩余量为17 μL,加入5 ×T4 buffer 6 μL,混匀后放入PCR 仪中进行连接,引物及接头设计参照曹哲明等[19]的方法,本试验中研究所用的接头、引物详见表1。
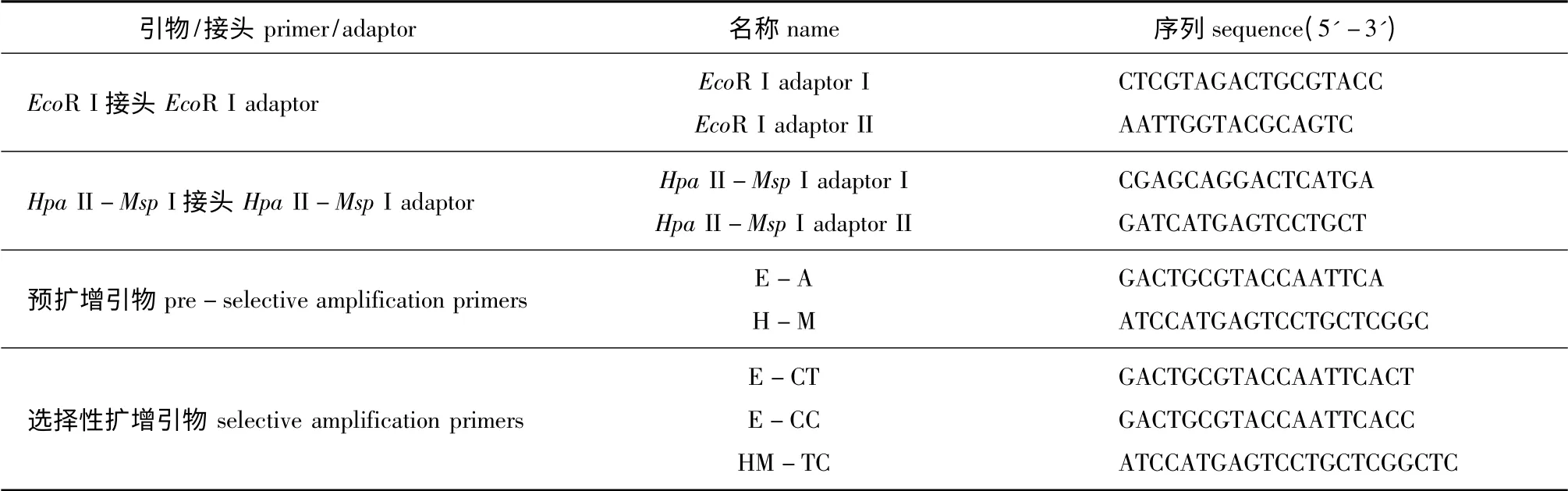
表1 接头和引物序列Tab.1 Sequences of adaptors and primers used for MSAP
1.2.5 MSAP 预扩增体系 采用E-A和H-M 引物组合(表1),反应总体积为20 μL。为了确定MSAP 预扩增体系中4 个因素(预扩模板、引物、dNTPs、Mg2+浓度)的最佳反应浓度,选用L9(34)正交表[20]进行4 因素3 水平的正交试验设计(表2)。引物浓度及PCR 反应程序参照秦艳杰[21]的方法。PCR 反应程序:94 ℃下预变性2 min;94 ℃下变性30 s,56 ℃下退火40 s,72 ℃下延伸60 s,共进行30 个循环;最后在72 ℃下再延伸5 min,4 ℃下保存。用琼脂糖凝胶电泳检测扩增产物的质量,将预扩增产物稀释20 倍后用作选择性扩增模板,剩余产物于冰箱(-20 ℃)中保存备用。试验重复2次。
1.2.6 选择性扩增体系 选择性扩增选取E -CC、HM-TC 引物组合(表1),反应总体积为20 μL。为了确定MSAP 选择性扩增体系中4 个因素(预扩模板、引物、dNTPs、Mg2+浓度)的最佳反应浓度,选用L9(34)正交表[20]进行4 因素3 水平的正交试验设计(表3)。引物浓度、模板稀释倍数和PCR 反应程序参照秦艳杰[21]的方法。PCR反应程序:94 ℃下预变性2 min;94 ℃下循环变性40 s,65 ~56 ℃(每循环下降0.7 ℃)下退火40 s,在72 ℃下延伸60 s,共进行12 个循环;94 ℃下循环变性40 s,56 ℃下退火40 s,72 ℃下延伸60 s,共进行30 个循环;最后在72 ℃下再延伸5 min,4℃下保存。
1.2.7 泥鳅基因组DNA 甲基化模式分析 选用E-CT/HM-TC和E-CC/HM -TC 两对选择性扩增引物(表1),分别对3 个二倍体泥鳅的基因组做MSAP 分析,选择性扩增产物变性后,用6%变性聚丙烯酰胺凝胶电泳检测,银染后获得图谱,分析其甲基化率。在MSAP 电泳图上,每个样品对应两个泳道,即H 泳道和M 泳道,H 泳道是指利用EcoR I/Hpa II 这组酶处理的样品,而M 泳道是指利用EcoR I/Msp I 这组酶处理的样品。每个样品的基因组甲基化主要分为:非甲基化,即条带在两个泳道同时出现;全甲基化,即条带在M 泳道出现而H 泳道缺失;半甲基化,即条带在H 泳道出现而M 泳道缺失,通过统计甲基化率来确定样品的甲基化程度。
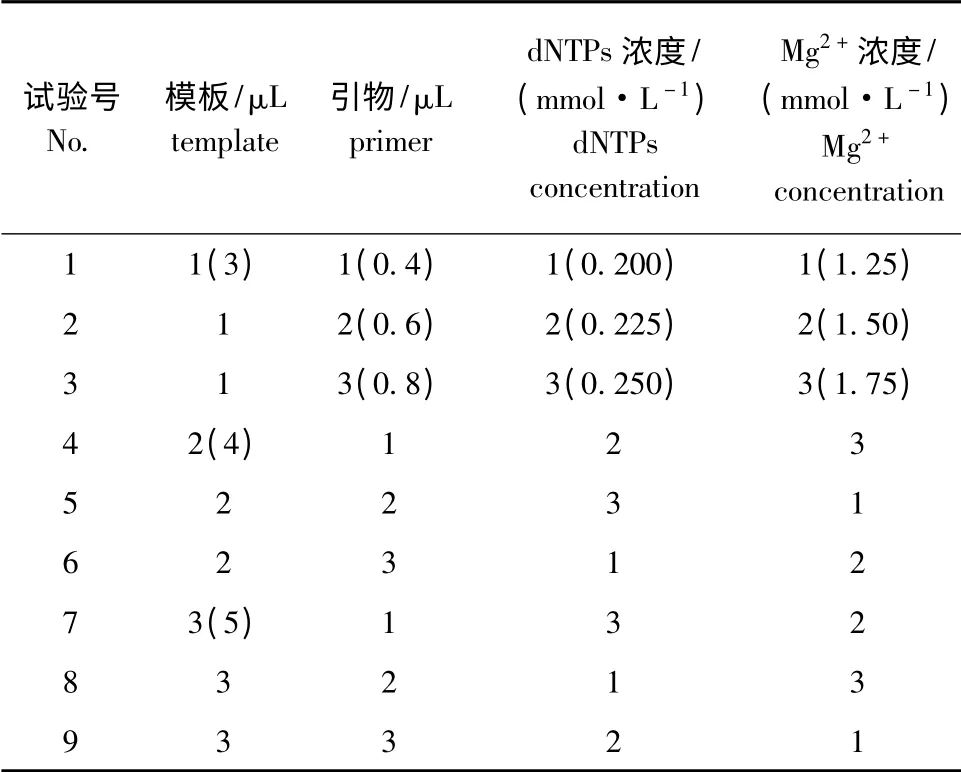
表2 预扩增反应体系各成分的因素-水平正交设计表Tab.2 Factors-levels of the components for pre-selective amplification orthogonal array

表3 选择性扩增反应体系各成分的因素-水平正交设计表Tab.3 Factors-levels of the components for selective amplification-orthogonal array
2 结果与分析
2.1 泥鳅基因组DNA 质量的检测
由于MSAP 方法对泥鳅基因DNA 的质量要求较高,因此,提取的泥鳅基因组DNA 条带清晰,带型完整,点样孔无残留,无RNA(图1)。使用Eppendorf D30 核酸蛋白测定仪测量DNA 浓度,OD260nm/OD280nm的值为1.8 ~2.0,表明该DNA 完全符合后续试验要求。
2.2 MSAP 双酶切体系
使用EcoR I/Hpa II和EcoR I/Msp I 两组限制性内切酶分别对基因组DNA 进行酶切,于37 ℃下分别保温4、6、8 h,用10 g/L 琼脂糖凝胶检测酶切产物。由图2可看出,酶切8 h 的产物相对酶切4、6 h 较完全,并呈弥散状态。后续试验也表明,酶切8 h 的产物符合后续试验要求。
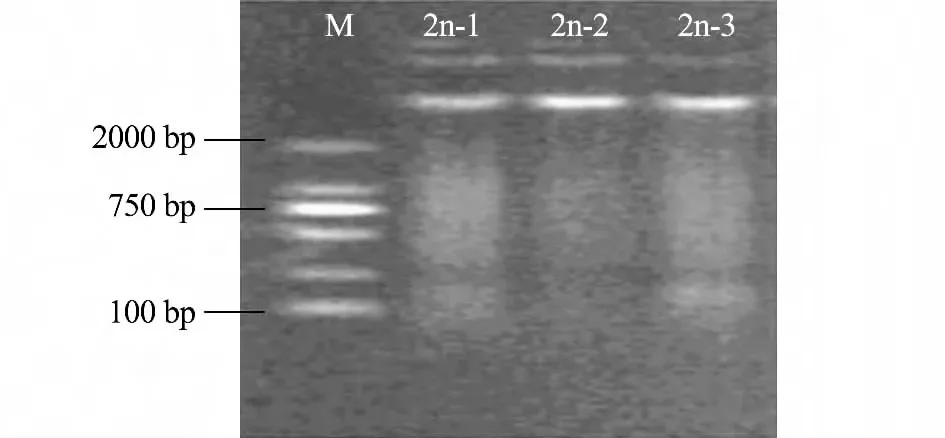
图1 基因组DNA 琼脂糖电泳结果Fig.1 Agarose gel electrophoresis of genomic DNA

图2 基因组DNA 双酶切的琼脂糖电泳结果Fig.2 Agarose gel electrophoresis of genomic DNA after double digestion
2.3 MSAP 预扩增
根据预扩增产物片段范围应集中在500 bp 左右且呈弥散状分布的原则,对电泳图中电泳条带的大小、强弱等进行直观分析。从图3可见,在不同的处理间由于预扩增模板、预扩引物、Mg2+、dNTPs 加入的量不同,扩增结果存在明显差异。其中,1、2、3、4、5、8 泳道条带较暗,扩增产物较低;7、9 泳道非特异性扩增较多;组合6 的扩增条带明显,且在200 ~700 bp 均匀弥散,在500 bp 左右最亮。因此,确定组合6 为最佳预扩增体系,即模板为4 μL、引物0.8 μL、0.2 mmol/L dNTPs、1.5 mmol/L Mg2+、Taq DNA 酶1 U。

图3 不同预扩增体系扩增产物的琼脂糖电泳结果Fig.3 Agarose gel electrophoresis of different products of apre-selective amplification
2.4 MSAP 选择性扩增
根据预试验结果初步筛选用E -CT/HM -TC引物进行选择性扩增。从图4可见,在这9 个正交组合中,1、2、3、4、7和8 泳道产生大量非特异性条带;第9 泳道相比于第6 泳道,有非特异性条带产生;第5 泳道相比于第6 泳道,亮度较暗,产物较低。因此,确定组合6 为最佳选择性扩增体系,即稀释20 倍的模板2 μL、引物1.5 μL、0.375 mmol/L dNTPs、1.5 mmol/L Mg2+、Taq DNA酶1 U。
2.5 最适MSAP 反应体系的验证与应用
为验证获得的最佳泥鳅MSAP 反应体系,选取3 个二倍体泥鳅鳍基因组DNA 样品在该反应体系下进行MSAP 分析。扩增产物变性后在6%变性聚丙烯酰胺凝胶上电泳,银染后获得了清晰、多态性好的指纹图谱(图5)。由表4 数据可算出:3 个样品 的 全 甲 基 化 率 分 别 为 24.1%、20.8%、22.3%,半 甲 基 化 率 分 别 41.4%、20.8%、33.3%,总甲基化率分别为65.5%、41.6%、55.6%;3 个样品的非甲基化率分别为34.5%、58.4%、44.4%。证明该体系能够应用于泥鳅基因组DNA 甲基化模式分析。
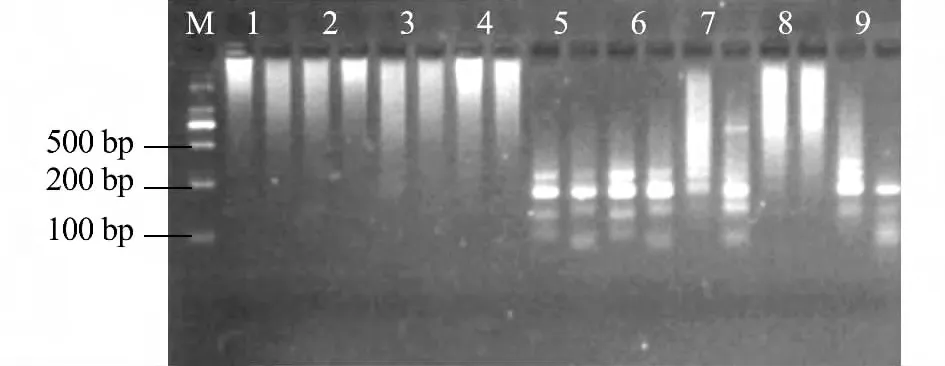
图4 不同选择性扩增体系扩增产物的琼脂糖电泳结果Fig.4 Agarose gel electrophoresis of different products of selective amplification
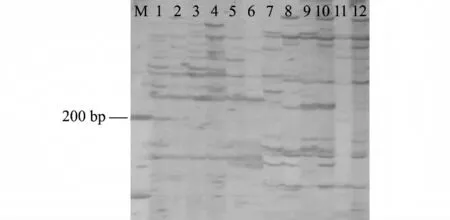
图5 E-CC/HM-TC 与E-CT/HM-TC 引物组合对3种DNA 选择性扩增产物的银染结果Fig.5 Silver staining of selective amplification products with E-CC/HM-TC and E-CT/HM-TC primer combination
3 讨论
20世纪以来,表观遗传学快速发展,已成为生物学、医学和农学等研究领域的前沿。DNA 甲基化是表观遗传修饰的主要方式之一。检测DNA 甲基化的方法有重亚硫酸法、高效液相色谱法(HPLC)、甲基化特异性PCR、基因芯片法、质谱或色谱法、甲基化敏感性扩增多态性(MSAP)和基因测序法等[22],其中MSAP 技术由于其具有简便、高效、重复性好、需样量小、多态性丰富等优点,已被广泛用于检测动、植物基因组胞嘧啶甲基化水平和模式的研究中[23-25]。近年来,在栉孔扇贝Chlamys farreri[26]、海 湾 扇 贝Argopecten irradians[26-27]、虾夷 扇 贝Patinopecten yessoensis[26]、草鱼Ctenopharyngodon idellus[19]、刺参Apostichopus japonicas[28]、中国明对虾Fenneropenaeus chinensis[29]等多种水产动物的基因组甲基化研究中已得到应用。

表4 二倍体泥鳅基因组DNA 的甲基化水平Tab.4 Genomic DNA methylation levels of diploid loach
MSAP是基于AFLP 的改良技术,涉及DNA 提取、酶切、扩增、产物电泳检测等多个环节。在影响MSAP 分析的各个因素中,基因组DNA 的酶切产物质量是决定MSAP 成功的关键。酶切时间过短,酶切不完全,扩增中往往出现高分子量的片段,不能真实反映基因组甲基化信息;酶切时间过长,可能会导致酶对DNA 的非特异性切割,影响试验的准确性。因此,适当的酶切时间是保证MSAP 试验结果准确的前提。为了使模板DNA 得到充分酶切,一般会加大酶的使用量,但加大酶量将增加试验成本。因此,本研究中重点优化了内切酶的酶切时间,结果表明,酶切时间为8 h,酶切反应充分,避免出现大分子量片段多而密的情况,获得了清晰可辨的多态性条带,便于数据统计。
预扩增和选择性扩增也是影响MSAP 的关键步骤。扩增的结果是由扩增反应中各个因素综合作用的结果,多数学者认为,引物用量、模板用量、Mg2+浓度、dNTPs 浓度是影响扩增结果的主要因素。因为引物用量过低,则产物的量明显较低,相反,则会产生非特异性条带;模板量过低,则条带较暗,产物量较低;Mg2+浓度对扩增的结果影响也较大,这在选择性扩增中表现的最为明显,Mg2+过量易产生大量非特异性条带,相反,不足则易使产量降低;dNTPs可以为反应提供能量,dNTPs 浓度过低会降低产物的产量,而且dNTPs 浓度与Mg2+浓度要相适应,否则会直接影响PCR 结果。因此,本试验中着重对泥鳅MSAP 反应体系中预扩增和选择性扩增进行优化。结果表明:预扩增最佳反应体系为模板4 μL、引物0.8 μL、0.2 mmol/L dNTPs、1.5 mmol/L Mg2+;选择性扩增最佳反应体系为稀释20 倍的模板2 μL、引物1.5 μL、0.375 mmol/L dNTPs、1.5 mmol/L Mg2+。本试验结果与多数研究报道一致[30-32]。用该体系对泥鳅全基因组DNA 进行甲基化水平和模式分析,经统计分析表明,3 个二倍体泥鳅个体之间的甲基化程度存在差异,其原因有待于进一步研究。
综上所述,通过本试验优化后得到了稳定、重复性好的MSAP 体系,为今后探究同源四倍体泥鳅多倍化过程中基于DNA 甲基化的表观遗传变化特征奠定了基础。
[1]Jablonka E,Lamb M J.The changing concept of epigenetics[J].Annals of the New York Academy of Sciences,2002,981:82 -96.
[2]Xu M L,Li X Q,Korban S S.AFLP-based detection of DNA methylation[J].Plant Molecular Biology Reporter,2000,18:361-368.
[3]李智慧,逯翔,高云,等.物种多倍化与表观遗传学[J].科学通报,2010,55(35):3358 -3366.
[4]Morishima K,Horie S,Yamaha E,et al.A cryptic clonal line of the loach Misgurnus anguillicaudatus(Teleostei:Cobitidae)evidenced by induced gynogenesis,interspecific hybridization,microsatellite genotyping and multilocus DNA fingerprinting[J].Zoological Science,2002,19:565 -575.
[5]Arai K,Matsubara K,Suzuki R.Karyotype and erythrocyte size of spontaneous tetraploidy and triploidy in the loach Misgurnus anguillicaudatus[J].Nippon Suisan Gakkaishi,1991,57:2167 -2172.
[6]Zhang Quanqi,Arai K.Distribution and reproductive capacity of natural triploid individuals and occurrence of unreduced eggs as a cause of polyploidization in the loach,Misgurnus anguillicaudatus[J].Ichthyological Research,1999,46:153 -161.
[7]糸納正樹,荒井克俊.北海道蓴菜沼産ドジョウにおける非還元二倍性卵の形成[J].水産育種,2004,33:107 -113.
[8]李康,李渝成,周暾.两种泥鳅染色体组型的比较研究[J].动物学研究,1983,4(1):75 -80.
[9]李渝成,李康.马口鱼和泥鳅的核型研究,兼论鱼类染色体数目多态与分类的关系[J].武汉大学学报:自然科学版,1987,1:107 -111.
[10]印杰,赵振山,陈小奇,等.二倍体和四倍体泥鳅染色体组型比较[J].水生生物学报,2005,29(4):469 -472.
[11]李雅娟,印傑,王嘉博,等.中国におけるドジョウ倍数体の分布に関する研究[J].日本水産学会誌,2008,74(2):177 -182.
[12]李雅娟,田萍萍,李莹,等.中国洪湖不同倍性泥鳅的染色体组型及形态特征比较分析[J].大连水产学院学报,2009,24(3):236 -241.
[13]Li Y J,Tian Y,Zhang M Z,et al.Chromosome banding and FISH with rDNA probe in the diploid and tetraploid loach Misgurnus anguillicaudatus[J].Ichthyological Research,2010,57(4):358 -366.
[14]Li Y J,Yu Z,Zhang M Z,et al.The origin of natural tetraploid loach Misgurnus anguillicaudatus(Teleostei:Cobitidae)inferred from meiotic chromosome configurations[J].Genetica,2011,139:805 -811.
[15]刘博,李雅娟,李霞,等.不同倍性泥鳅鳍细胞培养及染色体标本制备方法的研究[J].大连海洋大学学报,2013,28(6):557 -562.
[16]Liu B,Wendel J F.Epigenetic phenomena and the evolution of plant allopolyploids[J].Molecular Phylogenetics and Evolution,2003,29:365 -379.
[17]Ma X F,Gustafson J P.Genome evolution of allopolyploids:a process of cytological and genetic diploidization[J].Cytogenetic and Genome Research,2005,109(1/3):236 -249.
[18]Fujikawa N,Nakayama I,Onozato H.Genetic inactivation of crucian carp eggs using a simple X -ray irradiation apparatus[J].Bull Natl Res Inst Aquaculture,1993,22:11 -19.
[19]曹哲明,丁炜东,俞菊华,等.草鱼全同胞鱼苗不同个体甲基化位点的差异[J].动物学报,2007,53(6):1083 -1088.
[20]潘承毅,何迎晖.数理统计的原理与方法[M].上海:同济大学出版社,1993:292 -293.
[21]秦艳杰.海湾扇贝遗传图谱构建及壳色基因、生长相关QTL的定位研究[D].青岛:中国科学院研究生院(海洋研究所),2006:42 -44.
[22]Dahl C,Guldberg P.DNA methylation analysis techniques[J].Biogerontology,2003,4(4):233 -250.
[23]Cervera M T,Ruiz-García L,Martínez-Zapater J M.Analysis of DNA methylation in Arabiodopsis thaliana based on methylationsensitive AFLP markers[J].Molecular Genetics and Genomics,2002,268(4):543 -552.
[24]万亚琴.DNA 甲基化与肉牛杂种优势关系的初步研究[D].重庆:西南大学,2008:30 -35.
[25]蒋曹德.猪DNA 甲基化与杂种表现的关系及遗传多样性分析[D].武汉:华中农业大学,2004:64 -66.
[26]于涛,杨爱国,吴彪,等.栉孔扇贝、虾夷扇贝及其杂交子代的MSAP 分析[J].水产学报,2010,34(9):1335 -1341.
[27]吕佳,侯睿,李宁,等.应用MSAP 技术研究扇贝全基因组DNA 甲基化水平[J].中国海洋大学学报,2013,43(10):48-53.
[28]郭婷婷,孙国华,杨建敏,等.刺参(Apostichopus japonicus)不同组织基因组甲基化状态MSAP 分析[J].海洋与湖沼,2013,44(1):77 -82.
[29]杜盈,何玉英,李健,等.野生和“黄海1 号”中国明对虾不同组织基因组DNA 的MSAP 分析[J].中国水产科学,2013,20(3):536 -543.
[30]高寰,张铮,周婷,等.三叶木通MSAP 反应体系的优化及引物筛选[J].中草药,2012,43(3):572 -576.
[31]吕晓婷,赵春梅,王爱华,等.苹果MSAP 技术体系的优化及其应用[J].中国农学通报,2012,28(22):287 -292.
[32]曹喜兵,赵改丽,范国强.泡桐MSAP 体系建立及引物筛选[J].河南农业大学学报,2012,46(5):535 -541.

