原位微波消融术治疗骨转移癌
李远 马珂 刘文生 单华超 牛晓辉
原位微波消融术治疗骨转移癌
李远 马珂 刘文生 单华超 牛晓辉
目的探讨原位微波消融术在骨转移癌治疗中的安全性和有效性。方法2009 年 9 月至 2013年 2 月,我科收治的骨转移癌 40 例,共 43 处接受原位微波消融术治疗。其中男 23 例、女 17 例,平均年龄55.9 ( 21~83 ) 岁。单发骨转移 16 例,多发转移 24 例。肺癌 14 例,肝癌 5 例,肾癌 6 例,乳腺癌 2 例,子宫内膜癌 3 例,甲状腺癌 2 例,宫颈癌、食道癌各 1 例,原发不明 6 例。手术部位:骨盆 16 处,股骨 13 处,胫骨 7 处,肱骨 6 处,肩胛骨 1 处。病理骨折 11 例,均为肢体长骨病理骨折。43 处中 42 处行原位微波消融后刮除手术,1 处肩胛骨转移微波消融后行边缘切除;2 处未进行重建,5 处单纯使用骨水泥重建,其余 36处行骨水泥填充加金属内固定物重建。术后每 3 个月一次随访,并对术后患者的生存率、局部复发率、围手术期并发症、VAS 评分及功能评分进行评价。采用 Kaplan-Meier 方法和 Log-Rank 实验对比进行生存分析,分别在术前、术后 1 周、术后 3 个月用 VAS 法进行疼痛评分,采用 MSTS 保肢评分系统对术后随访超过 3 个月的患者进行功能评分。结果40 例均获随访,平均随访 12.9 ( 3~41 ) 个月,中位随访时间 10.4 个月。随访期间死亡 17 例,存活 23 例。总体 6 个月生存率 89.6%,1 年生存率 83.8%,2 年生存率 60.9%。17 例死亡患者术后存活平均 9.5 ( 2~22 ) 个月。是否发生病理骨折对生存率有显著影响 ( χ2=11.662,P=0.001 ),无病理骨折患者 1 年生存率 80.8%,有病理骨折患者 1 年生存率 29.2%。局部复发率 11.6% ( 5 / 43 ),复发时间术后 16.4 ( 5~35 ) 个月。围手术期并发症发生率 4.7%,未出现内固定失效、病理骨折等其它并发症。术前 VAS评分,平均 7.8 ( 5~9 ) 分。术后 1 周评分,平均 3.0 ( 1~5 ) 分。术后 3 个月评分,平均 2.6 ( 1~6 ) 分。术后1 周、3 个月分别与术前相比,疼痛程度明显减轻,且差异有统计学意义 ( t=22.889,P=0.000 和 t=22.934,P=0.000 )。参与功能评分 41 处,平均 22 ( 10~28 ) 分。其中优 68% ( 28 / 41 ),良 17% ( 7 / 41 ),中 10% ( 4 / 41 ),差 5% ( 2 / 41 ),最终优良率 85%。结论原位微波消融术治疗骨转移癌是一种安全有效的方法,对局部病灶可以缓解疼痛,控制肿瘤进展。
导管消融术;骨肿瘤;肿瘤转移;微波
随着人类平均寿命延长,恶性肿瘤对人类的威胁日显突出。几乎每种恶性肿瘤均可发生骨转移,据统计,约 50% 的原发癌有转移至骨骼的趋势,骨骼是继肺和肝脏之后第三常见的转移部位[1]。对已经发生病理骨折和有可能发生病理性骨折的高危骨转移癌患者,进行手术治疗,可以使患者获得迅速坚强固定,使患者能在术后早期负重,从而改善生活质量。本研究对微波消融技术姑息性治疗骨转移癌进行回顾分析,探讨该技术治疗中的适应证、并发症,并评估术后治疗效果,从而评价其在骨转移癌治疗中的安全性和有效性。
资料与方法
一、临床资料
2009 年 9 月至 2012 年 2 月,我科使用原位微波消融技术治疗骨转移癌 40 例,其中男 23 例,女 17 例,平均年龄 55.9 ( 21~83 ) 岁。所有患者入院后行 X 线片、CT、MRI、肺 CT 及全身骨扫描等常规影像学检查,部分患者行 PET-CT 检查。入选标准:( 1 ) 有恶性肿瘤病史,骨病灶经 X 线片、MRI、CT 或 PET-CT 诊断为恶性肿瘤骨转移;或者无恶性肿瘤病史,骨病灶活检或细胞学诊断为恶性肿瘤骨转移。( 2 ) 预期存活 3 个月以上。( 3 ) 全身状况可,可以接受手术及麻醉。( 4 ) 已经发生病理骨折或有潜在病理骨折风险患者 ( Mirels 评分>8 )。 ( 5 ) 不能进行广泛切除或广泛切除后对功能影响大需要漫长恢复期者。其中单发骨转移 16 例,多发转移 24 例。按照原发病灶分类:肺癌 14 例,肝癌5 例,肾癌 6 例,乳腺癌 2 例,甲状腺癌 2 例、子宫内膜癌 3 例,宫颈癌、食道癌各 1 例,原发不明6 例。病理骨折 11 例,均为肢体长骨病理骨折。1 例行 2 处手术,1 例行 3 处,其它病例各 1 处,共43 处病灶行原位微波消融手术治疗。手术部位:骨盆 16 处,股骨 13 处,胫骨 7 处,肱骨 6 处,肩胛骨 1 处。
二、手术方法
术前经影像学确定肿瘤累及范围,包括骨内受累范围及软组织受累范围,确定术中消融范围及刮除范围。40 例共 43 处行手术治疗,其中 42 处行原位微波消融后刮除手术,1 处肩胛骨转移微波消融后行边缘切除;2 处未进行重建,5 处单纯使用骨水泥重建,其余 36 处行骨水泥填充加金属内固定物重建。
术中根据不同部位肿瘤,按照常规手术切口切开,在病灶外正常组织中分离,游离并保护病灶周围重要血管神经,按术前设计将要进行射频消融部位完全游离,用湿沙布将正常组织与手术部分隔离。根据设计消融范围大小,均匀置入微波天线( 南京亿高微波系统工程有限公司 ECO-100A 型冷循环微波刀 ),以 70 W 功率消融。设置测温针,维持病灶内温度至少 60 ℃,持续 15~20 min。在病灶外设置测温针,保持正常组织温度低于 40 ℃。如果外围温度升高,可用冷生理盐水冲洗降温。完成消融后彻底刮除骨外软组织内肿瘤及髓腔内肿瘤,并用高速磨钻打磨皮质骨,保留较完整的皮质骨。用蒸馏水及盐水反复冲洗后,用骨水泥填充骨内缺损部位,钢板或髓内针固定。放置引流管,关闭伤口(图1 )。
维持术后引流,至每日引流<50 ml 后拔除。因术中行坚强内固定,术后患肢早期开始功能锻炼。
术后随访均由本院高年资医师负责,系统规范记录于科室数据库。复查方法:术后每 3 个月随访一次,行手术局部 X 线、B 超检查。并对术后患者的生存率、局部复发率、围手术期并发症、VAS 评分及功能评分进行评价。
三、评价及统计学方法
1. 对本组患者的生存分析用 Kaplan-Meier 方法和 Log-Rank 实验对比进行。
2. 分别在术前、术后 1 周、术后 3 个月进行疼痛评分,分值用成组资料的配对 t 检验。
3. 对术后随访超过 3 个月患者,采用 MSTS 保肢评分系统进行功能评价[2],取得随访期内最佳评分。并根据 Manfrini 等对术后功能评价方式,将MSTS 评分 25.1~30.0 分设定为优,20.1~25.0 分为良,16.1~20.0 分为中,≤16 分为差[3]。
4. 使用 Spss13.0 软件包进行统计分析。
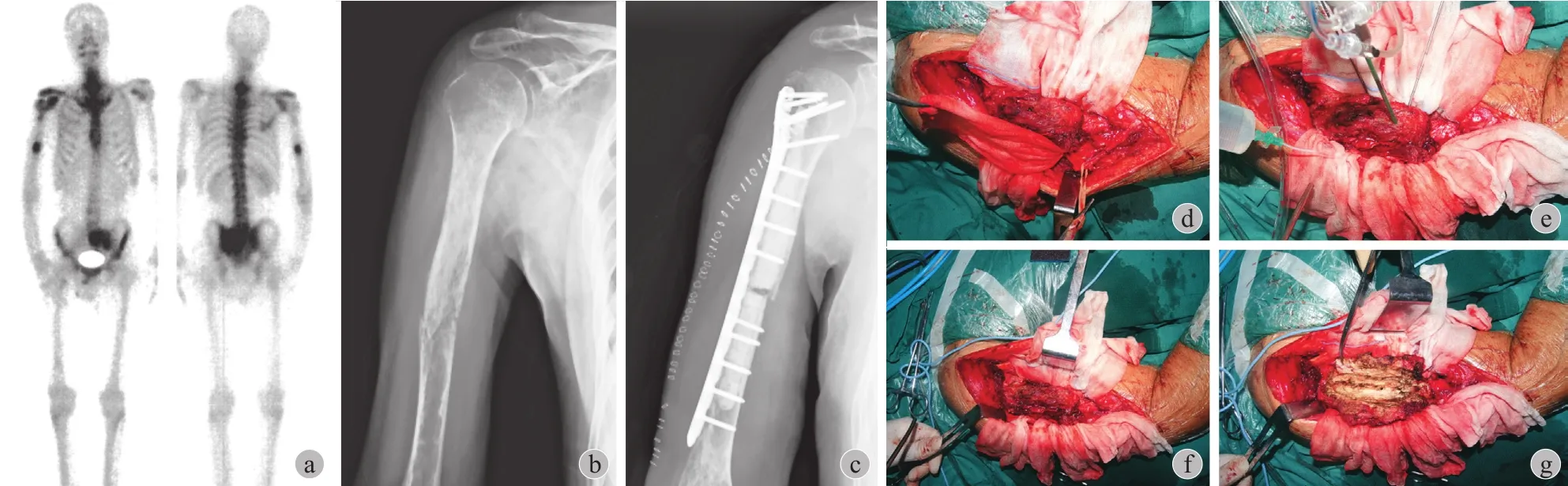
图 1 a:患者,男,53 岁,穿刺病理报告:骨转移癌。ECT 示右肱骨、胸椎、骶髂关节多处转移;b:X 线显示肱骨干病理骨折;c:术后 X 线显示病灶刮除后用骨水泥填充,并用钢板内固定;d:根据术前影像学定位,术中先游离要进行微波消融部位,并用湿盐水纱布将其与周围正常组织隔开;e:进行微波消融,在病灶内及病灶外分别设置测温针,保证病灶内温度 60 ℃ 以上,周围组织温度 40 ℃以下。周围组织降温可用冷生理盐水冲洗进行;f:微波消融 20 min 后,肿瘤组织凝固坏死,外表颜色黑褐色;g:刮除肿瘤组织,可见肿瘤组织坏死无出血Fig.1 a: The biopsy report of a 53-year-old male showed bone metastases. The Emission Computed Tomography ( ECT ) showed that multiple metastases in the right humerus, thoracic vertebrae and sacroiliac joint; b: The X-ray showed pathologic fracture in the humeral diaphysis; C: The postoperative X-ray showed that the cavity was flled with polymethylmethacrylate ( PMMA ) after the fracture was fxed with the plate; d: Based on the preoperative imaging investigation, the site of microwave ablation was dissociated, and the normal tissues around were separated by wet saline gauze; e: Microwave ablation was performed. The thermometers were placed inside and outside the target to ensure the temperature was above 60 ℃ inside the target and below 40 ℃ outside the target at the same time. The cold saline was irrigated in order to lower the temperature of the normal tissues around; f: After 20 minutes of microwave ablation, the tumor tissues were coagulated and necrosis. The color turned dark brown; g: Curettage of the tumor tissues was performed, which were necrotic without bleeding
结 果
40 例随访 3~41 个月,平均 12.9 个月,中位随访时间 10.4 个月。随访期间死亡 17 例,存活23 例。总体 6 个月生存率 89.6%,1 年生存率83.8%,2 年生存率 60.9% ( 图2 )。死亡的 17 例术后存活平均 9.5 ( 2~22 ) 个月。经 Log-Rank 检验,转移部位、原发疾病种类、单发转移或多发转移等对生存率均无影响 ( P>0.05 ),是否发生病理骨折对生存率有明显影响 ( χ2=11.662,P=0.001 ) ( 表1 )。无病理骨折患者 1 年生存率 80.8%,有病理骨折患者1 年生存率 29.2% ( 图3 )。
43 处随访期内局部复发率 11.6% ( 5 / 43 ),术后复发时间平均 16.4 ( 5~35 ) 个月。与我科曾发表的单纯刮除治疗骨转移癌的局部复发率 27.8% ( 10 / 36 ) 相比,尽管两组复发率差异无统计学意义( χ2=3.322,P=0.062 ),但原位微波消融术后局部复发率仍较低[4]。
2 例出现围手术期并发症 ( 4.7% ):1 例甲状腺癌髂骨转移者术后 1.5 个月出现深部感染,行清创手术,清除伤口内坏死组织,去除重建用的骨水泥及螺钉,重新使用抗生素骨水泥填充后伤口愈合;另 1 例肝癌耻骨转移患者,术后出现切口皮缘坏死,予清创,切除坏死皮缘,重新缝合后愈合。除复发和感染外,随访期内手术部位未出现内固定失效、病理骨折等其它并发症。

表1 各种因素对骨转移癌患者生存率的影响Tab.1 The effects of various factors on the survival rate of the patients with bone metastases
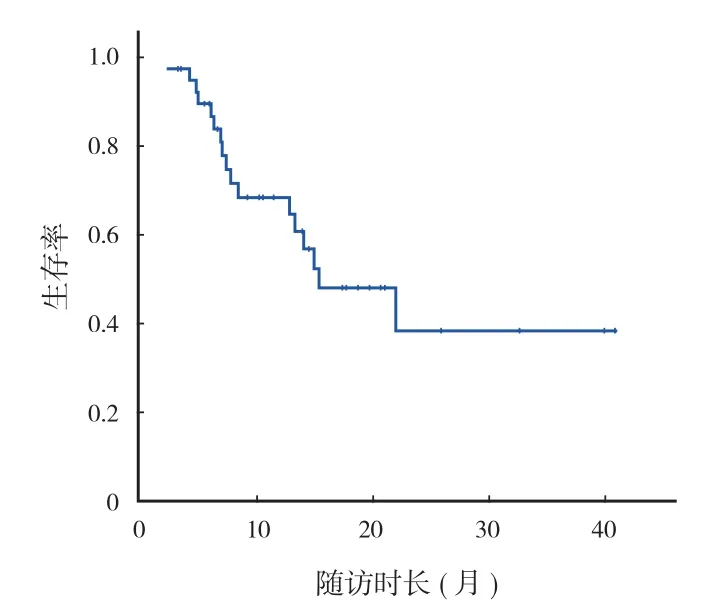
图 2 总体生存率曲线Fig.2 Overall survival curve
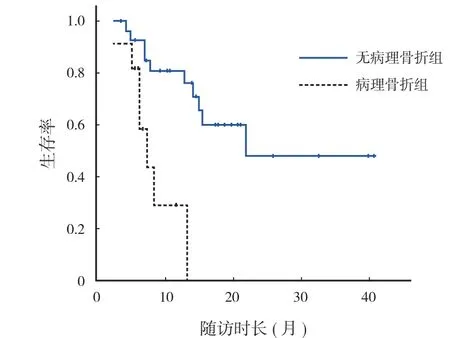
图 3 有、无病理骨折两组的不同生存曲线,两组差异有统计学意义Fig.3 Survival curves of the patients with or without pathologic fractures, and statistically signifcant differences existed between the 2 groups ( P=0.001 )
43 处术前 VAS 评分,平均 7.8 ( 5~9 ) 分。术后1 周评分,平均 3.0 ( 1~5 ) 分。术后 3 个月评分,平均 2.6 ( 1~6 ) 分。术后 1 周、3 个月分别与术前相比,疼痛程度明显减轻,且差异均有统计学意义( t=22.889,P=0.000;t=22.934,P=0.000 )。
参与功能评分的病灶有 41 处,平均评分 22 ( 10~28 ) 分。其中优 68% ( 28 / 41 ),良 17% ( 7 / 41 ),可 10% ( 4 / 41 ),差 5% ( 2 / 41 ),最终优良率85%。
讨 论
骨转移癌是最常见的骨肿瘤,其发生率是原发骨肿瘤的 20 倍。近年来随着部分肿瘤患者疗效的改善,其骨转移发生率亦有升高趋势。骨转移癌患者可出现疼痛、病理性骨折、脊髓压迫、高钙血症等一系列症状,严重影响到患者的生活质量。尽管骨转移是肿瘤晚期表现,大多数骨转移癌患者最终死于原发疾病,但随着生活水平的提高和医疗观念的更新,应认识到骨转移癌并不都是癌症患者的终末期,恰当地治疗可以缓解疼痛、提高生存质量,甚至可以延长生存期[5]。
对于骨转移癌患者的治疗包括非手术治疗及手术治疗。前者包括放疗、化疗、核素疗法、麻醉止痛药物疗法、内分泌疗法等;而手术治疗按照Enneking 手术切除边界的原则分为彻底性切除或姑息性切除两类[6]。第一类整块切除:对于原发肿瘤治愈率高,全身状况好,存活期较长的乳癌、肾癌等,经全身检查证实为单发骨转移癌病灶,可行边缘性或广泛性切除,并重建患者肢体功能,给予患者彻底治疗的机会。另一类姑息性切除:对于肿瘤预后差,生命器官转移,多处转移,彻底切除肿瘤后恢复期极长者,可行囊内切除或单纯固定病理骨折,从而起到缓解疼痛、减少并发症、改善生活质量的作用。本组病例均为经临床检查适行姑息性手术患者,仅 1 例肩胛骨转移患者行微波消融后边缘切除手术。
微波消融是利用频率 2450 MHz 的电磁波,使作用范围内的水分子和其它带电离子发生震动,产生高温的技术。肿瘤组织中含有较多的液体,可以在短时间内被加热到 60 ℃~100 ℃,而造成肿瘤细胞凝固坏死。手术中在刮除肿瘤前进行原位微波消融,可以将皮质骨内的肿瘤组织杀灭。在尽量保留骨结构的情况下,减少复发风险。按照 Enneking 手术切除方式描述,囊内切除恶性肿瘤,复发率几乎为 100%[6];在以往的报道中,骨转移癌刮除治疗后出现复发比例也在 26%~67%[4,7]。Pusceddu 报道[8],经微波消融治疗骨转移癌的局部复发率明显降低,仅 6%。本组病例经过原位微波消融再进行刮除手术,复发率为 11.6%,也低于单纯手术刮除病例。
不同作者对采用人工关节置换,还是采用病灶刮除内固定方式治疗骨转移癌仍有不同观点。多位作者报道了关节置换、刮除等不同手术方式治疗骨转移癌的结果,其 1 年生存率 17%~70%[9-12],并且患者的生存率与原发肿瘤类型相关,而与所接受的手术方式无关。但对于预期生存期较短的骨转移癌患者,简单的手术方式意味着发生并发症的风险更小。在本组病例中围手术期并发症仅为 4% ( 2 / 46 ),而随访期内也无内固定失效等并发症,因此,本研究所采用的原位微波消融后病灶刮除内固定手术,在手术相关并发症方面可能优于人工关节置换。
围手术期出现神经血管热损伤,术后周围组织坏死、深部感染、愈合不良等是微波消融术应用于骨肿瘤的常见并发症。为此我们采取以下措施进行预防:首先应熟悉血管神经解剖,术前根据影像学确认血管神经受压迫程度,术中仔细操作,将血管神经适当游离,用湿纱布保护,避免其损伤。在处理肿瘤前充分暴露需要微波消融部分,将其与周围正常组织用湿纱布分隔开,避免周围组织在消融时受到热损伤,并可在消融的同时用冷盐水冲洗纱布,使周围组织降温。消融后充分刮除消融部位髓内及骨外软组织肿瘤,仅保留骨皮质,减少坏死组织造成的感染及延迟愈合。本组病例仅出现 2 例围手术期并发症,经过对症治疗后痊愈。
内固定失败是采用肿瘤刮除内固定治疗骨转移癌常见的远期并发症。Wedin 等[13]报道了 16.2% 内固定失败率,Yazawa 等[14]也报道了 10% 内固定失败率。本组病例随访期间均未出现内固定失败,可能与我们在手术中刮除肿瘤组织后,骨缺损部位用骨水泥填充,再行坚强固定有关。
术中使用微波消融技术还可以减少术中出血。转移癌组织内有大量新生肿瘤性血管,直接刮除出血多。在手术中充分显露肿瘤组织,在刮除前先进行微波消融,局部组织凝固性坏死,甚至焦化,可以封闭血管断端,减少出血,使手术操作更从容,提高手术安全性和彻底性,同时也可以提高患者的耐受性。术后患者疼痛症状明显减轻,术后功能也得到良好恢复,肢体功能优良率达到 85%,其远期效果令人满意。
综上所述,原位微波消融术治疗骨转移癌的生存率高、局部复发率低、并发症少,是治疗骨转移癌安全、有效的方法。它可以使局部病灶缓解疼痛,控制肿瘤进展,恢复患者肢体功能,改善生活治疗。
[1] Hage WD, Aboulafia AJ, Aboulafia DM. Incidence, location, and diagnostic evaluation of metastatic bone disease. Orthop Clin North Am, 2000, 31(4):515-528.
[2] Enneking WF, Dunham W, Gebhardt MC, et al. A system for the functional evaluation of reconstructive procedures after surgical treatment of tumors of themusculoskeletal system. Clin Orthop Relat Res, 1993, (286):241-246.
[3] Manfrini M, Tiwari A, Ham J, et al. Evolution of surgical treatment for sarcomas of proximal humerus in children: retrospective review at a singleinstitute over 30 years. J Pediatr Orthop, 2011, 31(1):56-64.
[5] Riccio AI, Wodajo FM, Malawer M. Metastatic carcinoma of the long bones. Am Fam Physician, 2007, 76(10):1489-1494.
[6] Enneking WF. A system of staging musculoskeletal neoplasms. Clin Orthop Relat Res, 1986, (204):9-24.
[7] Ruggieri P, Mavrogenis AF, Angelini A, et al. Metastases of the pelvis: does resection improve survival? Orthopedics, 2011, 34(7):e236-244.
[8] Pusceddu C, Sotgia B, Fele RM, et al. Treatment of bone metastases with microwave thermal ablation. J Vasc Interv Radiol, 2013, 24(2):229-233.
[9] Hansen BH, Keller J, Laitinen M, et al. The scandinavian sarcoma group skeletal metastasis register. Survival after surgery for bone metastases in thepelvis and extremities. Acta Orthop Scand Suppl, 2004, 75(311):11-15.
[10] Camnasio F, Scotti C, Peretti GM, et al. Prosthetic joint replacement for long bone metastases: analysis of 154 cases. Arch Orthop Trauma Surg, 2008, 128(8):787-793.
[11] Sarahrudi K, Greitbauer M, Platzer P, et al. Surgical treatment of metastatic fractures of the femur: a retrospective analysis of 142 patients. J Trauma, 2009, 66(4):1158-1163.
[12] Harvey N, Ahlmann ER, Allison DC. Endoprostheses last longer than intramedullary devices in proximal femur metastases. Clin Orthop Relat Res, 2012, 470(3):684-691.
[13] Wedin R, Bauer HC. Surgical treatment of skeletal metastatic lesions of the proximal femur: endoprosthesis or reconstruction nail? J Bone Joint Surg Br, 2005, 87(12):1653-1657.
[14] Yazawa Y, Frassica FJ, Chao EY, et al. Metastatic bone disease. A study of the surgical treatment of 166 pathologic humeral and femoral fractures. Clin Orthop Relat Res, 1990, (251): 213-219.
( 本文编辑:代琴 )
In situ microwave ablation for bone metastases
LI Yuan, MA Ke, LIU Wen-sheng, SHAN Hua-chao, NIU Xiao-hui. Department of Orthopaedic Oncology, Beijing Jishuitan Hospital, Beijing, 100035, PRC
ObjectiveTo investigate the safety and effectiveness of in situ microwave ablation in the treatment of bone metastases.MethodsFrom September 2009 to February 2013, 40 patients with bone metastases were adopted, who all underwent in situ microwave ablation with 43 lesions involved. There were 23 males and 17 females, whose average age was 55.9 years old ( range; 21-83 years ). Solitary bone metastases were found in 16 cases and multiple metastases in 24 cases. There were 14 cases of lung cancer, 5 cases of liver cancer, 6 cases of renal carcinoma, 2 cases of breast cancer, 3 cases of endometrial carcinoma, 2 cases of thyroid carcinoma, 1 case of cervical carcinoma, 1 case of esophageal carcinoma and 6 cases of carcinoma of unknown primary. The operative sites included the pelvis ( n=16 ), the femur ( n=13 ), the tibia ( n=7 ), the humerus ( n=6 ) and the scapula ( n=1 ), and there were 11 case of long bone pathologic fractures of the extremities. Curettage after in situ microwave ablation was performed on 42 of the 43 lesions. Marginal resection after microwave ablation was performed on the patient with bone metastases in the scapula. No reconstruction was carried out in 2 lesions, and reconstruction of bone cement alone in 5 lesions. Bone cement flling and reconstruction with metal implants were carried out in the other 36 lesions. All the patients were followed up once every 3 months. The evaluation indicators included the postoperative survival rate, local recurrence rate, perioperative complications, Visual Analogue Scale ( VAS ) score and functional score. The Kaplan-Meier method and log-rank test were used to analyze the survival rate. The VAS pain scores were recordedpreoperatively and at 1 week and 3 months after the operation. The Musculoskeletal Tumor Society ( MSTS ) staging system was used to evaluate the function of the patients who were followed up for more than 3 months.ResultsAll the 40 patients were followed up for a mean period of 12.9 months ( range; 3-41 months ), and the median follow-up period was 10.4 months. During the follow-up, 17 patients died and 23 patients were alive. The 6-month overall survival ( OS ) was 89.6%, and the 1-year and 2-year OS were 83.8% and 60.9% respectively. The postoperative survival time was 9.5 months on average ( range; 2-22 months ) in the 17 patients who fnally died. The occurrence of pathological fracture had a signifcant effect on the OS ( χ2=11.662, P=0.001 ). The 1-year OS was 80.8% in the none-fracture group and 29.2% in the fracture group. The local recurrence rate was 11.6% ( 5/43 ), which occurred at 16.4 months after the operation on average ( range; 5-35 months ). The perioperative complication incidence was 4.7%. No complications such as internal fxation failure or pathological fracture were noticed. The mean VAS score was 7.8 points ( range; 5-9 points ) before the operation and 3.0 points ( range; 1-5 points ) and 2.6 points ( range; 1-6 points ) at 1 week and 3 months after the operation respectively. The ache degree at 1 week and 3 months after the operation was obviously alleviated when compared with that before the operation, and the differences were statistically signifcant ( t=22.889, P=0.000 & t=22.934, P=0.000 ). The mean MSTS score was 22 points ( range; 10-28 points ) in 41 evaluable locations and the excellent and good rate was 85%. There were 28 excellent cases ( 68% ), 7 good cases ( 17% ), 4 fair cases ( 10% ) and 2 poor cases ( 5% ).ConclusionsMicrowave ablation appears to be a safe and effective approach in the treatment of bone metastases, which can relieve local pain and control the development of bone metastases.
Catheter ablation; Bone neoplasms; Neoplasm metastasis; Microwaves
10.3969/j.issn.2095-252X.2014.04.009
R738.1
100035 北京积水潭医院骨肿瘤科
牛晓辉,Email: niuxiaohui@263.net
2013-12-25 )

