脊髓缺血再灌注损伤后 μ-Calpain mRNA 及蛋白的表达
卜国云 杜区成 吴叶 邓树才 朱加亮 商卫林
脊髓缺血再灌注损伤后 μ-Calpain mRNA 及蛋白的表达
卜国云 杜区成 吴叶 邓树才 朱加亮 商卫林
目的探讨钙调蛋白 μ-Calpain 在脊髓缺血再灌注损伤中的表达及意义。方法建立成年SD 大鼠缺血再灌注损伤模型,利用实时荧光定量 PCR 技术及 Western-blot 技术检测模型建立后 2 h、6 h、12 h、24 h、48 h 及 72 h μ-Calpain mRNA 及蛋白的表达情况。利用 Western-blot 技术检测 μ-Calpain 特异性底物 α-II Spectrin 的降解,并与对照组进行对比。结果与对照组相比,脊髓缺血再灌注损伤模型建立后 2 h,损伤段脊髓 μ-Calpain mRNA 的表达开始增高,但差异无统计学意义,12 h 后明显增高,差异有统计学意义( P<0.05 ),48 h 达峰值 ( P<0.001 ),72 h 后仍有 μ-Calpain mRNA 的表达且高于对照组,差异有统计学意义( P<0.05 )。模型建立后 2 h 损伤段脊髓 μ-Calpain 蛋白增高,48 h 达峰值 ( P<0.001 ),72 h 后 μ-Calpain 蛋白仍高于对照组,差异有统计学意义 ( P<0.05 )。α-II Spectrin 降解在模型建立后 2 h 即出现,但差异无统计学意义 ( P>0.05 ),72 h 后有少量 α-II Spectrin 残留。结论脊髓缺血再灌注损伤模型建立后,μ-Calpain mRNA 及蛋白表达增加,对其特异性底物 α-II Specrin 进行降解,参与了脊髓缺血再灌注损伤的病理过程。
卡配因;缩蛋白;再灌注损伤;脊髓损伤
在原发性脊髓损伤后,一系列继发性病理改变 导致神经功能的进一步丧失[1]。继发性损伤的机制包括脊髓缺血、细胞膜氧化、炎症反应、细胞内外离子失衡、细胞内蛋白酶系统的病理性激活、细胞骨架破坏等[2]。Calpain 蛋白是广泛存在于生物体内的蛋白酶,被 Ca2+激活后分解细胞骨架。本研究利用大鼠脊髓缺血性损伤模型,研究脊髓在缺血性损伤后 Calpain 蛋白不同时间段的表达情况。
材料与方法
一、实验动物与分组
成年雄性 SD 大鼠 70 只,体重 250~300 g,随机分为对照组和脊髓缺血后 2 h、6 h、12 h、24 h、48 h 及 72 h 组,每组 10 只。实验动物由解放军总医院第一附属医院实验动物科提供。
二、主要试剂
Trizol 试剂,美国 Invitrogen 公司;SuperScript First-Strand Synthesis 反转录试剂盒,美国 Invitrogen公司;RealMasterMix SYBR Green 试剂盒,天根公司;兔抗鼠 μ-Calpain 抗体 ( Santa Cruz,美国 );兔抗鼠 α-II Spectrin 抗体 ( Santa Cruz,美国 )。羊抗兔 IgG ( 北京中杉金桥 );ECL 试剂盒 ( Amersham Pharmacia,美国 )。
三、损伤模型制作及取材
速眠新按 0.02 ml / 20 g 腹腔注射进行麻醉,采用 Zivin 法制作动物模型。手术在无菌条件下操作。动物先俯卧固定于手术台上,消毒后经后正中入路切除 L2~4椎板,暴露 L3~4节段硬脊膜;关闭切口后,置动物于仰卧位,经腹正中入路暴露腹主动脉,于左肾动脉起始部远端以动脉夹夹闭腹主动脉40 min。对照组仅暴露至左肾动脉起始部远端。实验组按不同时间点处死动物,对照组在术后 2 h 处死。取出损伤段脊髓,0 ℃ 生理盐水冲洗后液氮中保存。
四、总 RNA 及总蛋白的提取
采用 Trizol 法提取总 RNA 及总蛋白,操作步骤严格按 Trizol 说明书进行。所得 RNA 经 10 g / L 琼脂糖凝胶电泳检测可见 5 S、18 S 及 28 S 三条带,未见RNA 降解带及 DNA 污染带。Trizol 提取 RNA 后,保留有机相,沉淀 DNA 后取上清液提取蛋白质,以牛血清蛋白制作标准曲线,采用 Bradford 法用紫外可见分光光度仪测定蛋白浓度,调整蛋白浓度至 10 μg / μl。
五、cDNA 合成及实时荧光定量 PCR
使用 SuperScript First-Strand Synthesis 反转录试剂盒,具体步骤按试剂盒说明书操作。所得cDNA 在 -20 ℃ 条件下保存。以 β-actin 为内参,进行实时荧光定量 PCR。μ-Calpain 上游引物为 5’-CTG TCA AAC CCC C CAG TTC AT-3’,下游引物为5’-GCA GCC AAG AGC CAA CAG T-3’,产物片段 213 bp。β-actin 上游引物为 5’-CCC ATC TAT GAG GGT TAC GC-3’;下游引物为 5’-TTT AAT GTC ACG CAC GAT TTC-3’,产物片段 150 bp。按 RealMasterMix SYBR Green 试剂盒说明书进行操作,反应条件如下:94 ℃ 预变性 2 min;94 ℃ 变性20 s;56 ℃ 退火 30 s;60 ℃ 延伸 40 s,40 个循环。μ-Calpain 的表达值相对于 β-actin 表达水平计算 ( 相对定量法:Ratio=2-△△CT)。
六、Western-blot 检测 μ-Calpain 及其底物 α-II Spectrin
取总蛋白样本 5 μl,加入 2×SDS-PAGE 上样缓冲液,加热至 100 ℃ 使蛋白充分变性,进行电泳将蛋白转移至 PVDF 膜上。取出 PVDF 膜后,洗去转膜液,加入 Western 封闭液,在摇床上缓慢摇动,室温封闭 2 h,加入 μ-Calpain 一抗 ( 1∶500 ),4 ℃缓慢摇动孵育过夜。加入 μ-Calpain 二抗 ( 1∶5000 )及 β-actin 抗体 ( 1∶10000 ),在 ECL kit 中显色,胶片曝光、显影。同法对 α-II Spectrin 进行 Westernblot 分析。
七、统计学分析
采用 SPSS 17.0 软件进行统计学分析,采用 t 检验进行对照组与各时间点实验组比较,P<0.05 为差异有统计学意义。
结 果
一、脊髓缺血再灌注损伤后 μ-Calpain mRNA 的表达
实验组术后 μ-Calpain mRNA 的表达随时间的推移而升高,2~6 h μ-Calpain mRNA 与对照组差异无统计学意义 ( P>0.05 ),12 h 开始增高,与对照组相比,差异有统计学意义 ( P<0.05 ),48 h 达峰值,48~72 h 下降,但仍高于对照组 ( 图1,表1 )。
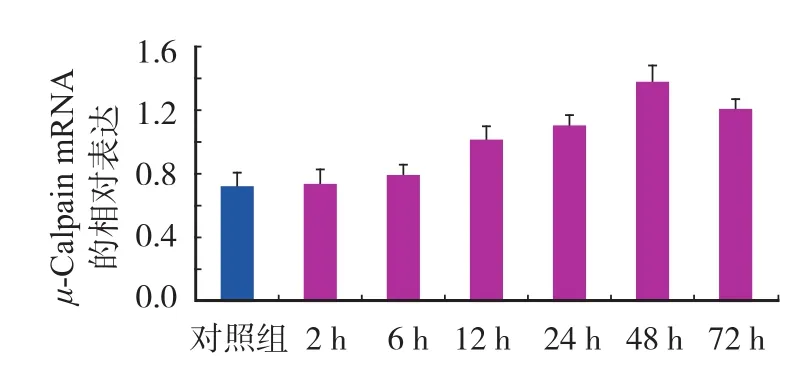
图1 对照组及实验组 μ-Calpain mRNA 的相对表达Fig.1 The relative expressions of μ-Calpain mRNA in the control and experimental groups
表1 对照组及实验组 μ-Calpain mRNA 的相对表达 (±s )Tab.1 The expressions of μ-Calpain mRNA in the control and experimental groups (±s )

表1 对照组及实验组 μ-Calpain mRNA 的相对表达 (±s )Tab.1 The expressions of μ-Calpain mRNA in the control and experimental groups (±s )
注:a与对照组相比,P < 0.05Notice:aMeant when compared with that of the control group, P<0.05
分组 n μ-Calpain mRNA ( 对数值 )对照组 10 0.72±0.099 2 h 组 10 0.73±0.087 6 h 组 10 0.79±0.070 12 h 组 10 1.01±0.099a24 h 组 10 1.10±0.077a48 h 组 10 1.38±0.091a72 h 组 10 1.21±0.069a
二、Western-blot 结果
与对照组比较,实验组 μ-Calpain 蛋白在术后6 h 开始增高,48 h 达峰值,72 h 下降,但仍高于对照组 ( P<0.05 ) ( 图2,表2 );α-II Spectrin 在造模成功后 2 h 就开始降解,但与对照组相比差异无统计学意义 ( P>0.05 ),6~72 h α-II Spectrin 蛋白显著降低 ( 图3,表3 )。Western-blot 电泳结果 ( 图4 )。
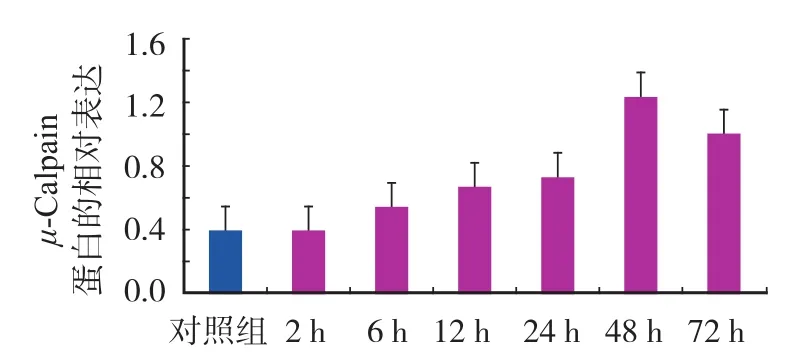
图2 对照组及实验组 μ-Calpain 蛋白的相对表达Fig.2 The relative expressions of μ-Calpain protein in the control and experimental groups
表2 对照组及实验组 μ-Calpain 蛋白的相对表达 (±s )Tab.2 The relative expressions of μ-Calpain protein in the control and experimental groups (±s )
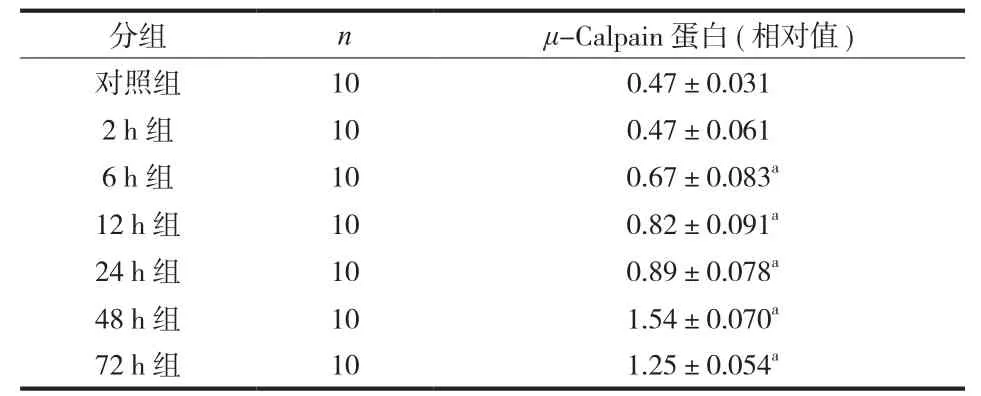
表2 对照组及实验组 μ-Calpain 蛋白的相对表达 (±s )Tab.2 The relative expressions of μ-Calpain protein in the control and experimental groups (±s )
注:a与对照组相比,P < 0.05Notice:aMeant when compared with that of the control group, P<0.05
分组 n μ-Calpain 蛋白 ( 相对值 )对照组 10 0.47±0.031 2 h 组 10 0.47±0.061 6 h 组 10 0.67±0.083a12 h 组 10 0.82±0.091a24 h 组 10 0.89±0.078a48 h 组 10 1.54±0.070a72 h 组 10 1.25±0.054a
表3 对照组及实验组 α-II Spectrin 的相对表达 (±s )Tab.3 The relative expressions of α-II spectrin in the control and experimental groups (±s )
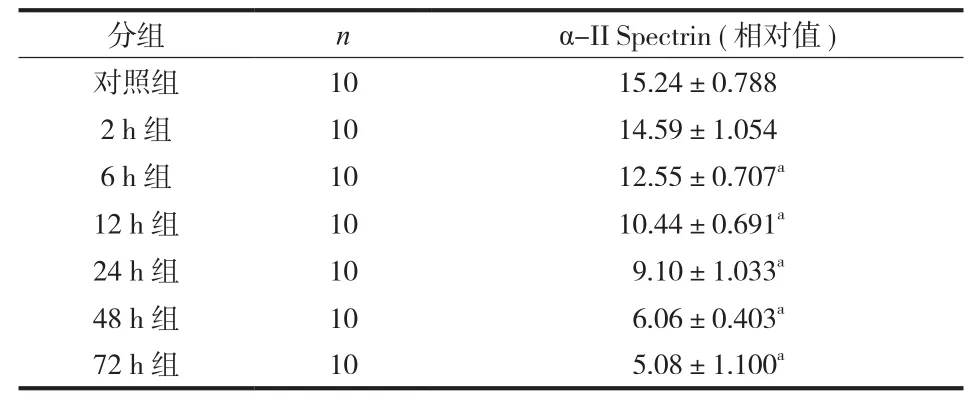
表3 对照组及实验组 α-II Spectrin 的相对表达 (±s )Tab.3 The relative expressions of α-II spectrin in the control and experimental groups (±s )
注:a与对照组相比,P < 0.05Notice:aMeant when compared with that of the control group, P<0.05
分组 n α-II Spectrin ( 相对值 )对照组 10 15.24±0.788 2 h 组 10 14.59±1.054 6 h 组 10 12.55±0.707a12 h 组 10 10.44±0.691a24 h 组 10 9.10±1.033a48 h 组 10 6.06±0.403a72 h 组 10 5.08±1.100a
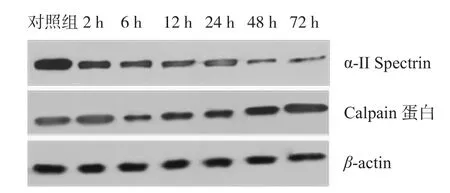
图4 对照组及造模后各时间点蛋白条带Fig.4 The protein band at different time points after the model was established in the control group
讨 论
脊髓损伤包括原发性损伤和继发性损伤,原发性损伤决定了脊髓损伤的程度,而继发性损伤可以引起脊髓结构和功能的进一步破坏,限制了脊髓功能的恢复,脊髓的出血和缺血再灌注损伤是继发性损伤中的重要机制[3]。本研究中,笔者利用脊髓的缺血再灌注损伤模型对脊髓损伤后 μ-Calpain mRNA、蛋白及其底物 α-II Spectrin 进行研究。
脊髓损伤后导致损伤平面以下的感觉和运动缺失。脊髓损伤后的病理变化复杂,有多种生物化学机制参与了细胞和轴突的破坏。细胞内 Ca2+超负荷被认为是缺血再灌注损伤的重要机制之一。Ca2+超负荷可导致线粒体功能破坏、各种钙依赖蛋白酶和脂肪酶的激活。Calpain 蛋白是一种 Ca2+依赖性蛋白酶,属于半胱氨酸蛋白酶家族,广泛地存在于哺乳动物的多种组织中,参与多种病理生理过程。在中枢神经系统中,Calpain 以前蛋白酶的形式存在于静止细胞中,对正常细胞的细胞骨架、信号转导和代谢有调节作用[4]。Calpain 主要分为两个亚型,即μ-Calpain 和 m-Calpain,受不同浓度的 Ca2+激活。Calpain 蛋白受 Ca2+激活后,可以降解细胞骨架蛋白、膜蛋白,并与细胞凋亡有关。
在脊髓重物撞击损伤模型中,Ray 等[5]发现损伤段脊髓内 μ-Calpain mRNA 在伤后的 72 h 内都没有明显增高,而 μ-Calpain 蛋白的活性在伤后的 4 h开始增强,在 48 h 达到峰值,但是该作者在另一项实验中发现,μ-Calpain mRNA 和蛋白在造模后的24 h 同时达到最大值[6]。而张子峰等[7]利用免疫组化技术对大鼠的脊髓缺血再灌注损伤模型进行研究发现,μ-Calpain 蛋白在造模后的 72 h 表达最多,在7 天后仍有表达。本实验结果显示,在造模后的最初 6 h 内,μ-Calpain mRNA 并没有显著增加,而造模后的 72 h 内都保持了非常高的水平;μ-Calpain 蛋白的表达在伤后早期就有了明显的增高。造成本实验与其它实验结果的差异可能有以下两项原因:( 1 )年龄是影响脊髓损伤后 Calpain 蛋白表达的重要因素之一,Wingrave 等[8]通过实验发现青年鼠比成年鼠在脊髓损伤后 Calpain 蛋白的表达要低,本实验的动物体重偏大,在 250~300 g,而其它几项实验所采用的实验动物体重在 200 g 左右,这一点可能会造成实验结果的差异;( 2 ) 脊髓损伤的撞击模型除了能导致脊髓的短暂缺血外,能造成更广泛的组织破坏,使 Ca2+大量快速内流,使 Calpain 快速转录及翻译,本实验所采取的模型为缺血再灌注模型,损伤程度轻于撞击模型。Lee 等[9]发现,在兔的脊髓缺血再灌注损伤模型中,μ-Calpain 蛋白在造模后30 min 即有明显的增加,并随着时间的推移而下降。通过上述实验结果分析,μ-Calpain 蛋白的表达在不同的脊髓损伤模型和不同种属之间的表达有可能是不相同的,这一点值得深入地研究。
α-II Spectrin 蛋白是细胞骨架蛋白之一,分子量为 230KD,在神经系统中表达于神经元的胞体、树突及轴突,是 μ-Calpain 的特异性底物之一,可在 Calpain 蛋白的催化下降解为分子量为 150KD的 Cleaved α-II Spectrin。实验结果表明,脊髓缺血再灌注损伤后,μ-Calpain 蛋白的特异性底物α-II Spectrin 即出现降解,但在造模后的 6 h 才出现明显降解,这与 μ-Calpain 蛋白在造模后升高的趋势相同。α-II Spectrin 的降解说明细胞骨架蛋白逐渐被破坏,神经组织发生溃变。μ-Calpain 在降解α-II Spectrin 的同时,还降解 NF200、68KD NFP等,使细胞骨架蛋白遭受进一步破坏,提示可以将μ-Calpain 作为保留细胞结构的治疗靶点,保持神经结构的完整性。
本实验中,μ-Calpain 蛋白的升高和 α-II Spectrin的降解要早于 α-Calpain mRNA 的升高,这可能是在脊髓损伤发生后 Ca2+内流首先激活了 μ-Calpain进行细胞骨架的降解,同时通过其它机制先促使μ-Calpain 的翻译增强,然后促进转录的增强。
脊髓损伤后的继发性损伤导致了脊髓结构和功能的进一步破坏,μ-Calpain 作为 Ca2+的激活蛋白酶,参与了神经细胞及神经纤维骨架蛋白的分解。本研究结果提示,如果能够及时阻止 μ-Calpain 蛋白的转录及激活,有可能阻止细胞骨架蛋白的降解,保留神经结构,进而为神经功能恢复提供物质基础。
[1] Borgens RB, Liu-Snyder P. Understanding secondary injury. Q Rev Biol, 2012, 87(2):89-127.
[2] Schumacher PA, Eubanks JH, Fehlings MG. Increased calpain I-mediated proteolysis, and preferential loss of dephosphorylated NF200, following traumatic spinal cord injury. Neuroscience, 1999, 91(2):733-744.
[3] Dumont RJ, Okonkwo DO, Verma S, et al. Acute spinal cord injury, part I: pathophysiologic mechanisms. Clin Neuropharmacol, 2001, 24(5):254-264.
[4] Colak A, Kaya M, Karaoğlan A, et al. Calpain inhibitor AK 295 inhibits calpain-induced apoptosis and improves neurologic function after traumatic spinal cord injury in rats. Neurocirugia (Astur), 2009, 20(3):245-254.
[5] Ray SK, Shields DC, Saido TC, et al. Calpain activity and translational expression increased in spinal cord injury. Brain Res, 1999, 816(2):375-380.
[6] Ray SK, Matzelle DD, Wilford GG, et al. Increased calpain expression is associated with apoptosis in rat spinal cord injury: calpain inhibitor provides neuroprotection. Neurochem Res, 2000, 25(9-10):1191-1198.
[7] 张子峰, 侯铁胜, 邓必权, 等. 钙蛋白酶在脊髓缺血再灌注损伤中的表达. 实用医药杂志, 2005, 22(4):327-329.
[8] Wingrave JM, Sribnick EA, Wilford GG, et al. Relatively low levels of calpain expression in juvenile rat correlate with less neuronal apoptosis after spinal cord injury. Exp Neurol, 2004, 187(2):529-532.
[9] Lee JC, Hwang IK, Yoo KY, et al. Degradation of spectrin via calpains in the ventral horn after transient spinal cord ischemia in rabbits. Neurochem Res, 2006, 31(7):989-998.
( 本文编辑:马超 王萌 )
Expressions of μ-Calpain mRNA and protein after spinal cord ischemia-reperfusion injury
BU Guo-yun, DU Qu-cheng, WU Ye, DENG Shu-cai, ZHU Jia-liang, SHANG Wei-lin. Department of Spine Surgery, Tianjin Hospital, Tianjin, 300211, PRC
ObjectiveTo explore the expressions and signifcance of μ-Calpain after spinal cord ischemiareperfusion injury.MethodsAn adult Sprague-Dawley ( SD ) rat model of spinal cord ischemia-reperfusion injury was established. Quantitative real-time furoscent polymerase chin reaction ( PCR ) and Western-blot technique were used to detect the expressions of mRNA and protein of μ-Calpain at 2 h, 6 h, 12 h, 24 h, 48 h and 72 h after the model was established. The degradation of α-II specrin of the specifc substrate of of μ-Calpain was detected by Westernblot technique, and the results were compared with that of the control group.ResultsThe expressions of μ-Calpain mRNA of the injured spinal cord began to increase at 2 h after the model was established, but there were no statistically significant differences. The expressions were obviously increased at 12 h, and there were statistically significant differences ( P<0.05 ). The peak was reached at 48 h after the model was established ( P<0.001 ). The expressions of μ-Calpain mRNA remained at a higher level at 72 h when compared with that of the control group, and there were statistically signifcant differences ( P<0.05 ). The expressions of μ-Calpain protein of the injured spinal cord began to increase at 2 h after the model was established, and the peak was reached at 48 h ( P<0.001 ). The expressions of μ-Calpain protein remained at a higher level at 72 h after the model was established when compared with that of the control group, and there were statistically signifcant differences ( P<0.05 ). The α-II spectrin began to degenerate at 2 h after the model was established, but there were no statistically signifcant differences. There were still some α-II spectrin remains at 72 h.ConclusionsThe expressions of μ-Calpain mRNA and protein are increased after the spinal cord ischemia-reperfusion injury model is established, and meanwhile the α-II specrin of its specifc substrate begins to degenerate. The μ-Calpain is involved in the pathological course of spinal cord ischemia-reperfusion injury.
Calpain; Spectrin; Reperfusion Injury; Spinal Cord Injuries
10.3969/j.issn.2095-252X.2014.12.014
:R683.2
全军十二五面上项目 ( CWS11J100 )
300211 天津市天津医院脊柱一科 ( 卜国云、邓树才 );100048 北京,解放军总医院第一附属医院骨二科( 杜区成、吴叶、朱加亮、商卫林 )
吴叶,Email: wuyespine@126.com
2013-12-22 )

