低剂量/低剂量率电离辐射生物效应
闵 锐
(中国人民解放军第二军医大学海军医学系 舰船辐射医学教研室 上海 200433)
低剂量/低剂量率电离辐射生物效应
闵 锐
(中国人民解放军第二军医大学海军医学系 舰船辐射医学教研室 上海 200433)
与大剂量/高剂量率电离辐射诱导的急性组织损伤效应不同,低剂量/低剂量率电离辐射除诱导慢性随机效应外,在一定条件下还可诱导兴奋效应和适应性反应。本文介绍有关低剂量/低剂量率辐射的定义和目前在低剂量/低剂量率辐射生物效应研究中存在的一些理论和现实问题,系统回顾低剂量/剂量率辐射诱导的一些生物学效应及效应发生的特点。
低剂量电离辐射,非靶效应,适应性反应,兴奋效应
长期以来,人们对核武器爆炸及重大核电站事故致大剂量/高剂量率电离辐射会诱导急性放射损伤印象深刻,对包括接受医学放射性诊断和检查,执行太空任务,及其他军事和经济领域高辐射本底工作环境低剂量或低水平电离辐射导致的长期生物学后果则了解不够。以至于科学界对低剂量/低水平辐射对人类环境和健康究竟会造成何种影响,这种影响是有益还是有害,需不需要防护,防护到何种程度等问题仍存在不少争议[1]。出现这种状况的原因主要是:相当长一段时间,低剂量/低剂量率的概念和定义不是太明确,导致大量研究结果缺乏可比性;低剂量/低剂量率辐射诱导效应的程度普遍较低,这种低程度效应同时还受机体修复机制、内稳态调节机制和其他体内外因素的干扰和影响,特异性效应需要长时间积累才可能出现,导致研究和观察低剂量/低剂量率辐射效应十分困难,增加了科学认识和正确评估低剂量/低剂量率辐射效应及后果的难度。
1 低剂量/剂量率的定义和概念[2]
广义讲,低剂量和低剂量率概念十分不确定,不同应用目的和场合有不同的标准和解释。从物理角度,低剂量和低剂量率是一个相对大剂量和高剂量率而言的简单物理概念。但在辐射生物效应研究者眼中,低剂量/剂量率可以指细胞关键部位在吸收射线能量后,造成的扰动或轻微损伤,完全可以在细胞自身修复机制的引导下得到及时纠正和正确修复的辐射剂量和剂量率。从健康危害评价和辐射防护的角度,公众接受的低剂量/剂量率辐射指除天然本地和医源性辐射外,这种剂量和剂量率诱导的有害效应不高于其他环境因素诱导的有害健康效应的发生率。对于职业放射工作者,低剂量/剂量率指年吸收当量剂量导致的健康风险不高于其他职业工作者的职业危害风险发生率的剂量和剂量率。从有效执行战时任务和平时救险任务的角度,低剂量和低剂量率指不妨碍人员短期内有效准确执行各种体力和精力要求的各种任务,同时不会对健康造成明显或严重的短期和长期危害的辐射剂量和剂量率。
1.1 国际机构对低剂量/剂量率的界定
为加强辐射健康效应相关科学研究资料的可比性,联合国原子辐射效应科学委员会(United Nations Scientific Committee on the Effects of Atomic Radiation, UNSCEAR)在1986年的报告中,分别对低水平辐射(Low level radiation)和低剂量辐射(Low dose radiation)进行定义:低水平辐射是指0.2 Gy以内的低LET辐射或者0.05 Gy以内的高LET辐射,剂量率均不超过0.05 mGy·min-1的电离辐射;低剂量辐射指符合低水平辐射的其他条件,但剂量率高于0.05 mGy·min-1的辐射。随着研究的不断发展和发现,低剂量和低剂量率概念的定义也不断被修正。国际辐射防护委员会(International Commission on Radiological Protection, ICRP)1991年60号出版物建议,剂量低于0.2 Gy,或剂量高于0.2 Gy但剂量率低于0.1 Gy·h-1的剂量可视为低剂量。1993年,美国国家辐射防护委员会(National Radiological Protection Board, NRPB)建议,用于辐射防护目的,剂量低于100 mGy,时间1h以上,平均剂量率低于0.1 mGy·min-1的急性照射剂量可以认为是低剂量(急性照射指那些剂量低于100 mGy,剂量率低于5 mGy·h-1的照射)。从诱导生物学效应的角度,长期积累剂量有时可能超过100 mGy,但剂量率低于5 mGy·h-1,此时反映生物效应的剂量效应曲线仍在线性范围内,这种剂量也可视为低剂量。
在低剂量辐射风险评估中,2006年美国等国家将当量剂量低于100 mSv,剂量率低于0.1 mSv·min-1的辐射统称为低剂量辐射[3]。而2010年UNSCEAR的年度报告中定义低剂量为:剂量低于200 mGy,剂量率低于0.1 mGy·min-1(1h以内或1h以上的平均剂量率)的X和γ-射线外照射剂量(Report of the UNSCEAR 2010: Fifty-seventh session, includes Scientific Report: summary of low-dose radiation effects on health)。足见,低剂量/剂量率概念的运用有专业和非专业之别,科学和通俗之别,平时和战时之别,不同应用目的之别,见表1。
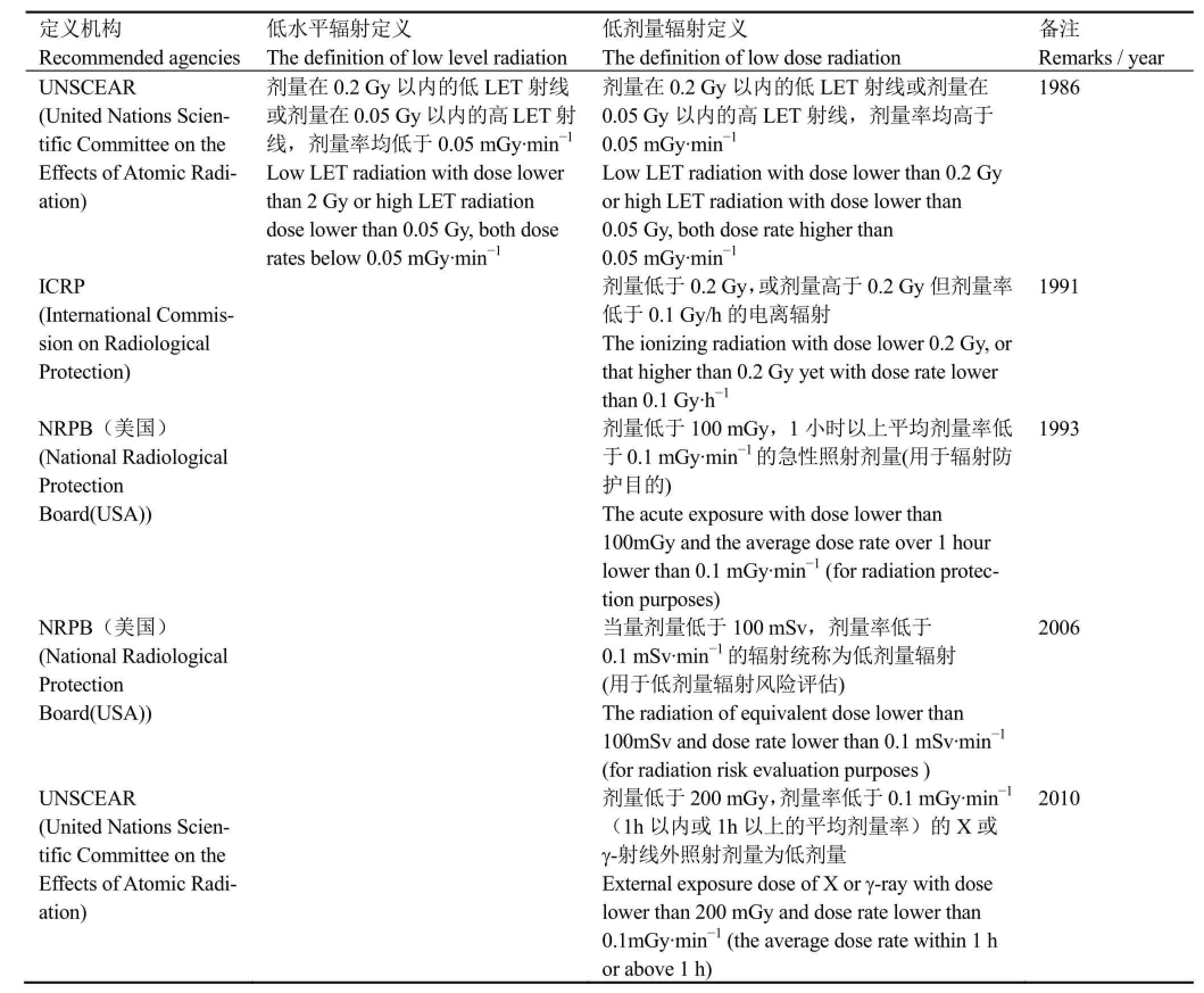
表1 国际机构对低剂量/低水平电离辐射的界定一览表Table 1 The definition of low dose/low levels of ionizing radiation recommended by international agencies
1.2 其他有关低剂量/剂量率的描述
辐射生物学家可从不同 LET射线与靶分子作用形成的剂量效应曲线,来定义什么是低剂量照射。通常认为,电离辐射随机效应风险源自细胞核DNA的错误修复和未修复的DNA损伤。低LET电离辐射(如高能β粒子和 γ-射线诱导产生的电子)在低水平照射时,诱导的随机效应风险直接正比于射线在细胞核中穿行的初始径迹数,此时的剂量效应曲线是线性的。而在较高水平照射时,低LET电离辐射诱导的随机效应风险由射线在细胞核中穿行的初始轨迹数和不同轨迹在DNA水平相互作用共同来决定,此时的剂量反应曲线呈线性二次方型曲线。同样,由于较高水平电离辐射可直接杀死细胞,实际上可降低随机效应剂量反应曲线的斜率。而高LET电离辐射(如α粒子),在细胞核内的一次作用足以损伤细胞,以至于多次(多轨迹)相互作用对细胞损伤的贡献可以忽略,此时的剂量反应曲线是线性的(直到细胞发生死亡,剂量效应曲线的斜率才出现显著下降),其斜率大于低LET射线剂量反应曲线线性部分的斜率。如果低LET射线照射时间足够长,由于时间关系射线在细胞核中的运行轨迹是不同的,即使存在射线运行轨迹之间的相互作用,在这种相互作用诱导的效应发生之前,由于射线诱导的初始DNA损伤已经通过内在的DNA修复机制而得到修复,剂量反应曲线也不会出现二次方部分(尤其是相互作用诱导额外DNA单链断裂,该类损伤被认为是低 LET射线剂量效应曲线二次方部分的主要贡献)。因此,在实验操作上,低剂量可以指效应发生在剂量效应曲线线性区域以内的剂量。
另一方面,剂量效应曲线中的线性关系不仅仅与辐射剂量有关,也与辐射剂量的剂量率有关。同样辐射剂量,通过修正剂量率能使原本会出现的非线性剂量反应曲线(如线性二次方曲线)仍保持在线性范围[4-5]。
值得指出的是,过去和现在,评估低剂量和低剂量率辐射效应借用的是大剂量高剂量率照射得到的剂量效应曲线模型,根据这个模型的效应曲线外推到低剂量范围,即所谓LNT (Linear-nothreshold)模型。由于认识到大剂量高剂量率照射得到的剂量效应曲线(大剂量高剂量率照射动物和细胞,得到的照射剂量与动物或细胞存活效应的曲线是一条具有一定斜率的直线),可能与低剂量和低剂量率辐射诱导的剂量效应曲线有所不同,用 LNT模型来评估低剂量和低剂量率辐射效应可能带来一定误差,为修正这种误差,国际辐射防护委员会(ICRP)提出剂量和剂量率效能因子(Dose and dose-rate effectiveness factor, DDREF)的概念。DDREF为大剂量/高剂量率线性无阈效应曲线的斜率与大剂量/低剂量率线性无阈效应曲线的斜率之比。ICRP提出这个概念,是基于低剂量/低剂量率射线照射得到的剂量效应曲线,与大剂量/低剂量率射线照射得到的剂量效应斜率均呈线性连续,只不过低剂量/低剂量率、低 LET射线照射得到的剂量效应曲线斜率低于大剂量/高剂量率射线照射得到的剂量效应曲线斜率的假设。根据DDREF概念,在用 LNT模型评估低剂量辐射效应时,需用DDREF对结果进行适当修正(减低)[6-7]。出于辐射防护目的,ICRP (1991) 60号出版物建议,在评估吸收剂量低于0.2 Gy或吸收剂量高于0.2 Gy,但剂量率低于 0.1 Gy·h-1射线照射诱导的风险时,DDREF修正因子为2。2006年,美国日本辐射生物效应研究基金会 VII号(BEIR VII)报告推荐的DDREF值为 1.5(他们假设高 LET电离辐射的DDREF值为1)。而2007年,ICRP再次建议DDREF值取2,其含义为低剂量/低剂量率射线照射得到的剂量效应曲线斜率只有大剂量/高剂量率射线照射剂量效应曲线斜率的一半,意味着如仍然用 LNT模型来评估低剂量辐射效应,其结果(如辐射风险)要降低一半。然而。ICRP 建议的DDREF值是否科学和合理,科学界也存在不同意见。
2 低剂量/低剂量率辐射生物效应研究的理论和现实问题
战时和平时,低剂量和低剂量率电离辐射导致的环境和健康问题都大量存在。如战时核武器、贫铀武器和放射武器使用,造成的环境低剂量和低剂量率辐射污染对军人和平民健康带来的广泛而持续的影响;平时长期工作在核电站、核废料处理和储存、核材料加工、运输和存放等场所的工人和军人,低剂量和低剂量率辐射环境对他们身心健康的影响;核事故造成的长期低剂量和低剂量率辐射环境污染对公众健康的影响[8];各种医学诊断、检查手段利用过程中低剂量和低剂量率辐射对患者和医生的健康影响[9];宇航员执行太空任务过程中太空低剂量和低剂量率辐射对他们执行任务的体力和能力,以及长期健康的影响等[10-12]。
科学回答上述问题需要展开大量动物和细胞辐射生物学效应的实验室研究,以及受照人群长时间大规模健康效应的流行病学调查。包括逐一阐明低剂量和低剂量率辐射诱导的生物效应与大剂量高剂量率辐射诱导的效应,在产生、传播和导致的生物学后果方面有什么不同?低剂量和低剂量率辐射诱导的效应哪些是对人类健康有害的?危害出现的时间和程度如何?是否需要防护?防护到何种程度?描述大剂量高剂量率辐射效应的假设、模型和剂量效应曲线是否适合用来描述低剂量/剂量率辐射诱导的生物学效应?这种模型能否准确说明和评价低剂量/剂量率辐射诱导的健康风险?如何根据流行病学调查结果和低剂量和低剂量率辐射诱导生物效应的特点,科学评价环境低剂量和低剂量率辐射对健康的影响,合理确定辐射防护的剂量剂量率标准?等科学问题。此外,除剂量和剂量率因素外,许多其他因素对辐射生物效应也会产生不同程度影响,如同样低剂量和低剂量率条件,不同LET射线,在不同物理、化学和生物条件下,以不同方式(单次和多次照射,急性和慢性照射,局部和全身照射)照射,生物效应发生的方式、效应程度和结局有什么不同等,对这些影响因素也应展开系统全面的研究。
围绕上述问题展开科学研究在理论上对于准确揭示不同剂量剂量率辐射生物效应发生的规律和导致的生物学后果,在实践上对于正确评估低剂量和低剂量率辐射作业环境对人员健康的影响,科学合理制定不同辐射作业环境人员作业时间和照射剂量限值(如平时和应急条件下一次或多次照射的剂量限值),以及采取正确的辐射防护和健康保证措施等,皆具有重要科学和实践意义。
3 低剂量/剂量率辐射诱导的生物学效应及特点
电离辐射诱导生物效应源于射线与组织细胞的相互作用,在这一过程中能量被DNA、蛋白、细胞膜结构和水介质等维系生命的重要分子、组织结构和介质吸收,导致他们的功能和活性发生改变和各种活性、毒性产物的产生,继而出现各种效应。伴随这些效应的传播、传递、相互作用、调节和放大,最终在不同时间、不同层次出现可观察到的生理或病理效应。与大剂量/高剂量率照射方式比,低剂量/低剂量率照射诱导的生物效应,在效应发生方式、效应类型、效应程度和结局等方面都有其自身特点。
3.1 低剂量辐射诱导的非靶效应
“非靶效应”(No target effects)指在电离辐射直接作用靶细胞导致靶细胞损伤的过程中,未受到照射的一些细胞(非靶),也会发生与受照靶细胞一样的生物学效应。这种效应既可发生在受照细胞邻近的未受照射区域,也可发生在远离受照体积的区域和部位,还可发生在受照细胞,及邻近受照细胞未受照细胞的子代细胞。这些效应过去分别称为“旁效应”(Bystander effects);“远隔效应”(Abscopal effects)和“基因组不稳定性效应”(Genomic instability effects),现统称为非靶效应。非靶效应概念的提出引出不少科学问题:如评估辐射风险的经典生物物理模型,是建立在受损细胞不与其他细胞通信,也不影响未击中细胞反应的“靶”理论基础上的,非靶效应现象的发现,这种长期用来评估大剂量辐射危害和外推用于评估低剂量辐射致癌的生物物理模型是否需要重新审查、评估和修正?在放射治疗中,考虑到非靶效应的存在,达到同样治疗效果能否能适当降低治疗剂量?同样在放疗过程中,为减轻照射部位正常组织的损伤,能否通过辐射的“非靶效应”,如远隔效应,达到降低照射部位正常组织辐射剂量的目的?或通过远隔效应激活免疫系统,诱导细胞毒素限制原位肿瘤的生长?如何将非靶效应因素纳入辐射风险评估和确定辐射防护剂量限值考量等。 关于“非靶效应”,也有人认为其实就是一类电离辐射的继发效应[13]。更需要指出的是,诱导“非靶效应”也并非低剂量的专利,大剂量也能诱导,尤其是旁效应和基因组不稳定性现象[14-15]。
3.1.1 旁效应(Bystander effects)[16]
旁效应定义为,邻近照射部位的未照射分子和细胞发生与照射部位分子和细胞内同样的效应。这种现象最早由Nagasawa和Little 在1992年提出,他们发现1%的细胞受高LET射线照射后,约30%的细胞出现姊妹染色体交换。机理研究表明,旁效应细胞收到了来自照射细胞传递的信号,这种信号由受照细胞分泌和/或溶出,在细胞间通过细胞间隙联接和其他方式进行传递。研究也表明,并非所有射线都能诱导旁效应,也并非所有细胞都能够产生旁效应信号或作出旁效应反应,而且一旦旁效应被触发,效应的程度基本不随剂量变化,旁效应的出现与初始受照细胞数无关,受照细胞旁效应信号的发射和旁效应细胞反应是一种要么全有要么全无的双态过程[17]。
不管这种效应由什么射线和多大剂量诱导,现在大家感兴趣的是如何评价和利用这种效应。如果旁效应的终点是致细胞凋亡,那么在辐射防护中可以认为是一种有利效应,因为正常组织受损细胞发生凋亡对正常组织实际起到一种保护作用,如果这些受损细胞继续存在或进一步增殖生长发育,极有可能导致癌症发生。如果旁效应的终点是使细胞转换、基因突变或染色体重排,那么这种效应可视为有害效应,因为这些具有基因改变的旁效应细胞随时可能会“启动”和通过错误修复“积累”,最终导致肿瘤发生。而从肿瘤放射治疗的角度,达到同样治疗效果,考虑旁效应的存在可以降低肿瘤的照射剂量和照射面积。但目前观察到的大多数与旁效应相关联的事件都与基因突变,细胞死亡等有害效应相关。
3.1.2 远隔效应(Abscopal effects)[18-20]
Abscopal一词中, ab为拉丁字的前缀,意为“远离”,scopal来自希腊字的scopos,意为“靶”。这种效应定义为,辐射生物学效应可发生在远离受照靶部位的部位。远隔效应意味着组织辐射效应的反应范围远大于受照部位的大小,其实这种现象很早就有报道[21]。一些研究表明,辐射远隔效应有利于抑制肿瘤生长,如照射小鼠的右后腿可使种植在小鼠左后腿的肿瘤缩小。在肿瘤治疗中,可通过在远离肿瘤部位照射激活系统免疫,或诱导相关基因表达增加,或诱导某些影响肿瘤细胞生长的信号分子表达,导致原位肿瘤的生长抑制,但也有远位照射可在原位诱发各种肿瘤的报道[22-24]。值得指出的是,诱导远隔效应并非低剂量的专利,大剂量照射也可诱导远隔效应。
3.1.3 基因组不稳定性效应[25-30]
基因组不稳定性(Genomic instability)原指基因组表现为染色体畸变、微核形成、基因突变等获得性改变概率增加的一类现象。辐射诱导的基因组不稳定性指辐射诱导某一细胞发生亚致死损伤,损伤细胞与其他未受照射细胞进行信息交换,导致损伤细胞或未受到直接照射细胞的下代细胞发生基因不稳定性的概率增加的现象。辐射诱导的基因组不稳定性表现为染色体重排、突变、微核、基因拷贝数、DNA重复序列中的不稳定小型和微型卫星序列增加,以及细胞转换和死亡率增加等。对于低剂量,10 mGy的X-射线便可诱发基因发生不稳定性。然而辐射诱导的基因组不稳定性也并非低剂量的专利,在大剂量照射诱导的靶和非靶效应过程中也会出现基因组不稳定性现象。不同剂量照射诱导的基因不稳定性过程都与细胞间信号传递、趋化因子、细胞因子和活性氧/活性氮产生为特征的炎性反应有关。各种辐射,包括放射治疗诱导的基因不稳定性,很容易让人联想这是否就是导致辐射致癌和辐射遗传效应的原因,其实问题并没有那么简单,因为细胞本身的自由基清除能力和组织损伤修复能力都能对靶效应或非靶效应过程诱导的基因不稳定性,以及这些基因不稳定性最终是否会进展为疾病产生影响。因此,要明确辐射诱导的基因组不稳定性究竟会对人类健康产生何种影响还需进一步研究。
3.2 低剂量辐射诱导的适应性反应
适应性反应(Adaptive responses)是低剂量辐射诱导的一类经典反应。
适应性反应指靶物质(如细胞)先暴露于一个非常低的辐射剂量(启动剂量),在经过一个短暂的时间间隔后,再用较大剂量(效应剂量)进行照射,其诱导的损伤效应小于靶物质直接用效应剂量进行照射诱导的效应。如细胞事先暴露于一个非常低的辐射剂量,间隔一定时间,再暴露到大剂量,其染色体畸变率低于直接用大剂量照射细胞诱导的畸变率[31-32]。但实验发现,并不是所有细胞都具有这样的反应和出现这样的效应,有些细胞能出现低剂量辐射的适应性反应,有些细胞则出现低剂量辐射损伤的累加效应,表明遗传背景可能也在低剂量诱导的适应性反应中起着重要作用,至少在淋巴细胞上是这样[33]。低剂量电离辐射也可影响生物转化的自发频率,如有报道发现低剂量或剂量率辐射能将细胞的正常转换率和染色体损伤率降到正常本底水平以下[34-35]。这也属于一种适应性反应,这种适应性反应对于评估辐射的剂量效应关系,尤其是评估低剂量辐射总量和总剂量率与辐射效应间的关系非常重要。在一系列小鼠辐射适应性反应的研究中发现,只给小鼠照射“启动剂量”,小鼠表现出生命延长和肿瘤延迟发生的现象,表明可能低剂量诱导的适应性反应具有降低辐射危险的作用[36-38]。机制研究表明,低剂量电离辐射有可能通过触发和激活生物自我修复和保护系统,进而起到降低辐射相关有害效应风险的作用[39]。然而,这些低剂量辐射通过诱导适应性反应,从而起到降低辐射有害效应的研究结果和结论,明显与目前在辐射风险评估和辐射防护中使用的线性无阈模型相矛盾。
3.3 低剂量辐射诱导的兴奋效应
兴奋效应(Hormetic effects),即物质在小剂量时诱导出刺激或兴奋效应,在较大剂量时则诱导出抑制效应。这是一种由小剂量的物理、化学和生物物质或因素刺激都能诱发出,较普遍的一种效应现象,不仅仅限于低剂量电离辐射这类物理因素。一些研究发现,低剂量X或γ-射线照射能激活正常细胞广谱防御性表观遗传信号,上调适应性反应相关基因,促进细胞,尤其是免疫细胞功能,增强DNA损伤的修复能力,诱导细胞Apoptosis 清除癌前和突变细胞,诱导应激蛋白产生,清除自由基,激活膜受体,促进细胞因子和生长因子分泌等作用[40-42]。
这些作用似乎都有利于抵抗辐射损伤和辐射诱导的肿瘤和疾病,因此有人提出低剂量辐射有益无害的观点[43]。但另一方面,从损伤修复的角度,虽然有报道认为低剂量照射诱导的无误修复率比大剂量照射高,但并没有证据表明低剂量照射可诱导100%的无误修复。即再低剂量的照射也存在一定比例的错误修复,这些错误修复的积累和放大,及其在其他因素共同作用下,都有可能成为晚期随机效应风险增高的原因。对此,美日辐射效应共同委员会BEIR VII报告的结论是,“假设任何低剂量电离辐射诱导的具有刺激作用的兴奋效应对人类健康是有益的,但此时辐射带来的额外潜在危害却无法保证。因此任何关于低剂量辐射有益或有害的结论都为时过早,这方面的研究还需更加深入”。鉴此,目前在辐射风险评估中使用 LNT模型的科学性和正确性仍需得到维护[44-45]。
3.4 低剂量/低剂量率辐射效应特点[46]
就电离辐射与物质作用方式和过程而言,大剂量与低剂量照射并没有什么本质区别。大剂量和低剂量电离辐射都通过直接和间接作用诱导生物学效应。直接作用指作用和效应同时发生在同一分子、亚细胞结构或细胞上,间接作用指作用和效应发生在不同的靶物质上,如电离辐射先与生物介质(如水)作用生成包括自由基在内的各种活性产物,这些活性产物再与各类生物靶物质作用诱导效应。类似的概念还有电离辐射的原发作用和继发作用。原发作用指射线与生物靶或生物介质直接发生电离、激发或碰撞等作用。继发作用有两方面的含义,一是指在直接发生电离、激发或碰撞的过程中,往往伴随具有一定动能的次级射线和粒子产生,这些次级射线和粒子具有在原位或异位与靶物质作用,发生次级电离、激发和碰撞的能力。二是指无论电离辐射的原发作用还是继发作用导致的生物损伤或内环境破坏,诱导生成和分泌的各种生物毒素(如辐射毒素,炎性因子等)可继续与各类生物靶物质作用产生效应。大剂量照射的直接、间接和继发作用诱导的急性效应都要强于低剂量照射,然而据认为,低剂量诱导远期效应的能力要大于大剂量照射。
不同剂量和剂量率诱导生物效应的区别和不同,在于效应发生的方式、时间、频率、传播过程、效应程度和结局不同。从剂量率的角度,射线大剂量率(或急性)照射,一方面通过瞬间在生物组织中诱导出大量正负离子对导致强烈生物效应,另一方面,大量正负离子对在小范围内的聚集也很容易产生复合效应,而离子对复合后便失去了进一步诱导生物效应的能力,因此大剂量率(或急性)照射诱导的效应很快出现,通常称为急性效应,这种效应发生的范围往往较局限。低剂量率照诱导产生的正负离子对比较稀疏,但正负离子对复合的概率大大低于大剂量率急性照射,因此效应的持续时间和作用距离都较长,这种效应通常称为慢性远期效应或随机效应。
随机效应指效应发生率(非严重程度)随照射剂量增加而增加。理论上无论受照剂量多低,只要受到照射效应就有可能发生,不存在剂量阈值。虽随机效应的发生和发生率仍然主要取决射线的剂量和剂量率因素,但与大剂量/剂量率照射比,非剂量和剂量率因素对其发生和发生率的影响要大的多。这一方面,由于低剂量/低剂量率诱导的效应程度多较轻微,机体对轻微损伤效应具有一定自主修复机能,存在边损伤边修复的情况。生物体可通过其特有的内环境稳定调节能力,在一定程度调节和适应低剂量照射对内环境的扰动,以及通过体内固有的修复机制纠正和修复射线诱导的一些可逆性改变或轻微损伤,进而在一定程度避免效应的发生或降低发生率。另一方面,剂量和剂量率以外的因素对低剂量/低剂量率诱导的生物效应影响较大,使得研究和观察低剂量和低剂量率辐射效应,评价其有益还是有害十分困难。目前较有说服力的低剂量和低剂量率生物效应研究结果,如致人类癌效应,主要还是来自对特定受照人群的流行病学调查。
4 结语
综合目前低剂量/剂量率辐射生物效应研究,科学界和公众最关心的问题是低剂量/剂量率辐射的致癌效应和遗传效应。但这方面的研究涉及辐射效应发生机制、机体修复机制、癌症发生机制、研究这些机制的细胞和动物模型,以及大量流行病学调查资料分析等广泛而复杂的科学问题。在低剂量/剂量率辐射致癌研究方面,正反两方面的结构报道都有,目前一时还不能对这些结果作出正确的结论和判断。然而在大量核工业职业工作者流行病学调查研究中,确实发现长期接触低剂量/剂量率照射者癌症发生率显著增加,但这些癌症也只限于白血病和肺癌。对于低剂量/剂量率辐射致遗传效应的研究,仍然只是在离体细胞和动物实验中发现遗传效应显著增加,在人群流行病学调查研究中,遗传效应增加并未达到显著水平。有关这方面的研究和问题已有许多评述[47-50]。
1 Socol Y, Dobrzyński L, Doss M, et al. Commentary: ethical issues of current health-protection policies on low-dose ionizing radiation [J]. Dose Response, 2013, 12(2): 342-348.
2 Editorial. The meaning of low dose and low dose-rate [J]. Journal of Radiological Protection, 2010, 30: 1-3.
3 National Research Council of the National academies. health risks from exposure to low levels of ionizing radiation: beir vii, phase 2. committee to assess health risks from exposure to low levels of ionizing radiation, board of radiation effects, research division on earth and life studies [M]. Washington: National Research Council of The National Academies Press, 2006, 19-42.
4 Tanaka K, Kohda A, Satoh K. Dose-rate effects and dose and dose-rate effectiveness factor on frequencies of chromosome aberrations in splenic lymphocytes from mice continuously exposed to low-dose-rate gamma-radiation [J]. Journal of Radiological Protection. 2013, 33(1): 61-70.
5 Brooks A L. Is a dose dose-rate effectiveness factor (DDREF) needed following exposure to low total radiation doses delivered at low dose-rates? [J]. Health Physics, 2011, 1(3): 262.
6 Vaiserman A M. Radiation hormesis: historical perspective and implications for low-dose cancer risk assessment [J]. Dose Response, 2010, 8(2): 172-191.
7 Brooks A L1, Eberlein P E, Couch L A, et al. The role of dose-rate on risk from internally-deposited radionuclides and the potential need to separate dose-rate effectiveness factor (DREF) from the dose and dose-rate effectiveness factor (DDREF) [J]. Health Physics, 2009, 97(5): 458-69.
8 Preston R J, Jr Boice J D, Brill A B, et al. Uncertainties in estimating health risks associated with exposure to ionising radiation [J]. Journal of Radiological Protection, 2013, 33(3): 573- 588.
9 Brooks A L, Dauer L T. Advances in radiation biology: effect on nuclear medicine [J]. Seminars in Nuclear Medicine, 2014, 44(3): 179-186.
10 Dachev T, Horneck G, Häder D P, et al. Time profile of cosmic radiation exposure during the EXPOSE-E Mission: The R3DE Instrument [J]. Astrobiology, 2012, 12(5): 403-411.
11 Berger T, Hajek M, Bilski P, et al. Cosmic radiation exposure of biological test systems during the EXPOSE-E mission [J]. Astrobiology, 2012, 12(5): 387-392.
12 Schoenfeld M P, Ansari R R, Nakao A, et al. A hypothesis on biological protection from space radiation through the use of new therapeutic gases as medical counter measures. [J]. Medical Gas Research, 2012, 2: 8.
13 闵锐. 电离辐射的原发和继发效应及危害评价 [J]. 辐射研究与辐射工艺学报. 2013, 31(4): 1-5 MIN Rui. Primary and secondary effects induced by ionizing radiation and their hazard evaluation [J]. Journal of Radiation Research and Radiation Processing, 2013, 31(4): 1-5.
14 Choi V W, Ng C Y, Kobayashi A, et al. Bystander effect between zebrafish embryos in vivo induced by high-dose X-rays. [J]. Environmental Science & Technology, 2013, 47(12): 6368-6376.
15 Soleymanifard S, Toossi M T, Samani R K, et al. Investigation of the bystander effect in MRC5 cells after acute and fractionated irradiation in vitro. [J]. Journal of Medical Physics, 2014, 39(2): 93-97.
16 Seth I, Schwartz J L, Stewart R D, et al. Neutron exposures in human cells: bystander effect and relative biological effectiveness [J]. PLoS One, 2014, 9(6): e98947.
17 Prise K M, Folkard M, Kuosaite V, et al. What role for DNA damage and repair in the bystander response? [J]. Mutation Research, 2006, 597(1-2): 1-4.
18 Frey B, Rubner Y, Wunderlich R, et al. Induction ofabscopal anti-tumor immunity and immunogenic tumor cell death by ionizing irradiation - implications for cancer therapies. [J]. Current Medicinal Chemistry, 2012, 19(12): 1751-1764.
19 Golden E B, Demaria S, Schiff P B, et al. An abscopal response to radiation and ipilimumab in a patient with metastatic non-small cell lung cancer [J]. Cancer Immunology Research, 2013, 1(6): 365-372.
20 Strigari L, Mancuso M, Ubertini V, et al. Abscopal effect of radiation therapy: Interplay between radiation dose and p53 status [J]. International Journal of Radiation Biology, 2014, 90(3): 248-255.
21 Tubiana M, Aurengo A, Averbeck D. et al. Dose-effect relationship and estimation of the carcinogenic effects of low doses of ionizing radiation: the joint report of the Académie des Sciences (Paris) and of the Académie Nationale de Médecine [J]. International Journal of Radiation Oncology · Biology · Physics, 2005, 63(2): 317-319.
22 Mancuso M, Leonardi S, Giardullo P, et al. Oncogenic radiation abscopal effects in vivo: interrogating mouse skin [J]. International Journal of Radiation Oncology · Biology · Physics, 2013, 86(5): 993-999.
23 Mancuso M, Giardullo P, Leonardi S, et al. Dose and spatial effects in long-distance radiation signaling in vivo: implications for abscopal tumorigenesis [J]. International Journal of Radiation Oncology · Biology · Physics, 2013, 85(3): 813-819.
24 Aravindan S, Natarajan M, Ramraj S K, et al. Abscopal effect of low-LET γ-radiation mediated through Rel protein signal transduction in a mouse model of nontargeted radiation response [J]. Cancer Gene Therapy, 2014, 21(2): 54-59.
25 Miousse I R, Shao L, Chang J, et al. Exposure to low-dose56Fe-ion radiation induces long-term epigenetic alterations in mouse bone marrow hematopoietic progenitor and stem cells [J]. Radiation Research, 2014, 182(1): 92-101.
26 Szumiel I. Ionising radiation-induced oxidative stress, epigenetic changes and genomic instability: the pivotal role of mitochondria [J]. International Journal of Radiation Biology, 2014, 17: 1-55.
27 Jacquet P. Developmental defects and genomic instability after x-irradiation of wild-type and genetically modified mouse pre-implantation and early post-implantation embryos [J]. Journal of Radiological Protection, 2012, 32(4): R13-36.
28 Jacquet P, Buset J, Neefs M, et al. Transgenerational developmental effects and genomic instability after X-irradiation of preimplantation embryos: studies on two mouse strains [J]. Mutation Research, 2010, 687(1-2): 54-62.
29 Karotki A V, Baverstock K. What mechanisms/processes underlie radiation-induced genomic instability? [J]. Cellular and Molecular Life Sciences, 2012, 69(20): 3351-3360.
30 Morgan W F. Non-targeted and delayed effects of exposure to ionizing radiation: I. Radiation-induced genomic instability and bystander effects in vitro [J]. Radiation Research, 2012, 178(2): AV223-36.
31 Assadi N, Zabihi E, Khosravifarsani M, et al. Radioadaptive response in human lymphocyte cells [J]. International Journal of Molecular Medicine, 2014, 3(1): 57-60.
32 Tapio S, Jacob V. Radioadaptive response revisited [J]. Radiation and Environmental Biophysics, 2007, 46: 1-12. 33 Moskalev A A, Plyusnina E N, Shaposhnikov M V. Radiation hormesis and radioadaptive response in Drosophila melanogaster flies with different genetic backgrounds: the role of cellular stress-resistance mechanisms [J]. Biogerontology, 2011, 12(3): 253-263.
34 Redpath J L. Suppression of neoplastic transformation in vitro by low doses of low let radiation [J]. Dose Response, 2006, 4: 302-308.
35 Zeng G, Day T K, Hooker A M, et al. Non-linear chromosomal inversion response in prostate after low dose X-radiation exposure [J]. Mutation Research, 2006, 602: 65-73.
36 Esposito G, Campa A, Pinto M, et al. Adaptive response: modelling and experimental studies [J]. Radiation Protection Dosimetry, 2011, 143(2-4): 320-324.
37 Doss M. Low dose radiation adaptive protection to control neurodegenerative diseases [J]. Dose Response, 2013, 12(2): 277-287.
38 Lall R, Ganapathy S, Yang M, et al. Low-dose radiation exposure induces a HIF-1-mediated adaptive and protective metabolic response [J]. Cell Death & Differentiation, 2014, 21(5): 836-844.
39 Wodarz D, Sorace R, Komarova N L. Dynamics of cellular responses to radiation [J]. PLoS Computational Biology, 2014, 10(4): e1003513.
40 Jolly D, Meyer J. A brief review of radiation hormesis [J].Australasian Physical & Engineering Sciences in Medicine, 2009, 32(4): 180-187.
41 Scott B. Low-dose-radiation activated natural protection and LNT [J]. Health Physics, 2011, 100(3): 337-339.
42 Tang F R, Loke W K. Molecular mechanisms of low dose ionizing radiation induced hormesis, adaptive responses, radioresistance, bystander effects, and genomic instability [J]. International Journal of Radiation Biology, 2014, 30: 1-68.
43 Scott B R, Bruce V R, Gott K M, et al. Small γ-ray doses prevent rather than increase lung tumors in mice [J]. Dose Response, 2012, 10(4): 527-540.
44 Crump K S, Duport P, Jiang H, et al. A meta-analysis of evidence for hormesis in animal radiation carcinogenesis, including a discussion of potential pitfalls in statistical analyses to detect hormesis [J]. Journal of Toxicology and Environmental Health Part B: Critical Reviews, 2012, 15(3): 210-231.
45 Alexander M V. Radiation hormesis: Historical perspective and implications for low-dose cancer risk assessment [J]. Dose-Response, 2010, 8: 172-191.
46 Lawrence T D, Antone L B, David G H, et al. Review and evaluation of updated research on the health effects associated with low dose ionizing radiation [J]. Radiation Protection Dosimetry, 2010, 140(2): 103-136
47 Aaron R, James A, Robin L, et al. The cellular and molecular carcinogenic effects of radon exposure: a review [J]. International Journal of Molecular Sciences, 2013, 14: 14024-14063.
48 Patricia K N, Joseph C W. Radiation exposure from imaging tests: is there an increased cancer risk? [J]. Expert Review of Cardiovascular Therapy, 2011, 9(2): 177-183.
49 Keiji S, Shunichi Y. Low-dose radiation exposure and carcinogenesis [J]. Japanese Journal of Clinical Oncology, 2012, 42(7): 563-568.
50 William F M, William J B. Issues in low dose radiation biology: the controversy continues. A perspective [J]. Radiation Research, 2013, 179(5): 501-510.
Biological effects induced by low dose/low dose rate ionizing radiation
MIN Rui
(Institute of Warship Radiation, Department of Naval Medicine, Second Military Medical University of PLA, Shanghai 200433, China)
Differing from high dose/high dose rate ionizing radiation which only induce an acute tissue damage effect when interacting with organisms, low dose/low dose rate ionizing radiation will induce chronic stochastic effects, hormetic effects and adaptive response under certain conditions. In this paper, the definition of low dose/low dose rate radiation and some theoretical and practical problems currently existing in the biological effect research of the low dose/low dose rate radiation, a systematic review of the biological effects induced by low dose/dose rate radiation and some characteristics of the effects are introduced.
Low dose/low dose rate ionizing radiation, Non target effect, Adaptive response, Hormetic effect
R14,TL1
10.11889/j.1000-3436.2014.rrj.32.060101
闵锐,男,1957年9月出生,1994年毕业于第三军医大学预防医学系防原医学专业,获博士学位,现任第二军医大学海军医学系教授,博士生导师,E-mail:minrui021@hotmail.com
初稿2014-08-11;修回2014-09-18
CLCR37, TL1

