大鼠膝关节骨性关节炎动物模型的两种实验方案
钱 洁, 邢雪松, 梁 军
(1. 同济大学 生命科学与技术学院,上海 200092; 2. 高淳区医保中心, 江苏 南京 211300; 3. 高淳区双塔医院,江苏 南京 211300)
0 引 言
骨性关节炎是一种多发于中老年的慢性进行性骨关节病,主要累及关节软骨、软骨下骨质、滑膜、关节囊及关节的其他结构,是老年人关节疼痛和致残的首要原因,给社会带来严重负担和大量资源的消耗。由于骨关节炎的病因和发病机制还不明确,因此临床上尚缺乏根本的治疗手段,治疗效果也往往难以令人满意,对骨性关节炎关节软骨修复的研究受到很大限制,因此,建立骨性关节炎的动物模型是研究骨关节炎发病机制、预防及治疗研究的必要手段,将能更好地理解骨性关节炎的发病机制,为其预防及治疗提供理论依据[1-2]。
本文观察切断前交叉韧带模型及膝关节制动这两种实验方案诱导发生骨性关节炎不同分期的病理特点,并对比探讨两种模型产生骨性关节炎的病理机理。
1 材料与方法
1.1 实验动物
Sprague-Dawley雄性大鼠30只,8周龄,体重200~220 g(SPF级无特定病原体),同济大学动物实验中心提供。随机分为A组(前交叉韧带切断组,15只)和B组(膝关节制动组,15只),每组又按时间分为3、6及8周3组(每组5只)。每组左侧膝关节为实验组,右侧对照。实验大鼠均分笼饲养,自由活动,自然光照,自由饮食。饲养温度20~23 ℃,相对湿度为50%~55%。
1.2 动物模型的建立
A组:前交叉韧带横断模型(ALCT 模型)。大鼠用30 g/L戊巴比妥钠按30 mg/kg量行腹腔麻醉,常规备皮消毒膝关节,取左髌旁内侧切口显露膝关节,切开关节囊,打开关节腔,将髌骨向外侧脱位,尽量屈曲膝关节显露前交叉韧带,在直视下用小尖刀切断前交叉韧带,行抽屉试验确定前交叉韧带断裂,术中不损伤软骨面,彻底止血,将髌骨复位,逐层关闭切口。对照组作为假手术组,经同样方式进入膝关节,切开关节囊,打开关节腔,将髌骨脱位,屈曲膝关节显露前交叉韧带,不切断交叉韧带,然后复位髌骨,闭合关节腔。术后大鼠不做任何固定措施,每日肌注青霉素40万U一次,连续3 d。
B组:膝关节制动模型。将医用棉脂垫于大鼠左侧踝至髋关节之间,以石膏绷带均匀固定5~6层,将左膝关节固定于伸直180°位,固定。对照组不做特殊处理。务必注意:①大鼠啃咬石膏,须及时修补;②管型石膏固定松紧应适宜,过紧影响肢体血运,过松则容易脱落,须严密观察固定侧肢体末端血运及石膏有无松脱,如发现足部肿胀明显或石膏脱落时,及时调整石膏或重新固定。
1.3 标本取材及处理
1.3.1大体观察
实验组动物(A组和B组)分别于造模后第3、6及8周采用颈椎脱臼法处死,打开膝关节,观察膝关节有无关节积液、滑膜肿胀。
1.3.2光镜标本的取材与处理
实验组动物(A组和B组)分别于造模后第3、6及8周采用颈椎脱臼法处死,取膝关节股骨内髁负重部,常规脱钙、脱水、石蜡包埋、切片待后HE及甲苯胺蓝染色、光镜观察及免疫组化检测等。
1.4 检测项目及方法
1.4.1苏木素-伊红(HE)染色
光镜下观察关节软骨关节面、软骨细胞、软骨基质、潮线等情况,由2位独立的观察者按Mankin’s 评分原则为切片评分,取两者平均值作为Mankin’s得分。分级标准:0~1分为正常软骨;2~6分为早期骨关节炎;7~10分为中期骨关节炎;11~14分为晚期骨关节炎。
1.4.2甲苯胺蓝染色
采用Image-Pro plus 6.0图像分析系统,每个标本取5个视野,10×40高倍镜下测定单位面积阳性染色平均吸光度值,用以半定量表示细胞基质中蛋白多糖的含量。
1.4.3II型胶原免疫组化染色
购Ⅱ型胶原多克隆抗体、免疫组化染色SP试剂盒(武汉博士德生物有限公司),PBS代替一抗为阴性对照。免疫组化实验步骤按照说明书操作。采用Image-Pro plus 6.0图像分析系统,每个标本取5个视野,10×40高倍镜下测定单位面积阳性染色平均吸光度值,半定量表示细胞基质中II型胶原纤维的含量。
1.4.4TUNEL软骨细胞凋亡染色
购原位细胞凋亡检测试剂盒(Tunel,脱氧核糖核苷酸末端转移酶介导的dUTP缺口末端标记法。武汉博士德生物工程有限公司),步骤参照试剂盒说明。采用Image-Pro plus 6.0图像分析系统,每个标本取5个视野,10×40高倍镜下测定单位面积染色平均吸光度值,用以半定量表示软骨细胞凋亡的数量。
1.5 统计方法
用SPSS13.0软件对计量资料进行统计学分析,计量资料以均数±标准差表示。两组之间的比较采用t检验,检验水准α=0.05,P<0.05表示差异有统计学意义。
2 结 果
2.1 实验动物的一般观察
术后第1 d,前交叉韧带切断组:精神状态及进食饮水较差,活动明显减少,术后第3 d实验组动物精神状态及进食良好,开始自由活动,切口未见明显感染症状。膝关节制动组:精神状态及饮食良好,活动明显减少,制动后第2 d实验动物可以带石膏板缓慢活动。3~5 d后,实验动物可自由活动。
2.2 关节标本的大体观察
实验中对照组膝关节滑膜大体正常,关节软骨表面呈淡蓝白色,光滑明亮表面完整;实验组大鼠膝关节随着饲养时间的延长,关节及滑膜肿胀逐渐加重,膝关节制动组8周时可见软骨面失去正常光泽。
2.3 关节软骨的Mankin评分
各实验组关节软骨Mankin评分结果见表1。
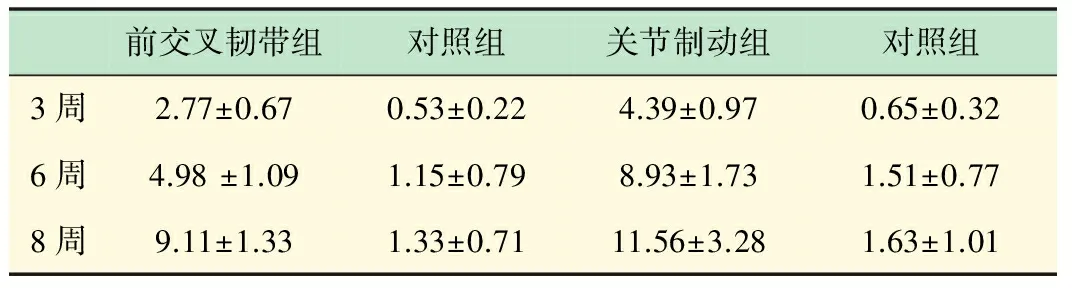
表1 各实验组关节软骨Mankin评分结果比较(x±s)
两组实验关节软骨损伤Mankin评分均随实验时间延长而加重(P<0.05),同实验时间关节制动组Mankin评分高于前交叉韧带切断组(P<0.05)。以Mankin分级标准,前交叉韧带切断组造模6周为早期OA,8周为中期OA;关节制动组造模3周为早期OA,6周为中期OA,8周为晚期OA。
2.4 蛋白多糖含量
各组甲苯胺兰染色吸光度比较见表2。
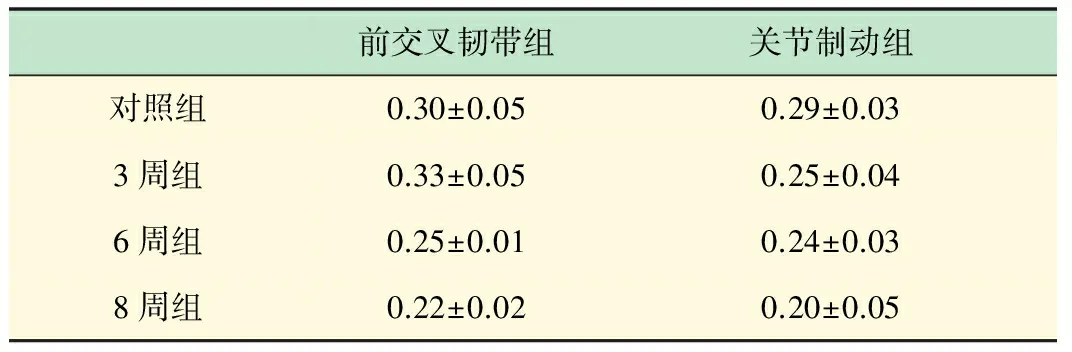
表2 各实验组关节软骨甲苯胺兰染色吸光度比较(x±s)
与对照组相比,前交叉韧带切断3周组PG的含量明显增加,而6周、8周组PG的含量明显减少,P<0.05,8周组PG的含量比6周组也减少明显,P<0.05。关节制动各实验组与对照组相比以及各实验组随时间延长软骨PG的含量都有明显减少P<0.05,表明关节制动3周以上可以明显减少软骨PG的含量,并且8周内随持续时间加长而减少越明显。
2.5 II胶原纤维含量
各组关节软骨II胶原纤维免疫组化染色吸光度比较见表3。
与对照组相比,前交叉韧带切断3周组的含量明显增加而6周、8周组含量明显减少,P<0.05,8周组含量比6周组也明显减少P<0.05。为0.39±0.04,3周组0.35±0.05,6周组0.32±0.07,8周组0.24±0.03,关节制动各实验组与对照组相比以及各实验组随时间延长软骨II型胶原纤维的含量都明显减少P<0.05,表明关节制动3周以上可以明显减少软骨基质II型胶原纤维的含量,并且8周内随持续时间加长而减少越明显。
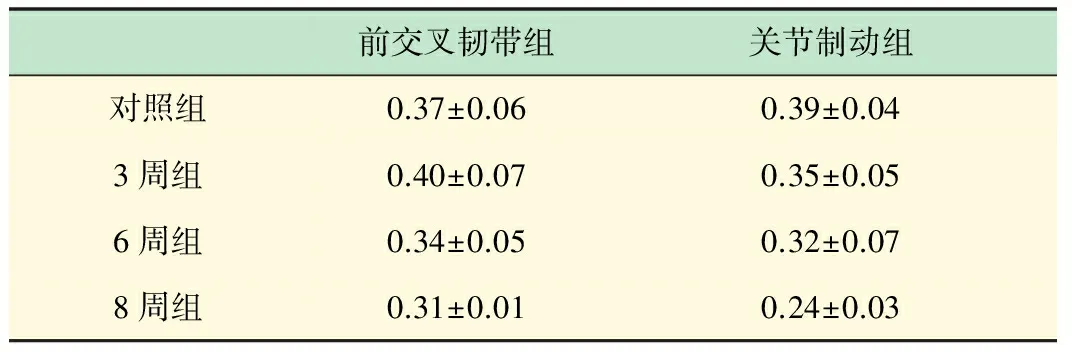
表3 各实验组关节软骨II型胶原免疫 组化染色吸光度比较(x±s)
2.6 软骨细胞凋亡
各组关节软骨TUNEL法软骨细胞凋亡染色吸光度比较见表4。
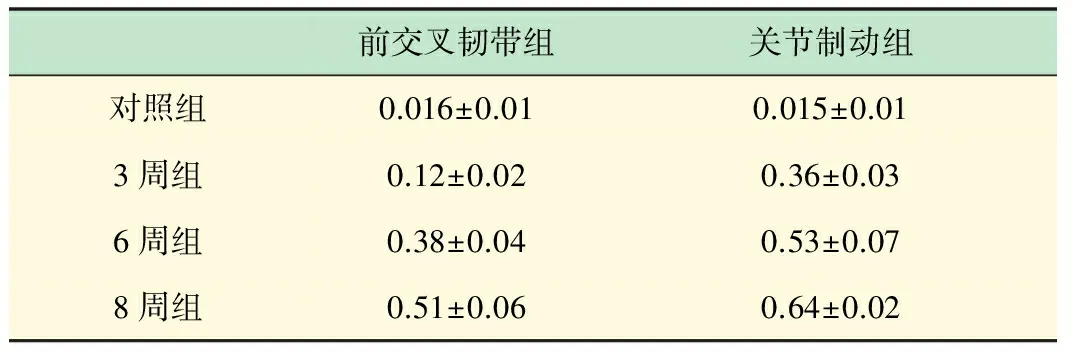
表4 各实验组关节软骨TUNEL染色吸光度比较(x±s)
前交叉韧带切断实验组组与对照组相比以及各实验组间软骨细胞凋亡都有明显差异P<0.05,随持续时间延长而增加越明显。关节制动组与对照组相比以及各实验组间软骨细胞凋亡都有明显增多,P<0.05,表明关节制动3周以上可以明显增加软骨细胞凋亡,并且8周内随持续时间加长而越明显。与韧带组相比,关节制动组3周即出现明显软骨细胞凋亡,相同持续时间内,制动组软骨细胞凋亡明显增多,P<0.05。
3 讨 论
3.1 前交叉韧带切断模型的病理分期及特点
前交叉韧带切断后造成关节不稳,改变其力学环境可能导致膝关节骨性关节炎的发生。有实验将犬膝关节前交叉韧带切断,观察到实验肢体的发展过程和自然发生(前交叉韧带破裂所致) 关节不稳定相一致,并且其最后的病理表现与骨关节炎相似[3]。王君等[4]在切除兔前交叉韧带的基础上固定手术对侧肢体使手术侧肢体过度负重形成兔膝负重模型,该模型造模时间较单纯切断前交叉韧带造模时间短。Stoop 等[5]切断Wistar大鼠的膝关节前交叉韧带,于第2、7、14、28、70 d 处死动物,取膝关节软骨常规组织学及免疫组化检测变性的Ⅱ型胶原,在前交叉韧带切断后软骨损害最早改变发生于表层带的软骨细胞和软骨基质;术后14 d 出现表层带软骨细胞肿胀,表层带纤维化。术后4周、10周,上述改变更明显。作者认为软骨表层早期机械性超负载诱发软骨退变,关节软骨的退变与Ⅱ型胶原降解产物的局部表达有关,胶原酶在关节软骨退变中发挥重要的作用。
本实验动态观察膝关节不稳定3、6、8周时关节软骨细胞、胶原纤维及蛋白多糖的形态学变化。甲苯胺兰染色是特异性结合基质中蛋白多糖,其深浅反映蛋白多糖的多少。通过吸光度来反映蛋白多糖、胶原纤维含量,从结果可知制模后软骨细胞中胶原纤维、蛋白多糖先升高后逐步减少,表现为3周组中TUNEL无明显变化,II型胶原、甲苯胺兰染色比正常对照组加深,尤其在软骨细胞周围和胞浆内染色加深更明显,提示软骨细胞代偿性代谢旺盛,分泌蛋白多糖和胶原,可能是软骨细胞对骨性关节炎病变的一种修复反应。6周和8周组,随着病程发展,到骨性关节炎中晚期(6周后)II型胶原降解的量大于合成的量,软骨基质中胶原总量减少,软骨形态结构和功能明显受损,胶原合成也降低,甲苯染色浅淡,部分区域软骨全层染色消失,软骨细胞凋亡数目增多,变性坏死逐渐加重,表明随骨关节炎病变的发展,软骨基质合成降低,基质破坏也由表层向深层发展。以Mankin评分来判定,实验6周为早期OA,实验8周为中期OA。
关节不稳定时,由于关节应力发生变化(局部增大或减小)会造成关节的退行性改变,从而导致骨关节炎的发生。关节不稳定造成关节内外力学改变,长期以往使关节软骨承受间歇性压力的糖蛋白逐渐减少,软骨脱水,胶原纤维显露,致关节软骨退变进行性加重[6-7]。
3.2 关节固定模型的病理分期及特点
肢体制动作为一种常用的治疗或辅助治疗手段广泛应用于各种骨与软组织疾病和创伤中,然而制动也会对所涉及的骨关节结构造成新的损伤。关节制动也是诱发模型最常用的方式[4],膝关节制动模型是在不损伤关节稳定性的情况下,通过关节制动来诱导大鼠膝关节软骨发生退变。将动物的关节长期固定于某一位置,限制了关节的运动,肌肉、关节囊收缩,对关节面产生了过度压力,而且因减少了横跨膝关节的肌肉的收缩而导致关节软骨的萎缩性变化,这样便可导致OA 的发生[8];制动后4周即出现X线改变,镜下可见软骨有糜烂灶,纤维网增粗断裂消失[9]。有研究发现7~14 d关节软骨出现早期退变,28 d中度,42 d严重[10]。动物实验表明,无论是短期的反复制动或是持续性制动,若制动时间超过30 d,则可导致关节软骨的进行性破坏、进行性OA的发生[3,11]。关节制动60 d后,关节软骨的变化无法逆转[9,12]。
本实验通过对大鼠膝关节制动时间的动态观察发现,制动后3周即有软骨细胞凋亡的发生,且凋亡主要发生在表层软骨细胞,甲苯胺兰混染,免疫组化低,蛋白多糖、II型胶原含量减少,6周后凋亡呈进展趋势,出现中层和表层软骨细胞凋亡,甲苯染色浅淡,部分区域软骨全层染色消失,提示基质合成降低,8周软骨细胞凋亡进一步增多,软骨细胞变性坏死逐渐加重,甲苯染色全层消失,II型胶原明显降低。以Mankin评分来判定,膝关节制动模型组实验3周为早期,实验6周为中期OA,实验8周为晚期OA。
正常关节软骨的营养绝大多数来自于关节滑液。Pedowitz等[13-14]认为,关节活动对软骨营养传递极其重要,关节活动造成关节软骨受压与减压交替,在滑液流动中,带入营养物质,带走代谢产物,形成所谓“软骨泵”的软骨营养机制。正常应力环境对维持关节软骨的营养和完整性有非常重要的作用。关节活动刺激软骨细胞合成活跃,反之则合成减少,软骨丢失。关节固定可造成软骨压力泵作用消失、滑膜向软骨浸润并与软骨粘连、肌肉关节囊挛缩使关节面压力升高、软骨细胞营养障碍,诱发关节软骨萎缩使软骨变薄水肿,蛋白聚糖含量下降、结构改变,同时胶原合成及含量的减少,最终导致OA。研究显示,高流体静压可以降低葡萄糖转运蛋白的活性,静压负荷可以改变细胞内pH值和离子强度,使蛋白多糖的硫酸化过程受阻,从而对软骨细胞合成基质的能力造成影响。制动和其他因素使关节免于负重的方法也导致关节软骨未钙化的部分变薄、变软以及软骨下血管出芽的增多和蛋白多糖成分的减少[15]。
3.3 两种模型的对比
骨关节炎是机械性和生物性因素相互作用,使关节软骨细胞、细胞外基质和软骨下骨合成与降解失去平衡的结果。胶原和蛋白多糖是关节软骨细胞外基质主要组成成分,是软骨表面张力的决定因素[16]。正常软骨中软骨细胞合成的大量胶原纤维(主要是II型胶原)、蛋白多糖等物质分泌到细胞外基质中[17],构成细胞外纤维网架,支持和保护软骨细胞,两者相辅相成相互作用[18]。目前研究认为,关节软骨细胞凋亡是骨关节炎的发病的主要原因。TUNEL法分析结果显示骨关节炎组软骨细胞凋亡明显高于正常组,细胞凋亡在骨关节炎病变区高于非病变区。胶原是重要的细胞外基质成分,II型胶原质和量的改变是导致骨关节软骨丧失其正常生物力学特性的直接原因,其变化与骨关节炎有着密切的关系,II型胶原的改变是关节软骨丧失其正常生物力学特性的直接原因[10]。
由于不同方法建立的骨性关节炎模型的病变特点及病理分期不尽相同,根据不同的方法所建立的OA模型,对后期实验的影响及后继治疗方法的选择不尽一致。切断前交叉韧带法和膝关节制动法均可以成功制作膝关节退变模型,能够比较全面反映骨性关节炎关节软骨退变的病理过程,但两种方法诱发的骨性关节炎模型也存在一定的差异。
本实验发现前叉切断后首先的病理改变发生在软骨表面,表现为软骨失去光泽、软化和纤维化等,这些退变与局部胶原降解产物表达有关。蛋白多糖胶原先升后降提示关节不稳定早期,关节软骨是损伤和修复并存,如治疗不及时,更多的软骨细胞将出现变性坏死,胶原纤维和蛋白多糖合成受阻,最终软骨剥脱;固定组蛋白多糖胶原逐周减低,病理进程也发现与韧带组同样变化但较前叉组明显快且严重,3周时细胞凋亡已很明显,说明软骨退变更加明显,Mankin评分也反映相似的软骨退变情况。前交叉韧带切断模型造模时间较长,实验6周为早期OA,实验8周为中期OA,基质分解流失是其首动因素;膝关节制动模型组实验3周即为早期OA,实验6周为中期OA,实验8周为晚期OA,软骨细胞损伤和基质分解共同发生作用是其病理特点。
4 结 语
本研究通过切断前交叉韧带法和膝关节伸直位制动法两种实验方案建立大鼠膝关节骨性关节炎模型,交叉韧带的损伤可以明显导致膝关节的不稳定,不给予处理可以诱发早期的、与年龄无关的关节软骨退变;较长时间(3周)的关节制动可以引起关节软骨的萎缩及关节的僵硬,最终引起关节软骨的退变。后期的研究中我们用主动运动来分别干预这两种骨性关节炎模型,观察主动运动对两种模型的影响。
[1] Marijnissen A C, van Roermund P M, Verzijl N,etal. Steady progression of osteoarthritic features in the canine groove model [J]. Osteoarthritis Cartilage, 2002, 10(4): 282-289.
[2] Batiste D L, Kirkley A, Laverty S,etal. Exvivo characterization of articular cartilage and bone lesions in a rabbit ACL transection model of osteoarthritis using MR I and micro-CT [J]. Osteoarthritis Cartilage, 2004, 12(12): 986-996.
[3] 江捍平,王大平. 骨关节炎动物模型[ J ]. 中国现代医学杂志,2004, 14(6): 153-156.
JIANG Han-ping, WANG Da-ping. Osteoarthritis animal model [J]. China Journal of Modern Medicine, 2004, 14(6): 153-156.
[4] 王 君,何炳书,李笑萍. 兔膝骨关节炎负重模型的建立[J]. 中国老年学杂志, 2005, 25(9): 1079-1080.
WANG Jun, HE Bing-shu, LI Xiao-ping. Weight-bearing rabbit model of knee osteoarthritis [J]. Chinese Journal of Gerontology, 2005, 25(9): 1079-1080.
[5] Stoop R, Buma P, van der Kraan M,etal. Type Ⅱcollagen degradation in articular cartilage fibrillation after anterior cruciate ligament transection in rats [J ]. Osteoarthritis Cartilage, 2001(9): 308-315.
[6] 刘蜀彬,孔祥星,黄迅悟,等.股骨干骺端髓内血运阻断诱发兔膝关节骨性关节炎模型[J].中国矫形外科杂志,2003,11(24):1706-1707.
LIU Shu-bin, KONG Xiang-xing,HUANG Xun-wu,etal. An Experimental Osteoarthritic Model Induced by InterruptingMedullary Blood Supply of Distal Femoral Metaphysis in Rabbit [J]. Orthopedic Journal of China, 2003,11(24):1706-1707.
[7] Dorotkaa R, Windbergerb U, Macfeldab K,etal. Repair of articular cartilage defects treated by microfacture and a three-dimensional collagen matrix [J]. Biomaterials, 2005, 26(17):3617-3629.
[8] 聂 林. 骨关节炎的动物模型[J]. 中华实验外科杂志, 1990, 7(2): 96-97.
NIE Ling. Osteoarthritis animal model [J]. Chinese Journal of Experimental Surgery, 1990, 7(2): 96-97.
[9] 邱贵兴,王桂生.兔膝关节制动引起关节软骨退变的实验研究[J],中华外科杂志,1987,25(3):175-177.
QIU Gui-xing, WANG Gui-sheng. Experimental study of rabbit articular cartilage degeneration caused by knee brake [J]. Chinese Journal of Surgery, 1987,25(3):175-177.
[10] Okazaki R, Sakai A, Dotsuyama A,etal. Apoptosis and p53 expression in chondrocytes Relate to Degeneration in Articular Cartilage of Immobilized knee Joints [J], Rheumatol, 2003, 30 (3):559-566.
[11] Evans EB, Eggers GWN, Butler JK,etal. Experimental immobilization and remobilization of rat knee joints [J]. J Bone Joint Surg, 1960, 42(A) : 737.
[12] 刘伯龄,刘献祥.骨性关节炎动物模型的建立概况[J].福建中医药,2003,34(4):49-50.
LIU Bo-ling, LIU Xain-xiang. Overview establish an animal model of osteoarthritis [J]. Fujian Journal of Traditional Chinese Medicine, 2003, 34(4):49-50.
[13] Pedowitz R A, Gershuni D H. Crenshaw AG,etal. Intraarticular pressure during continuous passive motion of the human knee [ J ]. J Orthop Res,1989(7): 530-541.
[14] Mow V C, Jolmes M H, Lai W H. Fluid transport and mechanical properties of articular cartilage: a review [J]. J Biomechanics, 1984,17: 377-382.
[15] Moses M A, Sudhalter J, Lanqer R. Identification of an inhibiter of neovascularization from cartilage[J]. Science, 1999,248(4961):1408-1410.
[16] Christgau S, Garnero P, Fledelius C, etal. Collagen type II C-telopeptide fragments as an index of cartilage degradation [J]. Bone, 2001,29(3):209-215.
[17] Milz S, Benjiamin M, Putz R. Molecular Parameters indicating adaptation to mechanical stress in fibrous connective tissue [J]. Adv Znat Embryol Cell Biot, 2005,178:71-74.
[18] 曹林忠. 细胞因子对关节软骨损伤修复影响的研究进展[J]. 广州医药,2009,40(1):5-7.
CAO Lin-zhong. Progress of cytokine effects on articular cartilage repairs [J]. Guangzhou Medical Journal, 2009,40(1):5-7.

