四种抗污染木本植物对锑的生理响应及积累特征研究
薛亮,高暝,史胜青,魏远,江泽平,刘建锋*
1. 中国林业科学研究院亚热带林业研究所,浙江 富阳 311400;2. 林木遗传育种国家重点实验室 中国林业科学研究院林业所,北京 100091
四种抗污染木本植物对锑的生理响应及积累特征研究
薛亮1,高暝1,史胜青2,魏远2,江泽平2,刘建锋2*
1. 中国林业科学研究院亚热带林业研究所,浙江 富阳 311400;2. 林木遗传育种国家重点实验室 中国林业科学研究院林业所,北京 100091
以臭椿(Ailanthus altissima)、构树(Broussonetia papyrifera)、大叶黄杨(Buxus megistophylla)和紫穗槐(Amorpha fruticosa)4种抗污染木本植物苗木为材料,在盆栽条件下设置0、250、500、1000和2000 mg·kg-15个锑的质量分数梯度,分析胁迫过程中苗木苗高、地径、生物量、耐性指数、相对叶绿素含量、POD活性和SOD活性等指标的变化,探讨这4种苗木对锑胁迫的生理响应,并通过测定苗木地上、地下部分锑的质量分数,明确这几种植物对锑的积累特征,以期为锑污染植物修复材料筛选提供理论基础。结果表明:在不同质量分数锑胁迫下,4种木本植物的苗高、地茎、生物量及耐性指数出现不同程度的下降,其中大叶黄杨在不同质量分数锑处理下的耐性指数均大于90%,表现出对锑较强的抗性。除大叶黄杨外,在中、中高质量分数(500、1000 mg·kg-1)锑处理后,其他3种木本植物叶片叶绿素含量较对照均显著下降。而在高质量分数锑胁迫下,4种木本植物的叶绿素含量与对照相比均显著下降,表明锑能通过影响植物的光合作用来降低这4种木本植物的生物量合成。在中高质量分数锑胁迫下,4种植物根系的POD和SOD活性均呈现不同程度的增加;在高质量分数锑胁迫下,臭椿、构树和紫穗槐的POD及SOD活性增加幅度减少或受到抑制,表明抗氧化酶系统在植物抵抗锑胁迫过程中发挥重要作用,同时高质量分数的锑胁迫又能降低抗氧化酶系统清除活性氧的能力。在不同质量分数的锑胁迫下,4种木本植物地上、地下部分锑的质量分数存在差异,分别为构树>紫穗槐>臭椿>大叶黄杨,紫穗槐>构树>臭椿>大叶黄杨,表明大叶黄杨可能通过对锑较强的排斥能力,减少锑对叶绿素合成、POD和SOD活性的抑制作用,近而增强了其对锑胁迫的抗性。固氮植物紫穗槐根系最大锑的质量分数达到418.27 mg·kg-1,且在各质量分数锑处理下均具有最大的富集系数BCF,可作为锑植物稳定的潜力树种。此外,这4种木本植物均可作为锑污染地区植被恢复过程中的先锋木本植物。
抗污染;木本植物;锑;生理响应;积累特征
锑及锑化物已被证实是一类具有基因毒性的物质,并对人体具有致癌作用(Huang等, 1998; Takahashi等, 2002; Beyersmann和Hartwig, 2008)。美国环境保护署和欧共体理事会已将锑列为优先治理污染物。我国是产锑大国,年均锑产量约为15万t,占世界总产量的70%以上(国土资源部信息中心, 2006)。由于对锑矿开采缺乏有效的规划与管理,以及对锑的不合理使用,致使土壤、水体及空气中锑含量急剧上升(Wei等, 2011; Wang等, 2011; Bi等, 2011)。以湖南省锡矿山锑矿区为例,该矿区土壤中锑的质量分数范围为100~5.05×103mg·kg-1。锑在环境中污染程度的加剧,促使其通过食物链严重威胁人类及整个生态系统的健康(Wu等, 2011; He等, 2012)。
植物修复是利用植物及共存微生物体系来清除环境中的污染物。植物修复因其经济、高效且相对安全的环境修复技术,正在被世界各国广泛应用和研究。其中,木本植物具有生物量大、生长快速及根系发达等优势,利用其对污染环境进行修复成为生物修复研究领域的一个热点(Wan和 Jia, 2010)。研究木本植物体内锑的积累特征及其对锑的响应机制,对开发木本植物锑修复技术具有重要的现实意义。
目前,可应用于锑污染修复的木本植物材料较少,且主要通过在矿区开展植物材料筛选获得(Anawar等, 2011; Jana等, 2012)。此外,关于木本植物对锑的生长及生理生化响应方面的研究尚未开展,锑的木本修复理论远落后于其他重金属。本文以4种抗污染木本植物为试验材料,对臭椿、构树、大叶黄杨和紫穗槐进行锑胁迫盆栽控制实验,开展木本植物对锑的生理响应及富集特征研究,为锑污染场地的木本植物修复提供材料及理论基础。
1 材料与方法
1.1 供试材料
供试材料来自于湖南省林业科学杜家冲试验林场的种质资源收集圃。地理坐标为东经113°1′30″,北纬 28°6′40″。土壤为四纪红色黏土,土壤pH为5.6,土壤有机质为2.63 g·kg-1,碱解氮为23.37 mg·kg-1,速效磷为4.8 mg·kg-1,有效钾为108 mg·kg-1。年平均气温 17.1 ℃,平均日照时数1496~1850 h,平均降雨量1400~1900 mm,无霜期264 d。本研究选取了大叶黄杨、臭椿、紫穗槐和构树4种典型抗污染木本植物,选择个体、分蘖和健康状况基本一致的二年生实生苗。
1.2 试验方法
采用温室盆栽控制实验,土壤锑质量分数参照我国主要锑矿区土壤锑质量分数,设置为0、250、500、1000和2000 mg·kg-15个质量分数梯度(He, 2007; 刘成佐等, 2007; Zhao等, 2009),每个处理6个重复,其中3个重复用于植物生长及生理指标测定,另外3个重复用于植物锑含量测定。供试土壤为湖南林科院林场内无污染第四纪红壤,土样风干、碾碎后过2 mm筛后混匀,每盆20 cm(径)×25 cm(高),装土为3 kg(干重)。2012年3月初完成苗木移植,5月初对供试苗木进行 KSb(OH)6胁迫处理。移栽后,用称重法补充水分,每隔3~5天等量浇入淡水一次,使土壤田间持水量保持在60%~70%。10月初测定植物根部抗氧化酶系统活性、叶绿素相对含量,收获所有植物检测锑含量。
1.3 指标测定
锑含量测定:植物样品用去离子水清洗约3 min以除去表面土壤颗粒,样品在 80 ℃烘干箱放置 2 d,随后用Wiley Mill(型号:Thomas Model 4, USA)碾碎,通过直径1 mm的过滤筛。土壤样品和植物样品分别用HCl:HNO3=3:1和HNO3:HCl: HF=6:3:1的混合溶液放于微波消解仪(型号:ETHOS1,意大利)进行消解,随后用荧光分光光度仪(型号:F-4500,日本)测定锑含量。
生理生化指标测定:植物叶片叶绿素含量用手持叶绿素仪(型号:SPAD 502,日本)测定叶中部的SPAD计数值,表示叶绿素相对含量。SOD活性采用氮蓝四唑还原法测定,一个单位的 SOD活性按照抑制氮蓝四唑光化还原50%的酶量作为1个酶活性单位(U),酶活性以U/mg蛋白表示。POD活性采用愈创木酚法测定,按照每mg组织蛋白每min使反应体系中底物愈创木酚的浓度改变1 µmol所需的酶量为1个酶活性单位(U),酶活性以U/(mg蛋白·min)表示。
1.4 数据分析
耐性指数(Tolerance index, TI)=重金属胁迫后植物的生物量/对照中植物的生物量(Wikins, 1978);富集系数(bioconcentration factor, BCF)=植物地下部分重金属质量分数/土壤重金属质量分数;转移系数(translocation factor, TF)=植物地上部分重金属质量分数/地下部分重金属质量分数;采用SPSS17.0软件对测定数据进行方差分析和差异显著性检验。采用Microsoft Excel 2003进行图形绘制。
2 结果
2.1 生长状况
在不同质量分数锑胁迫下,4种木本植物的苗高、地茎及生物量出现不同程度的下降。在中、低质量分数(250、500 mg·kg-1)锑胁迫下,臭椿、大叶黄杨、紫穗槐和构树的耐性指数均超过80%,对锑胁迫均表现出较强的耐受性。在中高、高质量分数(1000、2000 mg·kg-1)锑胁迫下臭椿、紫穗槐和构树的耐性指数显著下降,而大叶黄杨的耐性指数均高于90%。不同质量分数锑胁迫对构树、臭椿和紫穗槐有一定的毒害作用,且随着胁迫质量分数的增加,毒害作用逐渐增强,耐性指数降低;大叶黄杨没有受到明显的毒害,耐性指数较高(表1)。
2.2 相对叶绿素含量
4种植物的相对叶绿素含量由图1所示。在低质量分数(250 mg·kg-1)锑胁迫下4种木本植物的叶绿素含量与对照相比没有显著差异,未出现明显的黄化现象。除大叶黄杨外,在中、中高质量分数(500、1000 mg·kg-1)锑处理后,其他3种木本植物叶片叶绿素含量较对照均显著下降。而在高质量分数(2000 mg·kg-1)锑胁迫下,4种植物的叶绿素含量与对照相比均显著下降,少量叶片在叶缘出现黄化现象。
2.3 抗氧化酶系统活性
臭椿根系 POD活性开始随锑质量分数上升呈增加趋势,在高质量分数锑胁迫后 POD活性受到明显抑制(图2-a)。构树根系POD活性随锑质量分数上升呈增加趋势,而随着胁迫质量分数的增加活性的增加幅度逐渐降低,在中高和高质量分数锑胁迫下POD活性差异不显著(图2-b)。大叶黄杨根系 POD活性在低、中和中高质量分数锑胁迫下差异不显著,仅在高质量分数锑胁迫下显著上升(图2-c)。与对照相比,紫穗槐根系POD活性先随锑处理质量分数上升呈增加趋势,至高质量分数锑胁迫时POD活性的增加受到显著抑制(图2-d)。经锑处理后,臭椿根系的 SOD活性均显著高于对照,在中高质量分数锑胁迫下达到最大值,较对照增加13.0%(图3-a)。大叶黄杨根系的SOD活性在低、中质量分数锑胁迫下与对照差异不显著,在中高和高质量分数锑处理后显著增加(图3-c)。构树和紫穗槐根系的 SOD活性先随胁迫质量分数的上升而增加,在中质量分数达到最大值,在高质量分数锑胁迫下SOD活性均受到不同程度抑制(图3-b,图3-d)。

表1 锑胁迫下四种木本植物生长状况Table 1 Growth conditions of four woody plants under Sb stress

图1 锑胁迫下4种木本植物相对叶绿素含量Fig. 1 Relative chlorophyll content of four woody plants under Sb stress
2.4 植物重金属积累特征

图2 锑胁迫下4种木本植物POD活性Fig. 2 Activities of POD in four woody plants under Sb stress
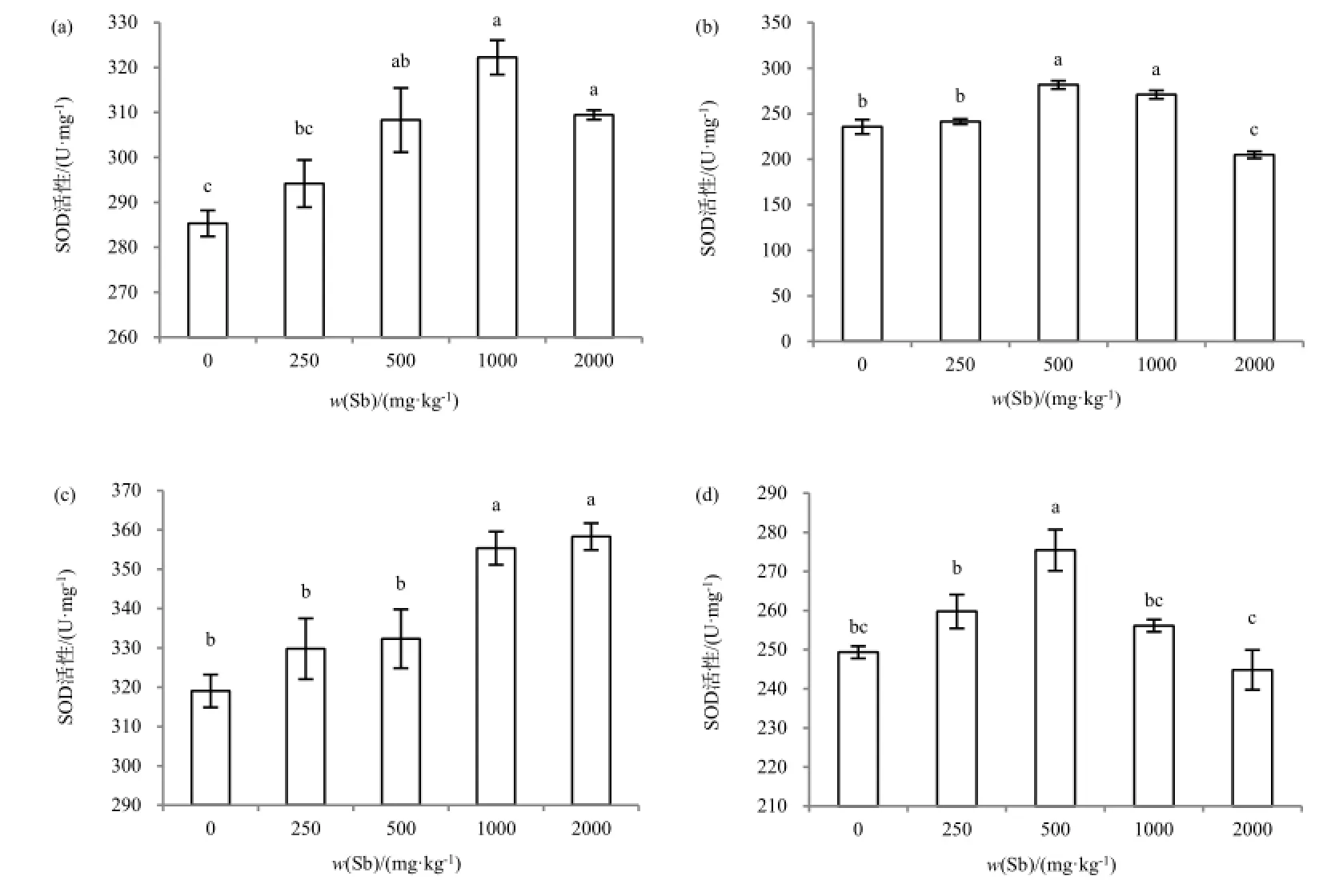
图3 锑胁迫下4种木本植物SOD活性Fig. 3 Activities of SOD in four woody plants under Sb stress
4种木本植物根部和地上部组织中锑的质量分数如表2所示。所有木本植物地下及地上部分重金属含量随着胁迫质量分数的增强而上升。其中,根系是锑在这4种植物体内的主要积累部位。在不同质量分数锑胁迫下,4种木本植物地上部分的锑质量分数大小均为构树>紫穗槐>臭椿>大叶黄杨,其中构树在高质量分数锑胁迫下的最大锑质量分数为108.33 mg·kg-1。在各种锑质量分数胁迫下,4种木本植物根系的锑质量分数大小均为紫穗槐>构树>臭椿>大叶黄杨,其中紫穗槐在高质量分数锑胁迫下具有最大的锑质量分数为418.27 mg·kg-1。
4种木本植物对锑的富集系数(BCF)和转移系数(TF)如表3所示。4种木本植物的BCF均随着胁迫质量分数的增加而减少,表明这些木本随着锑胁迫质量分数的增加其富集能力下降。紫穗槐在各质量分数锑处理下均有最大的BCF,锑富集能力高于其他3种木本植物。同时,构树具有最大的TF,表现出较强的锑转移能力。

表2 4种木本植物根部和地上部组织中锑的质量分数Table 2 Sb mass fraction in root and shoot of four woody plants
3 讨论
植物对重金属的耐受能力是植物修复技术成功应用的重要前提。植物体内 Sb的正常水平和毒性水平分别为 0.01~0.1 mg·kg-1和 5~10 mg·kg-1(Kabata-Pendias和Pendias, 1984; Kabata-Pendias和Pendias, 2000)。本研究中4种木本植物内体锑的含量均显著高于其植物毒性质量分数,并能在各种质量分数锑胁迫下生长,但受害程度存在差异。其中,大叶黄杨在不同质量分数锑处理下耐性指数均大于90%。同时,其体内各组织锑的质量分数均低于其他3种木本植物。这可能是由于大叶黄杨具有较强的排斥锑的能力,从而增强了其对锑的耐受性。因此,后续可以对其开展锑的排斥机制方面的研究,为开发农作物排斥锑积累技术、保护环境与人类健康提供有效途径。
蓝唯源等(2009)研究发现,高浓度锑对芥菜(Brassica juncea)、玉米(Zea mays)等高等植物光合作用有明显影响,能够造成甜芥菜叶片失绿。Pan等(2011)研究发现,锑胁迫可以导致玉米叶片中叶绿素合成、叶片最大光化学效率显著降低。本研究中的4种植物的叶绿素相对含量在锑胁迫逐渐降低,与之前研究结果基本一致。这可能是由于植物体内的重金属与叶绿素合成的几种酶的 SH基结合,从而抑制了酶活性进而阻碍叶绿素合成(Somashekaraiah等, 1992)。因此,叶绿素含量的下降必将影响植物的光合作用,进而导致这4种木本植物的生物量降低。
植物通过形成复杂的抗氧化酶系统来对抗与清除胁迫造成的活性氧(焦健等, 2006)。POD和SOD是植物体内抗氧化系统中的主要保护酶,4种木本植物在中高质量分数锑胁迫下根系的 POD和SOD活性均呈现不同程度的增加,这表明它们能够通过清除锑胁迫产生的活性氧来保护植物免受伤害。同时,除大叶黄杨外,在高质量分数锑胁迫下3种木本植物的POD和SOD活性增加幅度减少或受到抑制。这表明植物体内高质量分数的锑对植物毒害作用加剧,迫使相关酶的结构或合成受到影响。相反,大叶黄杨可能启动了体内排斥锑的机制,其体内锑含量相对较少,降低由锑产生的氧化胁迫的危害程度,从而使其POD和SOD活性维持在一个相对平稳的状态。
一般情况下,植物体内锑的积累量随着土壤锑浓度的升高而增加(Martin, 2009)。本研究中的臭椿、构树、大叶黄杨和紫穗槐均表现出了此特点。Pratas等(2005)对生长在Portugal废弃矿区上的草本植物研究发现,植物对锑的最大富集质量分数低于5 mg·kg-1。Ainsworth等(1990)在某金属熔炼场附近的污染草地发现,植物对锑的富集质量分数为336 mg·kg-1。Nguyen等(2009)通过70 d的田间控制实验发现,牛毛毡(Eleocharis acicularis)对锑的最大富集质量分数为 76 mg·kg-1。Feng等(2009)通过室内控制实验发现,4种蕨类植物根部对锑的富集质量分数范围为123~358 mg·kg-1。本研究中的臭椿、构树、大叶黄杨和紫穗槐对锑的积累质量分数均随着胁迫质量分数的增加而增大,最大富集质量分数分别为168.07、196.53、85.6和418.27 mg·kg-1,均表现出较强的耐锑能力。同时,4种抗污染木本植物的 BCF均随胁迫质量分数的增加而降低,结果表明:4种木本植物对锑的富集能力随胁迫质量分数的增加而降低。其中,不同质量分数胁迫下的紫穗槐的BCF均高于其他3种木本植物,表现出较强的植物稳定能力。一般认为,锑污染较为严重地区土壤养分较为贫瘠,紫穗槐作为一种豆科植物,能从空气中固定氮从而提供其生长所需的养分,因此可作为锑植物稳定的潜力树种,并可作为植物与根际微生物联合修复锑污染机理研究的植物材料。此外,这4种木本植物在锑污染区(如锑矿矿山废弃地)的植被恢复过程中可作为潜在的先锋木本植物。
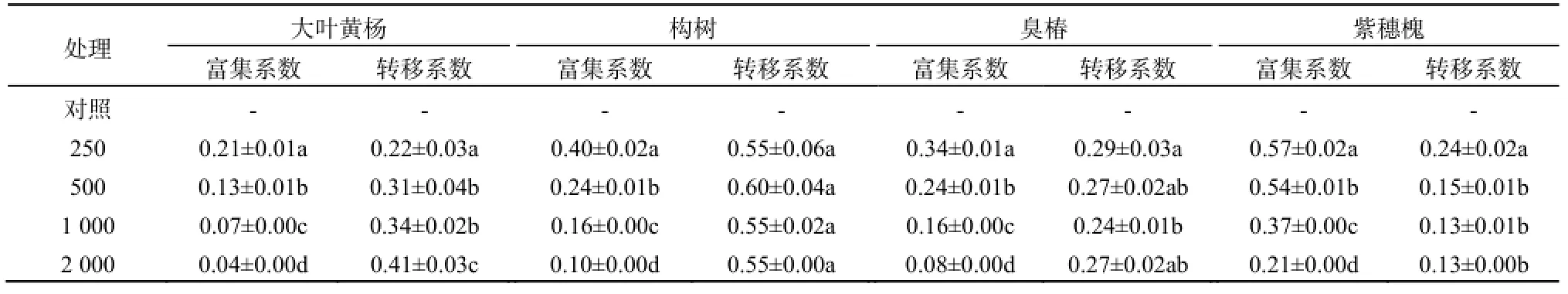
表3 4种木本植物对锑的富集系数和转移系数Table 3 Sb bioconcentration factor and translocation factor of four woody plants
4 结论
本研究分析了臭椿、构树、大叶黄杨及紫穗槐对锑的生理响应和积累特征,并评价其用于植物修复的潜力,通过试验得出以下结论:
(1)本研究中4种木本植物内体锑的含量均显著高于其植物毒性含量,并在各种质量分数锑胁迫下生长,表现出较强的耐受性。其中,大叶黄杨对锑胁迫表现出超强的耐受性,此外,其体内不同组织的锑含量均显著低于其他3种植物,具有对锑较强的排斥性。
(2)锑胁迫能影响植物的正常生长,并能对植物构成氧化胁迫以及降低植物体的叶绿素含量。同时,在一定质量分数范围内,植物能通过提高抗氧化酶活性等防御机制来降低锑胁迫对植物造成的危害。
(3)固氮植物紫穗槐有较强的对锑的富集能力,可作为锑植物稳定的潜力树种。此外,这4种木本植物均表现出较强的耐锑能力,可作为锑污染场地植被恢复过程中的先锋木本植物。
AINSWORTH N, COOKE J A, JOHNSON M S. 1990. Distribution of antimony in contaminated grassland: 1.vegetation and soils[J]. Environmental Pollution, 65(1): 65-77.
ANAWAR H M, FREITAS M C, CANHA N, et al. 2011. Arsenic, antimony, and other trace element contamination in a mine tailings affected area and uptake by tolerant plant species[J]. Environmental Geochemistry and Health, 33(4): 353-362.
BEYERSMANN D and HARTWIG A. 2008. Carcinogenic metal compounds: recent insight into molecular and cellular mechanisms[J]. Archives of Toxicology, 82(8): 493-512.
BI X Y, LI Z G, ZHUANG X C, et al. 2011. High levels of antimony in dust from e-waste recycling in southeastern China[J]. Science of the Total Environment, 409(23): 5126-5128.
FENG R W, WEI C Y, TU S X, et al. 2009. Antimony accumulation and antioxidative responses in four fern plants[J]. Plant and Soil, 317(1): 93-101.
HE M C, WANG X Q, WU F C, et al. 2012. Antimony pollution in China[J]. Science of the Total Environment, 421-422: 41-50.
HE M C. 2007. Distribution and phytoavailability of antimony at an antimony mining and smelting area, Hunan, China[J]. Environmental Geochemistry and Health, 29(3): 209-219.
HUANG H, SHU S C, SHIH J H, et al. 1998. Antimony trichloride induces DNA damage and apoptosis in mammalian cells[J]. Toxicology, 129(2-3): 113-123.
JANA U, CHASSANY V, BERTRAND G, et al. 2012. Analysis of arsenic and antimony distribution within plants growing at an old mine site in Ouche (Cantal, France) and identification of species suitable for site revegetation[J]. Journal of environmental management, 110: 188-193.
KABATA-PENDIAS A, PENDIAS H. 1984. Trace elements in soils and plants[M]. Boca Raton, FL (USA): CRC Press.
KABATA-PENDIAS A, PENDIAS H. 2000. Trace elements in soil & plants[M]. Boca Raton, USA: CRC Press.
MARTIN T. 2009. Phytoavailability and plant uptake of antinomy[M]. Université de Neuchâtel. Zuzwil.
NGUYEN T H, SAKAKIBARA M, SANO S. 2009. Phytoremediation of Sb, As, Cu, and Zn from Contaminated Water by the Aquatic Macrophyte Eleocharis acicularis[J]. Clean: Soil, Air, Water, 37(9): 720-725.
PAN X L, ZHANG D Y, CHEN X, et al. 2011. Antimony accumulation, growth performance, antioxidant defense system and photosynthesis of Zea mays in response to antimony pollution in soil[J]. Water, Air, and Soil Pollution, 215(1-4): 517-523.
PRATAS J, PRASAD M N, FREITAS H, et al. 2005. Plants growing in abandoned mines of Portugal are useful for biogeochemical exploration of arsenic, antimony, tungsten and mine reclamation[J]. Journal of Geochemistry Exploration, 85(3): 99-107.
SOMASHEKARAIAH B V, PADAMAJAES K, PRASAD R K. 1992. Phytoxicity of cadmium ions on germination seedings of mung bean(Phaseolus vulgarize):Involvement of lipid peroxides in chlorophyll degradation[J]. Plant Physiology, 85(1): 85-89.
TAKAHASHI S, SATO H, KUBOTA Y, et al. 2002. Inhibition of DNA-double strand break repair by antimony compounds[J]. Toxicology, 180(3): 249-256.
WAN X and JIA Y F. 2010. Study on adsorption and remediation of heavy metals by poplar and larch in contaminated soil[J]. Environmental Science and Pollution Research, 17(7): 1331-1338.
WANG X Q, HE M C, XI J H, et al. 2011. Antimony distribution and mobility in rivers around the world’s largest antimony mine of Xikuangshan, Hunan Province, China[J]. Microchemical Journal, 97(1): 4-11.
WEI C Y, DENG Q J, WU F C, et al. 2011. Arsenic, antimony, and bismuth uptake and accumulation by plants in an old antimony mine, China[J]. Biological Trace Element Research, 144(1-3): 1150-1158.
WIKINS D A. 1978. The measurement of tolerance to edaphic factors by means of root growth[J]. New Phytologist, 80(3): 623-633.
WU F C, FU Z Y, LIU B J, et al. 2011. Health risk associated with dietary co-exposure to high levels of antimony and arsenic in the world's largest antimony mine area[J]. Science of the Total Environment, 409(18): 3344-3351.
ZHAO L, ZHANG F S, WANG K, et al. 2009. Chemical properties of heavy metals in typical hospital waste incinerator ashes in China[J]. Waste Management, 29(3): 1114-1121.
国土资源部信息中心. 世界矿产资源年评(2004─2005)[M]. 北京: 中国地质出版社, 2006.
焦健, 李朝周, 黄高宝. 2006. 钴对干旱胁迫下大豆幼苗叶片的保护作用及其机理[J]. 应用生态学报, 17(5): 796-800.
蓝唯源, 宋书巧, 吴浩东, 等. 2009. 土壤三价锑污染对甜芥菜生长及品
质的影响研究[J]. 环境科学与技术, 32(2): 20-23.
刘成佐, 刘富梁, 谢宗波, 等. 2007. 德安锑矿区土壤中锑的形态分析及生物可给性初探[J]. 东华理工学院学报, 30(4): 358-361.
Physiological Response and Accumulation Characters of Four Anti-pollution Woody Plants under Antimony Stress
XUE Liang1, Gao Ming1, SHI Shengqing2, WEI Yuan2, JIANG Zeping2, LIU Jianfeng2*
1. Research Institute of Subtropical Forestry, Chinese Academy Forestry, Fuyang 311400, China;
2. State Key Laboratory of Tree Genetics and Breeding, Research Institute of Forestry, Chinese Academy of Forestry, Beijing 100091, China
The height, ground diameter, biomass, relative chlorophyll content, tolerance index and the activities of POD and SOD of 4 kinds of antipollution woody plant seedlings of Ailanthus altissima,Broussonetia papyrifera, Buxus megistophylla and Amorpha fruticosa growing on containers with five soil antimony (Sb) mass fraction (0, 250, 500, 1000 and 2000 mg·kg-1) were examined to explore the physiological response of these plants to Sb stress. Mass fraction of Sb in both aboveground and underground part of these plants were also measured to understand the accumulation characteristics of these plants under Sb stress. These researches would provide a theoretical foundation to select plant materials for Sb phytoremediation. The result showed that the height, ground diameter,biomass and tolerance index of all these four species decreased with the increase in Sb mass fraction. Except for Buxus megistophylla, the chlorophyll contents of other three species were significantly reduced under middle and upper-middle mass fraction(500, 1000 mg·kg-1)of Sb stress. However, the chlorophyll contents of all these woody plants were reduced under high mass fraction of Sb stress, indicating that Sb could reduce biomass Synthesis by disturb the photosynthesis of these plants. Under upper-middle mass fraction of Sb stress, the activities of POD and SOD in roots of four woody plants were increased while it were reduced or suppressed in Ailanthus altissima,Broussonetia papyrifera and Amorpha fruticosa under high mass fraction, suggesting that antioxidase enzyme system might play a important role under Sb stress and high mass fraction of Sb stress also reduce the capacities of antioxidase enzymes in scavenging reactive oxygen species. These plants showed different capacities of Sb accumulation both in aboveground and underground parts with the order of Broussonetia papyrifera > Amorpha fruticosa > Ailanthus altissima > Buxus megistophylla and Amorpha fruticosa > Broussonetia papyrifera > Ailanthus altissima > Buxus megistophylla, respectively. The result suggested that the reduction of inhibitory effect of Sb on chlorophyll synthesis, activities of POD and SOD of Buxus megistophylla might be due to its high ability to exclude Sb compared to other three species, which enhanced its resistance to Sb stress. The maximal mass fraction of Sb in root of Amorpha fruticosa was 418.27 mg·kg-1and possessed the highest BCF under all four mass fractions, which could be a potential tree species for Sb phytostabilization. Moreover, these four woody plants can be used as pioneer woody plants during vegetation restoration in Sb contaminated areas.
contamination resistance; woody plant; antimony; physiological response; accumulation characters
X173
:A
:1674-5906(2014)08-1344-07
薛亮,高暝,史胜青,魏远,江泽平,刘建锋. 四种抗污染木本植物对锑的生理响应及积累特征研究[J]. 生态环境学报, 2014, 23(8): 1344-1350.
XUE Liang, Gao Ming, SHI Shengqing, WEI Yuan, JIANG Zeping, LIU Jianfeng. Physiological Response and Accumulation Characters of Four Anti-pollution Woody Plants under Antimony Stress [J]. Ecology and Environmental Sciences, 2014, 23(8): 1344-1350.
国家科技支撑计划(2012BAC09B03);国家科技支撑计划(2011BAD38B0103)
薛亮(1984年生),助理研究员,博士,主要从事植物逆境生理生态学相关研究工作。E-mail:Linkeyuanxl@126.com *通讯作者:刘建锋,副研究员,博士,主要从事植物地理、植物生态学等相关研究工作。E-mail:Liujfrif@126.com
2014-01-06

