白蚁肠道内纤维素酶产生菌的筛选及其酶活性
张建芬,余翠君,陶伟峰
(浙江树人大学生物与环境工程学院,杭州310015)
白蚁肠道内纤维素酶产生菌的筛选及其酶活性
张建芬,余翠君,陶伟峰
(浙江树人大学生物与环境工程学院,杭州310015)
从黑翅土白蚁(OdontotermesformosanusShiraki)肠道内筛选具有纤维素降解能力的细菌,并研究其酶活性。结果表明:筛选得到5株菌株,活力较高的菌株CMC-4被鉴定为土白蚁特拉布尔希氏菌Z-4(TrabulsiellaodontotermitisZJSRU-4)。同时对菌株T.odontotermitisZJSRU-4进行了系统的研究,它具有完整的纤维素酶系统,主要产羧甲基纤维素酶(CMCase)和β-葡萄糖苷酶,滤纸酶的活力较低。在以羧甲基纤维素钠为碳源的培养基中培养36 h,发酵液中CMCase的比酶活达到20.8 U/mL,培养44 h,β-糖苷酶的比酶活达到18.2 U/mL。CMCase和β-葡萄糖苷酶作用的pH分别为6.0和6.5,它们作用的最适温度都为40 ℃。该菌对纤维质原料具有降解能力,具有潜在的应用价值。
白蚁;纤维素降解菌;筛选;羧甲基纤维素酶;土白蚁特拉布尔希氏菌
纤维素是地球上年产量巨大,而一直未能得到充分利用的可再生性的多糖类有机物资源。如何将纤维素物质降解转化为有用的糖和乙醇等是研究人员一直探索的课题。已知产纤维素酶的生物很多,如细菌、放线菌、真菌等微生物及白蚁、蜗牛等动物[1]。白蚁是热带和亚热带地区木质纤维素的重要分解者,它对地球陆地生态系统的形成起到了巨大的作用[2-3]。在白蚁的后肠中,有大量的共生微生物定居。后肠微生物对白蚁的生命活动具有重要作用,白蚁所需的营养物质大多来自微生物的发酵产物,后肠中的微生物发酵纤维素类物质生成乙酸、丙酸以及其他有机酸,是白蚁重要的能源和自身物质合成的碳架重要来源[4]。目前从白蚁中分离到的具有纤维素酶活的细菌有芽孢杆菌(Bacillus)[5-6]、螺旋菌(Spirochaeta)[7]、链霉菌(Streptomyces)[8]、葡萄球菌(Streptococcus)[9]和贪噬菌(Variovorax)[10]。黑翅土白蚁(OdontotermesformosanusShiraki)在我国分布广泛,是社会危害性最大的低等白蚁之一。本文从黑翅土白蚁(OdontotermesformosanusShiraki)肠道中分离具有降解纤维素能力的细菌,并研究其酶学性质,以期为纤维素降解菌的生产与研究提供基础数据。
1 材料与方法
1.1 白蚁的来源
采集杭州北高峰山林的白蚁样品(黑翅土白蚁,OdontotermesformosanusShiraki),作为菌种筛选来源。选取体型健壮的工蚁,解剖后制备白蚁后肠菌悬液。
1.2 培养基及主要试剂
富集培养基:KH2PO42 g,MgSO40.15 g,KNO31 g,CMC-Na 10 g,定容至1 L,用5 mol/L NaOH调pH至7.0。
选择培养基:牛肉浸膏1.5 g,蛋白胨5 g,CMC-Na 1 g,NaCl 5 g,琼脂15 g,定容至1 L,用5 mol/L NaOH调pH至7.0。
产酶培养基:CMC-Na 5 g,酵母粉 2 g,KH2PO42 g,MgSO40.15 g定容至1 L,用5 mol/L NaOH调pH至7.0。
细菌基因组提取试剂盒为Axygen公司产品,Taq酶购自TaKaRa公司,引物合成及PCR 产物测序由上海生工生物工程有限公司完成。其他所用试剂均为国产分析纯。
1.3 白蚁肠道纤维素酶产生菌的筛选
1.3.1 解剖白蚁及白蚁后肠菌悬液制备
选取2头工蚁,置冰上微冷冻使其活动性减弱,用体积分数75%的酒精对白蚁表面进行消毒,再用蒸馏水洗3次,待用。白蚁解剖及后肠菌悬液的制备参见文献[10]。
1.3.2 纤维素酶产生菌的富集培养
取白蚁后肠菌悬液5 mL转入无菌试管中,于30 ℃下振荡培养1~3 d后,按2%的接种量,转接至新的富集培养基中进行第2次富集培养。
1.3.3 纤维素酶产生菌的筛选
将富集培养后的菌液做平板稀释涂布法分离,待长出单菌落后,用牙签点种在选择平板上,刚果红染色[8-9]观察。
挑取透明圈较大的菌落,进行多次划线分离,并进行牙签点种和刚果红染色,观察透明圈的大小,直至得到稳定降解纤维素的纯克隆。
1.4 菌种的鉴定
1.4.1 形态学研究
将筛选所得菌株经多次划线分离后,进行菌落形态观察、简单染色观察及革兰氏染色进行形态学鉴定。
1.4.2 分子生物学鉴定
按试剂盒规定方法提取基因组DNA,以基因组DNA为模板,通过PCR反应扩增16S rDNA基因。采用通用引物8F(5′-A ̄G ̄A ̄G ̄T ̄T ̄T ̄G ̄A ̄T ̄C ̄C ̄T ̄G ̄G ̄C ̄T ̄C ̄A ̄G-3′)和1492R (5′-A ̄C ̄G ̄G ̄T ̄T ̄A ̄C ̄C ̄T ̄T ̄G ̄T ̄T ̄A ̄C ̄G ̄A ̄C ̄T ̄T-3′),进行16S rDNA的PCR扩增。扩增体系为25 μL(引物各为0.3 μL,Taq酶体系为12.5 μL,DNA模板为0.2 μL,ddH2O为11.7 μL)。PCR扩增条件:94 ℃ 5 min,94 ℃ 30 s,53 ℃ 45 s,72 ℃ 2 min,30个循环,72 ℃延伸10 min。
PCR反应产物经1%琼脂糖凝胶电泳检测后,再将PCR的反应产物交由上海生工生物工程公司完成测序分析。序列测序验证后提交到GenBank数据库,进行BLAST相似性比较,MEGA 5软件邻接法构建进化树。
1.5 纤维素酶活力测定方法
纤维素酶活力的测定采用3,5-硝基水杨酸(DNS)法[11]。
酶活力单位定义:在 pH 6.5、40 ℃ 条件下每分钟产生1 μmol还原糖的酶量为1个酶活力单位(U)。
1.6 粗酶液的制备
100 mL发酵液离心得到3 g湿菌体,收集上清液。将上清液在冰浴条件下加入固体(NH4)2SO4至饱和度80%。4 ℃下静置30 min,离心(10 000 r/min)10 min,收集沉淀,用少量Tris-HCl缓冲液(pH 7.0,20 mmol/L)溶解。将盐析酶液用Tris-HCl缓冲液(pH 7.0,20 mmol/L)透析过夜,得到的酶液即为粗酶液Ⅰ。菌体用生理盐水洗涤2次后,用pH 7.0的0.02 mol/L Tris-HCl缓冲液20 mL悬浮。在冰浴中超声波破壁10 min(300 W,5 s,间隔10 s),4 ℃下抽提30 min。离心,取上清液即为粗酶液Ⅱ。
1.7 酶学性质研究
研究部分纯化的酶液的酶学性质,包括不同底物、温度、pH等,得出最优的纤维素酶反应条件。
2 结果与分析
2.1 菌种的筛选与纯化
经富集培养、选择性培养基平板筛选、多次划线分离后筛选得到5株能以羧甲基纤维素钠(CMC-Na)为唯一C源生长的菌株CMC-4、CMC-5、CMC -11、CMC -16和CMC -17,这些菌株经刚果红染色后在菌落周围都出现明显透明圈(图1)。

图1 菌株的刚果红染色Fig.1 Congo red staining of strain
分别测量刚果红染色后水解圈的直径及菌落直径,它们的比值即为HC值,结果如表1所示。由表1可知:菌株CMC-5纤维素降解圈直径与菌落直径的比值为3.40。说明该菌株具有较高的CMCase活性。
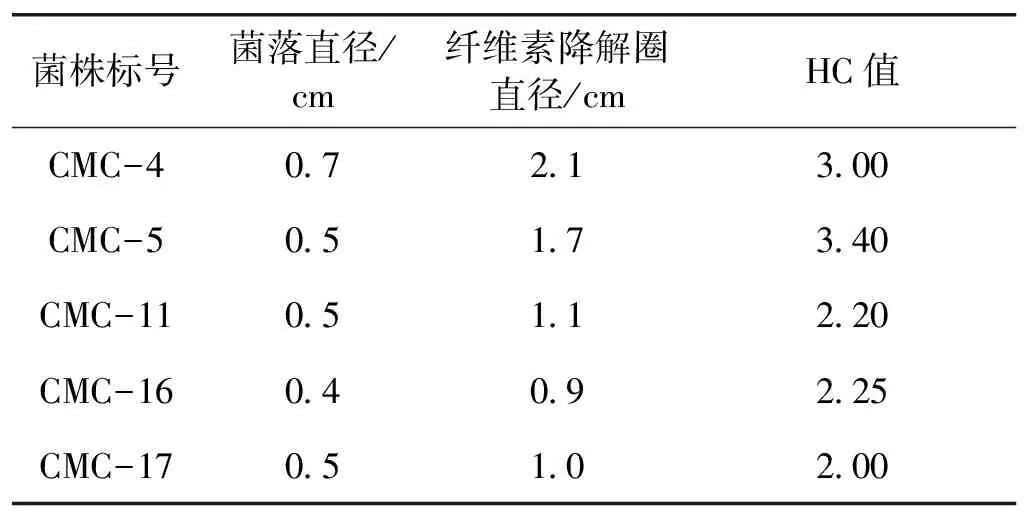
表1 纤维素分解菌刚果红染色的透明水解圈
2.2 纤维素酶产生菌的鉴定
2.2.1 形态鉴定
对HC值较大的菌株CMC-4、CMC-5进行鉴定,它们的外观比较一致,为无芽孢的杆状细菌,在固体营养琼脂上形成乳白色、光滑、透亮的、半透明的、运动的、边缘不规则的菌落,进一步生化分析这2株菌为兼性好氧,革兰氏阴性细菌。
2.2.2 分子生物学鉴定
为了进一步确定筛选到的菌株CMC-4、CMC-5的分类地位,在形态学的基础上又进行了分子生物学鉴定。图2为16S rDNA的PCR凝胶电泳结果。由图2可知,PCR扩增分别得到约1.5 kb长的片段。
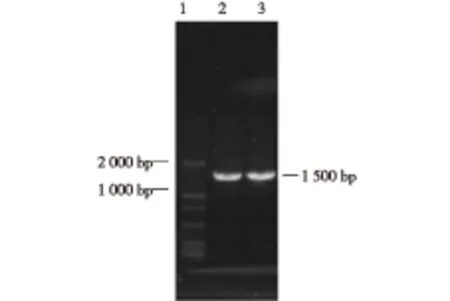
1—标准DNA;2—CMC-4菌的PCR;3—CMC-5菌的PCR图2 菌株的16S rDNA PCR扩增片段Fig.2 PCR fragments of 16S rDNA of strain
通过16S rDNA基因(图2)序列分析和进化树分析(图3)。由图3可知,CMC-4和CMC-5与TrabulsiellaodontotermitiesEant 3-9(DQ453129) 的相似度为99%。因此,菌株CMC-4和CMC-5为同一株菌,命名为土白蚁特拉布尔希氏菌ZJSRU-4(TrabulsiellaodontotermitiesZJSRU-4),将该菌株16S rDNA基因序列(1 452 bp)登陆GenBank,获得登录号为KC633946。T.odontotermitisEant 3-9T和 Eant 3-3为2007年从台湾南部屏东县腐烂的竹子上聚集的黑翅土白蚁(O.formosanusShiraki)的肠道内首次分离到的菌株[12]。迄今为止,还没有此菌被发现的其他报道。本文筛选到的T.odontotermitisZ-4是从杭州北高峰腐烂的松树上聚集的黑翅土白蚁的肠道内分离得到。由此推断,T.odontotermitis可能存在于热带和亚热带土白蚁的肠道内。
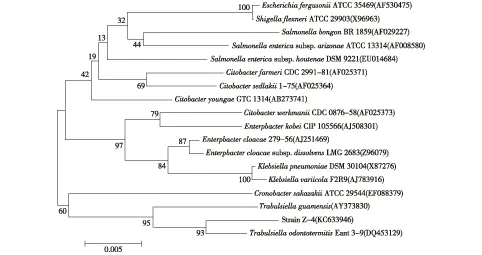
图3 菌株的16S rRNA序列系统发育树Fig.3 Phylogenetic tree based on 16S rRNA sequences of isolated strain
2.3 产酶分析
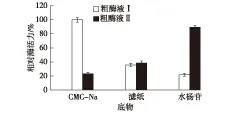
图4 粗酶液对不同底物的酶活力比较Fig.4 Enzyme activity of crude enzyme solution on different substrate
为了鉴定菌株ZJSRU-4所产的纤维素酶系统,滤纸、水杨苷和CMC-Na分别作为粗酶液Ⅰ和粗酶液Ⅱ酶反应的底物,鉴定结果见图 4。由图4可知:当滤纸、水杨苷和CMC-Na分别作为酶反应的底物时,粗酶液Ⅰ和粗酶液Ⅱ的反应体系都能检测到少量葡萄糖的生成。粗酶液Ⅰ,即胞外酶液主要为CMCase,而粗酶液Ⅱ,即胞内酶液主要为β-糖苷酶。说明菌株ZJSRU-4具有完整的纤维素酶系统。纤维素酶系统包括C1 纤维素酶,CMCase和β-糖苷酶,只有它们的协同作用,才能把纤维素降解为葡萄糖[13]。因为滤纸酶酶活力较低,在后续的实验中,笔者仅研究粗酶液Ⅰ中CMCase的酶学性质和粗酶液Ⅱ中β-糖苷酶的酶活力。
2.4 发酵产酶曲线
测定菌株经产酶培养基培养的CMCase和β-糖苷酶的比酶活,结果见图5。由图5可知:在36 h CMCase的酶活力均达到最大,达到20.8 U/mL发酵液;培养44 h,β-糖苷酶的比酶活力到18.2 U/mL发酵液。综合考虑2种酶的酶活力,在以下试验中,均以培养40 h的发酵液测定CMCase和β-糖苷酶的比酶活。
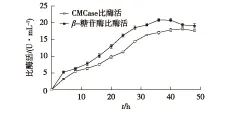
图5 菌株ZJSRU-4的产酶曲线Fig.5 Enzyme activity of strain ZJSRU-4 during culture time
2.5 酶学性质研究
2.5.1 pH和温度对纤维素酶活性的影响
为了研究pH对CMCase和β-糖苷酶的酶活力的影响,反应体系选用50 mmol/L醋酸钠缓冲液(pH 4.0~5.8),50 mmol/L Tris-HCl缓冲液(pH 5.8~8.0)和50 mmol/L甘氨酸-NaOH缓冲液(pH 8.0~9.0)。缓冲体系对CMCase的影响较大,同一pH条件下,Tris-HCl缓冲体系比甘氨酸-NaOH缓冲体系酶活力更高。pH对CMCase和β-糖苷酶的酶活力的影响均较大,最适pH分别在6.5和6.0附近(图6(a))。考察CMCase和β-糖苷酶在不同温度(20、25、30、35、40、 45、50、55和60 ℃)下的比酶活变化,结果见图6(b)。由图6(b)可知:CMCase和β-糖苷酶的最适反应温度均为40 ℃。据文献[14-16]报道,多数细菌产的CMCase的最适反应温度在40~65 ℃,最适反应pH在5.4~7.0[14-16],说明笔者分离到的CMCase与文献报道的一致。
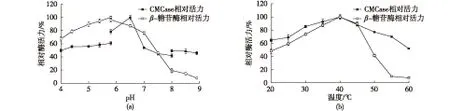
图6 温度和pH对CMCase和β-糖苷酶的影响Fig.6 Effects of pH and temperature on CMCase and β-glucosidase activity
2.5.2 CMCase对不同纤维素材料的降解能力
将菌株分别接种到不同纤维素材料的摇瓶发酵培养基中,分别测定CMCase的酶活以显示其对不同纤维素材料的降解能力,结果见图7。由图7可知:菌株对CMC-Na的降解活力较高,对新华滤纸、玉米秸秆、水稻秸秆和小麦麸皮均有降解能力,但酶活力不高。说明菌株T.odontotermities对纤维质原料具有降解能力,具有潜在的应用价值。
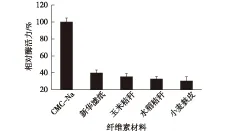
图7 菌株对不同纤维素材料的降解能力Fig.7 Cellulose-degrading ability of strain ZJSRU-4 under different carbon source
3 结 论
从白蚁肠道中分离得到5株具有纤维素降解活力的菌株,活力较高的菌株经形态学观察和分子鉴定为土白蚁特拉布尔希氏菌ZJSRU-4(TrabulsiellaodontotermitisZJSRU-4)、对该菌株进行了较为系统的研究。菌株T.odontotermitisZJSRU-4能产生较高的CMCase的酶活力和β-糖苷酶活力,滤纸酶活力较低,说明该菌株能实现纤维素的协同降解。菌株ZJSRU-4具有完整的纤维素酶系统,许多植物材料的主要成分如秸秆、玉米秸秆、小麦麸皮等能被该菌降解,虽然目前降解活力并不高。在以后的研究中,可以进一步研究其培养条件以提高纤维素酶活力,或者通过混菌培养以提高降解活力。在后续的研究工作中,将拟分离纯化来源于T.odontotermitisZJSRU-4的CMCase,滤纸酶和β-糖苷酶,并研究它们的酶学性质,将有助于理解这3种酶以及它们的协同作用。
[1] Gupta P,Samant K,Sahu A.Isolation of cellulose-degrading bacteria and determination of their cellulolytic potential[J].Int J Microbiol,2012,2012:1-5.
[2] Scharf M E,Tartar A.Termite digestomes as sources for novel lignocellulases[J].Biofuels Bioprod Bioref,2008,2(6):540-552.
[3] Ragauskas A J,Williams C K,Davison B H,et al.The path forward for biofuels and biomaterials[J].Science,2006,311:484-489.
[4] 陈虹,梅建凤,闵航.白蚁肠道微生物[J].微生物学杂志,2005,25(2):75-79.
[5] König H.Bacillusspecies in the intestine of termites and other soil invertebrates[J].J Appl Microbiol,2006,101(3):620-627.
[6] 吴燕,侯信锋,迟绍丽,等.白蚁栖息环境中蜡状芽孢杆菌的分离及其纤维素酶活性分析[J].微生物学通报,2012,39(5):638-644.
[7] Dröge S,Fröhlich J,Radek R,et al.Spirochaetacoccoidessp.nov.,a novel coccoid spirochete from the hindgut of the termiteNeotermescastaneus[J].Appl Environ Microbiol,2006,72(1):392-397.
[8] Tamburini E,Perito B,Mastromei G.Growth phase-dependent expression of an endoglucanase encoding gene (eglS) inStreptomycesrocheiA2[J].FEMS Microbiol Lett,2004,237(2):267-272.
[9] 何刚强,堵国成,刘立明.从白蚁中分离筛选纤维素分解菌及其产酶性质[J].食品与生物技术学报,2009,28(3):352-355.
[10] 吴燕,迟绍丽,倪金凤.从白蚁中分离到具有纤维素酶活的贪噬菌[J].应用昆虫学报,2011,48(19):95-98.
[11] Somogyi M.Note on sugar determination[J].J Biol Chem,1952,195:19-23.
[12] Chou J,Chen H W M,Arun A B,et al.Trabulsiellaodontotermitissp.nov.,isolated from the gut of the termiteOdontotermesformosanusShiraki[J].Int J Syst Evol Microbiol,2007,57(4):696-700.
[13] Ma L,Zhang J,Zou G,et al.Improvement of cellulase activity inTrichodermareeseiby heterologous expression of a beta-glucosidase gene fromPenicilliumdecumbens[J].Enzyme Microb Tech,2011,49(4):366-371.
[14] Lee Y J,Kim K,Lee H,et al.Purification and characterization of cellulase produced byBacillusamyoliquefaciensDL-3 utilizing rice hull[J].Bioresour Technol,2008,99(2):378-386.
[15] Zhao K,Guo L Z,Lu W D.Extracellular production of novel halotolerant,thermostable,and alkali-stable carboxymethyl cellulase by marine bacteriumMarinimicrobiumsp.LS-A18[J].Appl Biochem Biotech,2012,168(3):550-567.
[16] Jabbar A,Rashid M H,Javed M R,et al.Kinetics and thermodynamics of a novel endoglucanase (CMCase) fromGymnoascellacitrinaproduced under solid-state condition[J].J Ind Microbiol Biotechnol,2008,35(6):515-524.
(责任编辑 荀志金)
Isolation of cellulose-degrading strains from the gut of termites andcharacterization of its cellulase-producing capability
ZHANG Jianfen,YU Cuijun,TAO Weifeng
(College of Biology and Environmental Engineering,Zhejiang Shuren University,Hangzhou 310015,China)
Five mesophilic bacteria with cellulose-degrading ability were isolated from the gut of termites (OdontotermesformosanusShiraki). Strain CMC-4 with high cellulose-degrading ability was identified asTrabulsiellaodontotermitisZJSRU-4 according to physiological tests and phylogenetic analysis.High carboxymethyl cellulase(CMCase) andβ-glucosidase activity was detected,and filter paper activity was also produced at a low level.When sodium carboxymethyl cellulose was used as carbon source,CMCase activity reached 20.8 U/mL at 36 h andβ-glucosidase activity 18.2 U/mL at 44 h. Maximum CMCase activity was at pH 6.5,40 ℃,while maximumβ-glucosidase activity was at pH 6.0,40 ℃.This strain has potential industrial application to produce cellulose.Keywords:termite;cellulose-degrading bacteria;isolation;carboxymethyl cellulase;Trabulsiellaodontotermitis
10.3969/j.issn.1672-3678.2014.06.006
2013-11-07
国家自然科学基金青年基金(21102131);浙江省大学生科技创新项目(2012R420023);浙江树人大学学生课题(SH2013S03)
张建芬(1979—),女,博士,副教授,研究方向:生物催化与微生物转化,E-mail:grace_zjf@126.com
Q814
A
1672-3678(2014)06-0027-06

