促红细胞生成素对晚期卵巢癌经紫杉醇化疗所致神经毒性损伤的保护作用研究
成 莉,李 琳,邢 辉
紫杉醇联合顺铂是目前推荐的卵巢癌的一线治疗方案,以紫杉醇为基础的治疗是复发性卵巢癌的有效治疗方案[1]。化疗药物的抗有丝分裂作用常导致神经细胞凋亡,进而促进神经的损伤。化疗引起的神经损伤的常见症状有感觉异常、感觉迟钝、麻木及疼痛[2];非自主神经损伤也常与紫杉醇的化疗有关。因此,为减轻化疗药物引起的神经毒性,许多研究在不断探索新的化疗方案组合,临床发现使用促红细胞生成素(EPO)能够减轻化疗患者诱发的贫血[3]。同时近期研究结果表明,EPO能够产生潜在的神经保护作用,EPO及其受体可以在中枢神经系统及星形胶质细胞中高表达[4]。EPO具有抗神经细胞凋亡并减少糖尿病模型大鼠神经功能障碍的作用[5]。但EPO对化疗药物引起的神经损伤是否具有保护作用尚不明确。本研究选取本院以紫杉醇为化疗基础的卵巢癌患者,观察EPO对化疗引起的神经损害的保护作用。
1 资料与方法
1.1 临床资料 选取2009年2月—2012年3月在我院收治的晚期(Ⅲ~Ⅳ期)卵巢癌患者124例,年龄45~65岁,平均(55.1±6.5)岁。患者均已婚已育,术后肿瘤标本均经病理检查证实。病理类型:浆液性癌76例,黏液性癌7例,子宫内膜样癌7例,透明细胞癌8例,混合癌16例,癌肉瘤10例。国际妇产科联盟(FIGO )分期:Ⅲ期78例,Ⅳ期46例。患者均先接受首次细胞减灭术,然后行以紫杉醇为基础的化疗,当血红蛋白<100 g/L时行EPO皮下注射。根据患者是否接受EPO及术后早期或术后晚期接受EPO治疗将患者分为早期EPO组(n=41)、晚期EPO组(n=40)和非EPO组(n=43)。
1.2 治疗方法 首次细胞减灭术:手术范围为全子宫、大网膜、双附件、盆腔淋巴结清扫、阑尾切除。再行腹主动脉旁淋巴结清扫术。尽可能使得肿瘤直径<2 cm。经过首次细胞减灭术后患者腹腔内单个残留灶最大直径>1 cm者39例,而≤1 cm者85例。2例行腹壁转移灶切除术,4例行外阴转移灶切除术。
术后化疗:3组患者均采用紫杉醇联合顺铂的化疗方案,紫杉醇135 mg/m2,顺铂70 mg/m2。化疗时间为最少6个疗程,每个疗程为3周。
EPO治疗:当患者化疗前血红蛋白<100 g/L时给予EPO皮下注射,3次/周,剂量为每次150 U/kg。监测患者血红蛋白变化,当血红蛋白>150 g/L时停止EPO皮下注射。术后前2个疗程内接受EPO治疗的患者纳入早期EPO组,术后第4个疗程及以后接受EPO治疗者纳入晚期EPO组。未接受EPO治疗者则纳入非EPO组。
1.3 神经毒性评估 采用癌症治疗功能评估/妇科肿瘤神经毒性问卷(FACT/GOG-NTX)进行神经毒性评估。问卷共4个问题,每个问题根据患者感受分为0~4分。总分0分为0级,1~4分为1级,5~8分为2级,9~12分为3级,13~16分为4级。0级代表无神经毒性,1~4级代表有神经毒性,且神经毒性程度随级别的增加而加重。
1.4 贫血分级 根据血红蛋白水平进行分级:90~100 g/L为1级,60~89 g/L为2级,30~59 g/L为3级,0~29 g/L为4级。
2 结果
2.1 一般资料比较 3组患者的年龄、病理类型、分化程度、FIGO分期间差异均无统计学意义(P>0.05)。化疗前,非EPO组血红蛋白水平高于早期EPO组和晚期EPO组,差异有统计学意义(P<0.05,见表1)。
2.2 神经毒性比较 早期EPO组、晚期EPO组、非EPO组神经毒性损害发生率分别为24.4%(10/41)、42.5%(17/40)、53.5%(23/43)。3组患者神经毒性分级比较,差异有统计学意义(H=6.862,P=0.032,见表2)。
注:FIGO分期=国际妇产科联盟分期;*为t值;与非EPO组比较,△P<0.05

表2 3组患者神经毒性分级比较〔n(%)〕
2.3 贫血分级与早期EPO组神经毒性关系 不同贫血分级患者神经毒性损伤分级间差异有统计学意义(u=-3.810,P<0.05,见表3)。
表3 早期EPO组不同贫血分级患者神经毒性分级比较〔n(%)〕
Table3 Comparison of the neurological toxicity grading between the early EPO patients with the different anemia degree
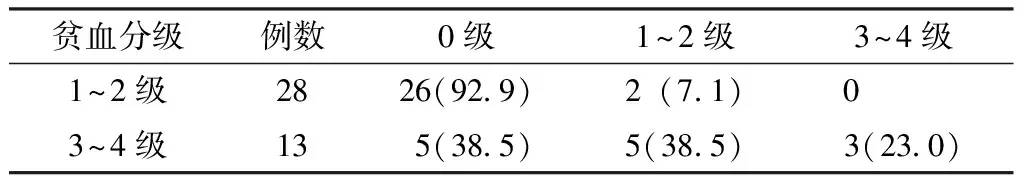
贫血分级例数0级1~2级3~4级1~2级2826(929)2(71)0 3~4级13 5(385) 5(385)3(230)
2.4 血红蛋白变化趋势 化疗前,早期EPO组患者血红蛋白低于其他两组(F=16.83,P=0.014)。随着EPO的治疗,早期EPO组血红蛋白逐渐升高;非EPO组血红蛋白逐渐下降;晚期EPO组血红蛋白在第4个化疗疗程时明显下降,第6个疗程时血红蛋水平有所回升。第6个疗程时,3组患者血红蛋白水平间差异无统计学意义(F=2.78,P=0.381,见图1)。

图1 3组患者血红蛋白变化趋势
2.5 3组发生神经毒性损伤的最早时间与紫杉醇用量比较 早期EPO组发生神经毒性损伤最早时间晚于其他两组(P<0.05)。早期EPO组最早发生神经毒性损伤时紫杉醇用量多于其他两组(P<0.05)。非EPO组发生神经毒性损伤的时间早于其他两组(P<0.05),且发生神经毒性损伤时使用紫杉醇的量少于其他两组(P<0.05,见表4)。
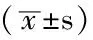
Table4 Comparison of paclitaxel dosage and neurotoxicity occurred earliest time in the three groups
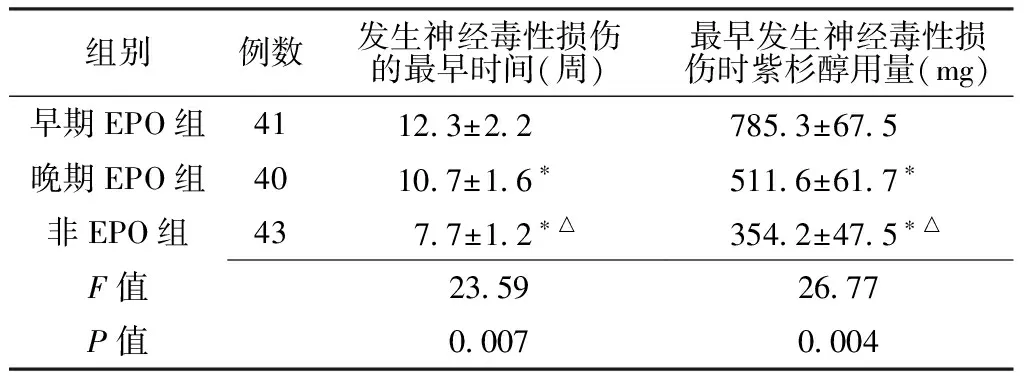
组别例数发生神经毒性损伤的最早时间(周)最早发生神经毒性损伤时紫杉醇用量(mg)早期EPO组41123±22 7853±675 晚期EPO组40107±16∗ 5116±617∗ 非EPO组43 77±12∗△ 3542±475∗△F值23592677P值00070004
注:与早期EPO组比较,*P<0.05;与晚期EPO组比较,△P<0.05
3 讨论
据世界卫生组织估计,每年卵巢癌的发病人数约为20万人,死亡人数高达12.5万人。卵巢癌的病死率在所有妇科肿瘤中居首位,在多种抗肿瘤药物中天然植物提取的抗肿瘤药物所占的比例最大。据统计,紫杉醇类抗肿瘤药物的临床应用已经占到了一线抗肿瘤药物的44%。紫杉醇引起的神经毒性也一直困扰着临床医生。紫杉醇在化疗中引起的神经毒性损害常导致患者肢体麻木、疼痛,甚至引起活动障碍,严重者可迫使患者停药,影响化疗效果;部分患者虽然能够忍耐紫杉醇带来的神经毒性损伤,但也会在一定程度上影响其日后的生存质量[6]。
紫杉醇是从红豆杉科植物中提取的一种二萜类化合物。紫杉醇抗癌谱较广,其能够通过稳定微管干扰微管动力进而激活纺锤体检查点,促使细胞周期阻滞于G2/M期,抑制细胞分裂,诱导细胞凋亡[7-8]。紫杉醇的临床毒副作用包括骨髓抑制、恶心、呕吐等,外周神经毒性作用也是其重要的毒副作用之一。有研究显示,对大鼠注射紫杉醇后检测其脊髓、脑组织、背根神经节和坐骨神经组织中的紫杉醇水平,结果发现紫杉醇在外周神经中的水平最高,而在中枢神经中水平最低[9]。紫杉醇进入人体后首先在本根神经节内聚集,然后沿着其轴突分支向外周及中枢传递。有研究表明,紫杉醇可引起A-纤维和C-纤维的自发放电,引起神经纤维和髓鞘轴突发生肿胀,轴突内线粒体可呈空泡状[10]。病变神经周围受到反复刺激后发生脱髓鞘病变,进而出现各种不同表现的神经毒性反应。
EPO是由肾脏分泌的一种低分子糖蛋白,其主要作用为促进造血前体细胞的增殖和分化,调节红细胞的再生。然而近来研究表明EPO还能起到神经保护作用[11]。Signore等[12]研究表明,EPO可以激活Akt途径抑制6-羟基多巴诱导的多巴胺能细胞的凋亡。EPO还能抑制缺血区域的白细胞浸润,减轻炎症程度,还具有抗氧化应激、减少氧自由基的形成、抑制神经元凋亡的作用。在体外实验中,EPO还能够促进海马神经元表达脑源性神经营养因子的表达,调节神经元的再生、分化和存活[13-16]。
本研究选取以紫杉醇为化疗基础的卵巢癌化疗患者,根据其是否具有EPO使用适应证对其应用EPO,比较早期EPO组、晚期EPO组及非EPO组患者神经毒性的差异,结果显示早期EPO组、晚期EPO组及非EPO组神经毒性损害发生率分别为24.4%、42.5%、53.5%。本研究根据不同贫血程度对早期EPO组患者进行再分组,发现3~4级贫血患者中8例发生神经毒性,其中3例发生3~4级神经毒性,1~2级贫血患者中无发生3~4级神经毒性者。由于晚期EPO组最初未发生贫血状态,所以仅对早期EPO组不同贫血状态进行了分析。应用EPO后,各组患者的血红蛋白也随着化疗疗程的进展得到了不同程度的改善,非EPO组患者随着化疗疗程的增加其血红蛋白水平呈逐渐下降趋势,至化疗第6个疗程时,3组血红蛋白水平间无明显差异。早期EPO组发生神经毒性损伤的最早时间晚于其他两组,其最早发生神经毒性损伤时紫杉醇用量为(785.3±67.5)mg,均明显高于其他两组。这也表明,早期应用EPO后患者发生神经毒性的时间较晚、耐受性较好,发生神经毒性时其接受的紫杉醇用量较高,能够达到更好的化疗效果。
综上所述,EPO能够减轻以紫杉醇为基础化疗的Ⅲ~Ⅳ期卵巢癌患者的神经毒性损伤。早期应用EPO能够更好地降低患者发生神经毒性的发生率,延长最早发生神经毒性的时间,提高最早发生毒性时紫杉醇的用量。由于本研究样本量有限,在今后的研究中应该扩大样本量,对患者的生活质量及EPO用量与化疗效果、紫杉醇用量进行相关分析,为临床应用EPO提供更多的证据。
1 Pecorelli S,Favalli G,Gadducci A,et al.Phase Ⅲ trial of observation versus six courses of paclitaxel in patients with advanced epithelial ovarian cancer in complete response after six courses of paclitaxel/platinum-based chemotherapy:final results of the after-6 protocol 1[J].J Clin Oncol,2009,27(28):4642-4648.
2 Hurt JD,Richardson DL,Seamon LG,et al.Sustained progression-free survival with weekly paclitaxel and bevacizumab in recurrent ovarian cancer[J].Gynecol Oncol,2009,115(3):396-400.
3 Green H,Soderkvist P,Rosenberg P,et al.Pharmacogenetic studies of paclitaxel in the treatment of ovarian cancer[J].Basic Clin Pharmacol Toxicol,2009,104(2):130-137.
4 Pectasides D,Xiros N,Papaxoinis G,et al.Gemcitabine and pegylated liposomal doxorubicin alternating with cisplatin plus cyclophosphamide in platinum refractory/resistant,paclitaxel-pretreated,ovarian carcinoma[J].Gynecol Oncol,2008,108(1):47-52.
5 Bianchi R,Buyukakilli B,Brines M,et al.Erythropoietin both protects from and reverses experimental diabetic neuropathy[J].Proc Natl Acad Sci USA,2004,101(3):823-828.
6 Le T,Hopkins L,Baines KA,et al.Prospective evaluations of continuous weekly paclitaxel regimen in recurrent platinum-resistant epithelial ovarian cancer[J].Gynecol Oncol,2006,102(1):49-53.
7 Bell J,Brady MF,Young RC,et al.Randomized phase iii trial of three versus six cycles of adjuvant carboplatin and paclitaxel in early stage epithelial ovarian carcinoma:a gynecologic oncology group study[J].Gynecol Oncol,2006,102(3):432-439.
8 Vasey PA,Jayson GC,Gordon A,et al.Phase iii randomized trial of docetaxel-carboplatin versus paclitaxel-carboplatin as first-line chemotherapy for ovarian carcinoma[J].J Natl Cancer Inst,2004,96(22):1682-1691.
9 Doi D,Ota Y,Konishi H,et al.Evaluation of the neurotoxicity of paclitaxel and carboplatin by current perception threshold in ovarian cancer patients[J].J Nippon Med Sch,2003,70(2):129-134.
10 Xiao WH,Bennett GJ.Chemotherapy-evoked neuropathic pain:abnormal spontaneous discharge in a-fiber and c-fiber primary afferent neurons and its suppression by acetyl-L-carnitine[J].Pain,2008,135(3):262-270.
11 Weber B,Largillier R,Ray-Coquard I,et al.A potentially neuroprotective role for erythropoietin with paclitaxel treatment in ovarian cancer patients:a prospective phase ii gineco trial[J].Support Care Cancer,21(7):1947-1954.
12 Signore AP,Weng Z,Hastings T,et al.Erythropoietin protects against 6-hydroxydopamine-induced dopaminergic cell death[J].J Neurochem,2006,96(2):428-443.
13 Oskay-Ozcelik G,Chekerov R,Sommer H,et al.Sequential chemotherapy with carboplatin followed by weekly paclitaxel in advanced ovarian cancer:results of a multicenter phase ii study of the northeastern german society of gynecological oncology[J].Gynecol Oncol,2009,116(3):317-322.
14 Harano K,Terauchi F,Katsumata N,et al.Quality-of-life outcomes from a randomized phase Ⅲ trial of dose-dense weekly paclitaxel and carboplatin compared with conventional paclitaxel and carboplatin as a first-line treatment for stage Ⅱ-Ⅳ ovarian cancer:Japanese Gynecologic Oncology Group Trial(JPOG3016)[J].Ann Oncol,2014,25(1):251-257.
15 Blinman P,Gainford C,Donoghoe M,et al.Feasibility,acceptability and preferences for intraperitoneal chemotherapy with paclitaxel and cisplatin after optimal debulking surgery for ovarian and related cancers:an ANZGOG study[J].J Gynecol Oncol,2013,24(4):359-366.
16 Solev IN,Balabanyan VY,Volchek IA,et al.Involvement of bdnf and ngf in the mechanism of neuroprotective effect of human recombinant erythropoietin nanoforms[J].Bull Exp Biol Med,2013,155(2):242-244.

