逍遥散对大鼠阿尔茨海默病模型海马CA1区相关指标的影响*
赵唯贤,李宜培,李高申,刘建涛,王保伟,郭梅珍
(1.河南医学高等专科学校,郑州 451141;2. 黄河科技学院, 郑州 450006)
阿尔茨海默病(alzheimer’s diseas,AD)是一种以进行性认知障碍和记忆能力损害为主的中枢神经系统退行性疾病,其起病潜隐,病程呈进行性发展,甚至导致痴呆。随着社会的发展,人们平均寿命的增加,AD作为当今最常见的痴呆类型,逐渐成为威胁人类健康的最重要疾病之一[1]。本研究通过观察逍遥散干预后AD大鼠模型海马相关指标的变化,旨在为未来AD的治疗提供实验依据。
1 材料
1.1 动物
采用清洁级SD雄性大鼠,鼠龄在4~5个月,体质量(250±20)g,购自河南省实验动物中心(批号SCXX(豫)2010-0002)。
1.2 药物
逍遥散组成:柴胡、当归、白芍、茯苓、炙甘草、生姜、薄荷,各药间按10∶10∶10∶10∶5∶1∶1比例配比,由我院科研制剂室严格按中药煎剂制备流程制作。于每日用药前2 h开始即时配备,最后浓缩药液浓度为2 g/mL,备用。奥拉西坦药粉(奥拉西坦胶囊,石药集团欧意药业有限公司提供,400 mg/粒,批号05110703),于每日用药前30 min用常温蒸馏水稀释成浓度为150 mg/mL的奥拉西坦溶液,备用。
1.3 试剂
D-半乳糖(D-gal,Genview公司产品,北京鼎国昌盛生物技术有限公司分装,批号22L10133)、A-β1~42peptide(北京博奥森生物技术有限公司提供,批号990901)、PP2A(蛋白磷酸酶-2A)-antibody(abgent,编号 AJ1644a)、GSK-3β(糖原合成酶激酶-3β)、antibody(CST,编号 9315s)、冷冻包埋剂 McCormick(USA)、TritonX-100 Amresco(USA)。
1.4 仪器
DMS2 型 Morris 水迷宫系统(中国医学科学院药物研究所)、蓝星 B 型脑立体定位仪2H-(安徽淮北正华生物仪器设备有限公司产)、洁净工作台(上海博迅实业有限公司医疗设备厂)、Image-pro Plus 5.0 图像分析系统。
2 方法
2.1 动物分组
将大鼠适应性喂养 3 d,光照节律12L∶12D(6∶00~18∶00),室温22~24℃,湿度30%~40%,喂食普通鼠用颗粒饲料(河南省实验动物中心提供),自由饮水。根据水迷宫实验结果,留用成绩最优者作为正式实验用大鼠,并按随机数字表法分为生理组(A 组)、模型组(B 组)、西药组(C 组)和中药组(D组)。
2.2 模型制作
B、C、D 3组采用 D-gal 腹腔注射和 A-β1~42peptide 双侧海马注射联合造模[2~4]。方法:①自造模第1天始,每天上午9∶00~10∶00按1 mL/100 g剂量,大鼠左下腹腹腔注射D-gal(浓度:10 mg·mL-1)连续42 d;②D-gal造模结束,大鼠腹腔注射 10% 水合氯醛(0.4 mL/100 g),麻醉后固定在脑立体定位仪,常规消毒,正中矢状切开皮肤,确定左右侧海马位置,牙科钻开颅暴露硬脑膜,将事前孵育好的A-β生理盐水溶液(浓度:5μg·μL-1),用微量注射器在10 min内每侧海马缓慢注入2 μL。A组用等体积灭菌生理盐水如前进行海马、腹腔注射造模。
2.3 干预方法
自全部造模结束后的第4天,每天上午9∶00对各组大鼠进行灌胃给药干预,每日灌胃1次,连续干预治疗28 d,灌胃体积均为0.5 mL/100 g。A、B组均采用生理盐水灌胃, C、D组分别采用奥拉西坦溶液和逍遥散煎剂灌胃。
2.4 标本取材
干预治疗完成后第4天,用10%水合氯醛(0.4 mL/100 g)腹腔注射麻醉,断头处死取出大脑组织,放在滴有4℃的4%戊二醛固定液的蜡板上(蜡板放在冰盒上),迅速用刀片从正中剖开大脑,用注射器抽取4℃的4%戊二醛固定液冲洗大脑组织,冲洗固定1~2 min迅速分离海马,切成1 mm×1 mm×1 mm小块,分组标记并放入装有4℃的4%戊二醛固定液磨口玻璃瓶中密封,4℃保存待检。
2.5 石蜡切片制备
将大鼠海马进行修块、包埋和切片,控制各组中每个指标的切片平面相近。
2.6 免疫组织化学染色程序(ABC法)
将切片从4℃冰箱中取出室温放置20 min,在0.5% TritonX-100溶液中37℃孵育10 min。10%的正常羊血清原液封闭(用0.5% TritonX-100 溶液稀释)室温轻摇1 h,吸掉封闭血清,加入用5%羊血清和0.5% TritonX-100 混合液稀释的一抗(PP2A稀释度为1∶200,GSK-3β稀释度为1∶150),室温孵育3 h。加入生物素标记的二抗(用5%羊血清和0.5% TritonX-100 混合液稀释,稀释度为1∶500),室温孵育1 h;加入配好的ABC反应液(1∶100),室温孵育2 h。
2.7 图像处理
选取每批每组冠状切面相似的切片进行照像,图像在Image-pro Plus 5.0 图像分析系统中进行分析。
2.8 统计学方法
采用SPSS 11.5统计软件进行统计分析,4组间比较用单因素方差分析,组间两两比较采用LSD-t检验,检验水准α=0.05。
3 结果
大鼠海马CA1区PP2A和GSK-3β的阳性反应物呈棕黄色颗粒,主要表达于胞浆和细胞核。图像及数据分析显示,PP2A在海马CA1区的表达,生理组中PP-2A阳性细胞数量较多,而模型组阳性细胞数量明显减少,阳性物面积、MOD、IOD均有明显下降(P<0.05);经药物干预治疗后,西药及中药组PP-2A阳性细胞数量、阳性物面积、MOD、IOD较模型组均有明显增加(P<0.05)(见表1)。生理组中GSK-3β阳性细胞数量较少,而模型组中GSK-3β阳性细胞数量、阳性物面积、MOD、IOD均较生理组有明显上升(P<0.05);经药物干预后,中西药组GSK-3β阳性细胞数量、阳性物面积、MOD、IOD均较模型组明显下降(P<0.01)(见表2)。
4 讨论
GSK-3β属于蛋白激酶,与神经退行性病变有密切联系。在AD 的病理形成过程中,它使微管相关蛋白(Tau 蛋白)磷酸化,Tau 磷酸化后导致微管蛋白不稳定,聚集成神经纤维缠结,导致神经元可塑性改变及神经元退行性变化[5]。另外,GSK-3β可致使大鼠海马神经元内可溶性Aβ前体蛋白(SAPP) 沉积而形成老年斑,而PP-2A在信号传导中承担着负性调节作用。有研究认为,PP2A 活性降低可能是导致AD脑中Tau蛋白过度磷酸化的原因[4]。在AD模型大脑的病变区域PP-2A的表达和活性上调,能使GSK-3Ser9 去磷酸化,激活GSK-3[6]。在细胞的凋亡、增生、分化、代谢中起重要作用。
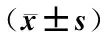
表1 PP2A在海马CA1区表达的变化
注:与生理组比较:1)P<0.05;与模型组比较:2)P<0.05

表2 GSK-3β在海马CA1区表达的变化
注:与生理组比较:1)P<0.05;与模型组比较:2)P<0.01
现在研究多认为,AD发病其基本病机为五脏虚衰, 特别强调肾虚精亏的作用[7,8],似淡化了肝在AD发病中的作用。实际上,AD早期常表现为典型的抑郁症状和对日常活动的兴趣丧失、记忆力减退、智力下降、意念消极、性格改变等,中医临床常将其归属于“呆病”、“郁证”等门类。当今社会中老年人独身居住、孤独寂寞,加重了情绪压抑;离异丧偶或子女不孝,更导致精神创伤,这些社会问题均促成情志的失调而引起肝的疏泄失常。百病生于气,气行则血畅、水湿行、清窍聪、神明清、百病无由;肝血足则肾精充,髓海得养,神魂安藏。因此,“肝气郁结”在今日社会中对本病的发病具有重要意义。
逍遥散为疏肝解郁、健脾和营的重要方剂,其在精神科应用所涉及到的疾病(症)种类就有13种,包括隐匿性抑郁症、忧郁症、癔症、神经官能症等[9]。有研究显示,逍遥散可提高小鼠学习记忆能力,降低潜伏时间,提高脑组织匀浆超氧化物歧化酶、胆碱乙酰转移酶、单胺类氧化酶的活性,降低丙二醛含量和乙酰胆碱酯酶活性[10]。研究发现,蛋白激酶C(PKC)在细胞凋亡中的作用日益突出,PKC活性过高或过低都会影响到细胞内信号的传导,导致细胞的生长失常或凋亡。经逍遥散治疗后应激大鼠海马突触体PKC活性升高的幅度明显小于病理对照组[6]。临床方面,朱振铎认为七情失调、情志抑郁不遂是AD的主要病因。而此因素致肝疏泄功能减退、肝郁气滞,稍受刺激即抑郁难解,久而成呆。因而,以疏肝解郁组方观察组对记忆力等综合积分明显提高[11]。
本研究提示,经逍遥散干预后PP-2A在大鼠海马CA1区的表达中,阳性细胞数量较模型组明显增加,阳性物面积、MOD、IOD也均有明显增加(P<0.05)。而GSK-3β经逍遥散干预后,阳性细胞数量、阳性物面积、MOD、IOD下降均有明显的统计学意义(P<0.05)。
因此,以疏肝立法从一个方面提示了对AD模型某个环节的影响作用。随着AD发病率的上升,对家庭和社会带来的沉重负担也日益凸显,成为严重的社会问题,而加强相关面的研究已成为医务人员乃至政府工作的重要任务。
[1] 苏芮,韩振蕴,范吉平,等. “毒损脑络”理论在阿尔茨海默病中医研究领域中的意义[J].中医杂志,2011,52(16):1370-1371.
[2] 崔旭,李文彬,张炳烈.D一半乳糖对神经元和成纤维细胞拟老化作用的实验研究[J]. 中国应用生理学杂志,1997,13(2):131-133.
[3] 赵保胜,徐暾海.老年性痴呆疾病模型的建立[J].中国实验方剂学杂志,2011,17(6):274-276.
[4] 李林,茹立强. D-半乳糖-Aβ复合造模致大鼠学习记忆功能障碍及丹参酮治疗作用的研究[J].江西医学院学报,2009,49(1):13.
[5] 孙国杰,周华,杜艳军,等. 针灸预处理对AD大鼠海马组织GSK-3β和PP2A影响的实验研究[J].时珍国医国药,2011,22(3):732~733.
[6] 敖海清,徐志伟,严灿,等.逍遥散对应激大鼠海马突触体内PKC活性及Ca2+浓度的影响[J]. 山东中医杂志,2006,25(2):112-114.
[7] 傅华洲.中医药治疗老年性痴呆患者35 例[J].中医杂志,2011,52(增刊):103-104.
[8] 朱书秀,孙国杰.电针对阿尔茨海默病大鼠海马区胶质细胞活化及神经元超微结构的影响[J]. 中医杂志,2009,50(6):522-525.
[9] 熊静悦, 曾南, 张崇燕,等.逍遥散抗抑郁作用研究[J].中药药理与临床,2007, 23(1):3-5.
[10] 吴红彦,王虎平,王彩霞. 黑逍遥散对老年性痴呆的防治作用及其机制研究[J].时珍国医国药,2011,22(4):912-913.
[11] 朱振铎,薛一涛,霍青,等.山东中医药大学学报[J]. 1998,22(5):346-348.

