COPD纤维支气管镜肺泡灌洗液中可溶性晚期糖基化终末产物受体水平的临床意义
杨兴官,雷 超,胡占升
目前,COPD确切的发病机制仍然不清楚。可溶性晚期糖基化终末产物受体(soluble receptor for advanced glycation end-products,sRAGE)是一种能够与晚期糖基化终末产物(AGEs)、钙粒蛋白S100A、高迁移率族蛋白B1(HMGB1)、S100P及淀粉样肽等多种配体结合的可溶性受体,通过配体结合形成受体-配体激活物,启动细胞信号转导通路而发挥细胞生物学效应。国外研究证实晚期糖基化终末产物受体(RAGE)与感染、炎症相关[1-3],Buckley等[4]的综述显示RAGE与肺部疾病相关。因此,sRAGE可能在COPD临床诊治中有一定意义。本研究旨在探讨纤维支气管镜肺泡灌洗液中sRAGE水平在COPD中的临床意义。
1 资料与方法
1.1 一般资料 选取2012年10月—2013年5月入住辽宁医学院附属第一医院重症监护病房COPD患者40例为COPD组,COPD的诊断符合中华医学会呼吸病学分会慢性阻塞性肺疾病学组指定的《慢性阻塞性肺疾病诊治指南(2007年修订版)》中的诊断标准[5];排除患有糖尿病、高血压及肿瘤等病史患者。另选取同时期非COPD组患者40例为非COPD组,其中创伤术后13例、药物中毒12例、脑出血8例、离子紊乱7例。两组患者性别构成、年龄、体质指数(BMI)及吸烟率比较,差异均无统计学意义(P>0.05,见表1)。
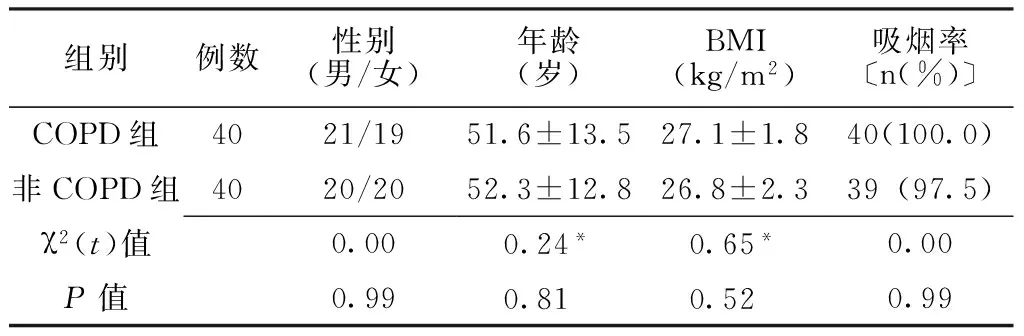
表1 两组患者一般资料比较
注:BMI=体质指数;*为t值
1.2 纤维支气管镜肺泡灌洗液sRAGE水平检测 采集每例患者纤维支气管镜肺泡灌洗液3 ml,用枸橼酸钙抗凝,-20 ℃冰箱保存。人sRAGE抗体试剂盒购自于上海研域生物科技有限公司,采用酶联免疫吸附试验(ELISA)法检测患者纤维支气管镜肺泡灌洗液中sRAGE水平(ng/L),严格按照试剂盒说明操作,患者均签署sRAGE检测以及纤维支气管镜肺泡灌洗术知情同意书。
1.3 肺功能测定 COPD患者均在吸入支气管舒张剂后测定一秒用力呼气容积(FEV1)、用力肺活量(FVC)、FEV1占预计值百分比(FEV1%),将COPD患者分为4级:(1)轻度:FEV1/FVC<70%,FEV1%≥80%,患者有或无慢性咳嗽、咳痰症状;(2)中度:FEV1/FVC<70%,50%≤FEV1%<80%,患者有或无慢性咳嗽、咳痰症状;(3)重度:FEV1/FVC<70%,30%≤FEV1%<50%,患者有或无慢性咳嗽、咳痰症状;(4)极重度:FEV1/FVC<70%,FEV1%<30%,或FEV1%<50%而患者伴有慢性呼吸衰竭[5]。
2 结果
2.1 两组纤维支气管镜肺泡灌洗液sRAGE水平比较 正态性检验结果显示,纤维支气管镜肺泡灌洗液sRAGE水平近似正态分布。COPD组患者纤维支气管镜肺泡灌洗液sRAGE水平为(191±71)ng/L,非COPD组为(55±56)ng/L,COPD组高于非COPD组,差异有统计学意义(t=9.44,P<0.001)。
2.2 不同级COPD患者纤维支气管镜肺泡灌洗液sRAGE水平比较 根据肺功能检测结果,将COPD患者分为轻度COPD组(12例)、中度COPD组(10例)、重度COPD组(10例)以及极重度COPD组(8例)。轻度COPD组纤维支气管镜肺泡灌洗液sRAGE水平为(111±44)ng/L、中度COPD组为(184±45)ng/L、重度COPD组为(226±34)ng/L、极重度COPD组为(273±30)ng/L,各组COPD患者患者纤维支气管镜肺泡灌洗液sRAGE水平比较,差异有统计学意义(F=30.48,P<0.001),且极重度COPD组高于重度COPD组,重度COPD组高于中度COPD组,中度COPD组高于轻度COPD组,差异均有统计学意义(P<0.05)。
2.3 相关性分析 直线相关分析结果显示,COPD患者纤维支气管镜肺泡灌洗液sRAGE水平与FEV1%呈负相关(r=-0.738,P<0.05,见图1)。
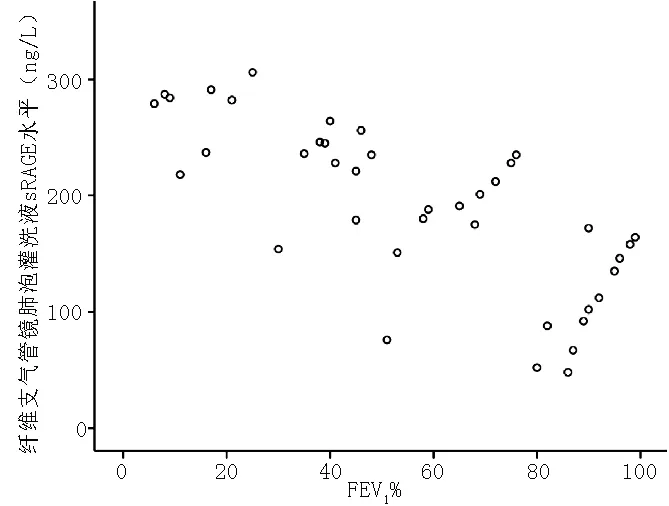
图1 COPD患者纤维支气管镜肺泡灌洗液sRAGE水平与FEV1%的相关性
Figure1 The corelation between concentration of sRAGE in bronchoscopy alveolus lavage fluid and FEV1% in COPD patients
3 讨论
COPD是一种由于吸烟、感染及遗传等多种病因导致的常见呼吸系统疾病。目前,虽然对COPD发病机制的认识依然不是十分清楚,但是认为COPD以气道、肺血管以及实质细胞的慢性炎性反应为特点。COPD发生时,淋巴细胞、单核细胞、中性粒细胞和单核-巨噬细胞大量增加。此类细胞被激活,活化的炎性细胞合成与释放大量的炎性递质,包括白介素(IL)-6、IL-18、白三烯B4、RAGE及肿瘤坏死因子α等[6-7]。这些生物活性递质不仅可以破坏肺部正常生理组织,而且能够促使炎性反应加强。AGEs是在人体内以脂肪、蛋白质、核酸以及糖通过催化反应生成的化合物,存在人体肺、血液、肾脏等多个部位,不易被分解,具有稳定性。在许多细胞如系膜细胞、巨噬细胞、内皮细胞表面存在AGEs 的受体——RAGE,能够和AGEs 结合形成AGEs-RAGE复合物,从而激活细胞内信号转导通路,引起细胞中一系列生物化学反应,导致大量细胞因子、生长因子、活性氧自由基等活性递质合成,释放入血,引起血管内皮细胞损伤或凋亡、血管损伤、血流动力学发生变化、炎性反应等多种病理反应过程。而sRAGE为一种RAGE的变体,可由多种细胞合成与分泌,可以与RAGE竞争结合血浆中AGEs,减少或者阻断AGEs与RAGE的结合,减少内皮细胞的损伤以及还原型辅酶Ⅱ氧化酶(NOX4)等炎性活性递质的释放,因此其是一种RAGE拮抗调节因子,对机体具有一定保护作用。国外研究证实其主要来源于Ⅰ型肺泡上皮细胞[4,8],主要作用是维持肺泡的稳定以及辅助肺的气体交换[9]。
近年来,国外有关sRAGE的研究报道有许多,如在糖尿病、肿瘤、心血管、感染、炎症等方面,在COPD方面的研究文献也有不少,Smith等[10]以及Sukkar等[11]研究报道COPD患者血浆sRAGE水平下降,不过,此类方面研究主要集中在血浆sRAGE方面,而在纤维支气管镜灌洗液sRAGE方面的研究较少;Mauri等[12]研究文献表明急性呼吸窘迫综合征(ARDS)患者以及肺部感染炎症患者肺泡灌洗液中的sRAGE水平升高,而且肺泡灌洗液中的sRAGE水平与血浆sRAGE水平无相关性。国内也有一些关于sRAGE方面的报道,但是主要集中在糖尿病[13]以及肿瘤[14]方面。本研究探讨纤维支气管镜肺泡灌洗液中sRAGE水平在COPD中的临床意义,研究结果显示,COPD组纤维支气管镜肺泡灌洗液中sRAGE水高于非COPD组;纤维支气管镜肺泡灌洗液中sRAGE水平在极重度COPD组高于重度COPD组,重度COPD组高于中度COPD组,中度COPD组高于轻度COPD组。本研究结果与Mauri等[12]的肺炎患者肺泡灌洗液中sRAGE水平增高这一研究结果一致,而且还进一步说明了纤维支气管镜肺泡灌洗液中sRAGE水平与COPD患者病情严重程度相关。因此,纤维支气管镜肺泡灌洗液sRAGE水平可以用来判断COPD患者病情严重程度,可以作为COPD患者预后预测的一个指标。正常生理情况下,纤维支气管镜肺泡灌洗液中的sRAGE水平是极低的,本研究结果中纤维支气管镜肺泡灌洗液sRAGE水平增高的原因,可能的解释是COPD患者由于慢性炎性反应导致Ⅰ型肺泡上皮细胞大量破坏,进而sRAGE大量释放入气道;同时由于感染及炎性反应,血管损伤破坏,血管通透性增强,循环中的sRAGE进入组织,进而通过渗透作用进入气道,导致纤维支气管镜灌洗液sRAGE水平的升高,但是Mauri等[12]认为这与肺功能紊乱严重程度、感染以及机械通气时的潮气量有关。
COPD是一种发病率高、病死率高的慢性呼吸系统疾病,已经成为一个突出的公共卫生问题[5,15]。如果能够争取时间在早期对COPD患者做出正确诊断、能够预测出高危COPD患者预后和在早期积极给予COPD患者恰当的治疗方案,是可以减少COPD患者住院时间,而且能够改善COPD患者预后以及提高COPD患者存活率的。目前,有关于COPD预后指标有很多,例如肺功能测定、BODE指数(body mass index,airflow obstruction,dyspnea,and exercise capacity index,BODE index)[16]、深吸气量(IC)/肺总量(TLC)测定[17]以及呼吸功能检查[18]等,不可否认的是其在COPD预后预测中有一定价值,但是自身都存在一定程度的缺陷:例如特异度不高、灵敏度不高或者检测手段经济费用昂贵等。虽然本研究也存在一些不足之处,未做前瞻性研究,纤维支气管镜肺泡灌洗液中sRAGE水平作为判断COPD患者预后指标的灵敏度以及特异度还有待于进一步研究,但是本研究证实了COPD患者纤维支气管镜肺泡灌洗液中sRAGE水平增高,而且与COPD病情严重程度有关,是其一个危险因素,有可能作为判断COPD患者预后的指标。因此,临床上连续监测COPD患者纤维支气管镜肺泡灌洗液中sRAGE水平有一定临床意义,可以为临床工作者在诊治COPD过程中提供一定的建议。
1 van Zoelen MA,Achouiti A,van der Poll T.The role of receptor for advanced glycation endproducts(RAGE) in infection[J].Crit Care,2011,15(2):208.
2 Kierdorf K,Fritz G.RAGE regulation and signaling in inflammation and beyond[J].J Leukoc Biol,2013,94(1):55-68.
3 Mosquera JA.Role of the receptor for advanced glycation end products(RAGE) in inflammation[J].Invest Clin,2010,51(2):257-268.
4 Buckley ST,Ehrhardt C.The receptor for advanced glycation end products(RAGE) and the Lung[J].J Biomed Biotechnol,2010,2010:917108.
5 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2007年修订版)[J].中华结核和呼吸杂志,2007,30(1):8-17.
6 王彦霞,杨秀芬,游道峰,等.慢性阻塞性肺疾病患者血清NO、TNF-α、hs-CRP水平及临床意义的探讨[J].疑难病杂志,2011,10(3):180.
7 张广梅.慢性阻塞性肺疾病患者血清IL-6、IL-8、高敏C反应蛋白、甲状腺激素水平变化的临床研究[J].实用心脑肺血管病杂志,2012,20(5):791.
8 Kim JK,Park S,Lee MJ,et al.Plasma levels of soluble receptor for advanced glycation end products(sRAGE)and proinflammatory ligand for RAGE(EN-RAGE)are associated with carotid atherosclerosis in patients with peritoneal dialysis[J].Atherosclerosis,2012,220(1):208-214.
9 Demling N,Ehrhardt C,Kasper M,et al.Promotion of cell adherence and spreading:a novel function of RAGE,the highly selective differentiation marker of human alveolar epithelial type Ⅰ cells[J].Cell Tissue Res,2006,323(3):475-488.
10 Smith DJ,Yerkovich ST,Towers MA,et al.Reduced soluble receptor for advanced glycation end-products in COPD[J].Eur Respir J,2011,37(3):516-522.
11 Sukkar MB,Wood LG,Tooze M,et al.Soluble RAGE is deficient in neutrophilic asthma and COPD[J].Eur Respir J,2012,39(3):721-729.
12 Mauri T,Masson S,Pradella A,et al.Elevated plasma and alveolar levels of soluble receptor for advanced glycation endproducts are associated with severity of lung dysfunction in ARDS patients[J].Tohoku J Exp Med,2010,222(2):105-112.
13 杨生.2型糖尿病合并下肢血管病变患者与晚期糖基化终末产物及脂联素相关性研究[J].中国全科医学,2011,14(5):1643-1645.
14 雷超,胡占升.慢性阻塞性肺疾病患者血浆晚期糖基化终末产物和可溶性糖基化终末产物受体浓度变化及其临床意义[J].中国全科医学,2014,17(8):875-878.
15 张景,盛艳玲.慢性阻塞性肺疾病急性加重期的诊治 [J].中国临床医生,2013,41(2):7.
16 陈贝贝,谢俊刚.FEV1%预计值与BODE指数在COPD临床评价中的价值[J].华中科技大学学报:医学版,2012,41(2):230-233.
17 Casanova C,Cote C,de Torres JP,et al.Inspiratory-to-total lung capacity ratio predicts mortality in patients with chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2005,171(6):591-597.
18 Schlecht NF,Schwartzman K,Bourbeau J.Dyspnea as clinical indicator in patients with chronic obstructive pulmonary disease[J].Chron Respir Dis,2005,2(4):183-191.

