PML/RARα融合基因不典型FISH信号模式的APL的实验与临床特征研究
刘淑媛,栾树清,闻芳,简正伟,万腊根,张长林
(南昌大学第一附属医院检验科,江西南昌330006)
PML/RARα融合基因不典型FISH信号模式的APL的实验与临床特征研究
刘淑媛,栾树清,闻芳,简正伟,万腊根,张长林
(南昌大学第一附属医院检验科,江西南昌330006)
目的探讨伴有PML/RARα不典型FISH信号模式的急性早幼粒细胞白血病的临床和实验室特征。方法采用PML/RARα的DCDF-FISH技术、染色体核型分析及FLT3-ITD突变检测技术对初诊的52例急性早幼粒细胞白血病患者骨髓标本进行检测,比较FISH信号模式与其他检测结果的关系。结果在检测的52例标本中,51例存在PML/RARα融合基因,阳性率高达98.1%;51例FISH阳性患者中38例为典型的1R1G2F信号,13例呈不典型信号模式,其中2例为1R1G1F,3例为1R1G3F,6例为2R2G1F,1例为1R2G1F,1例为2R1G1F。将不典型FISH信号模式组和典型FISH信号模式组进行比较,我们发现不典型组的高白患者比率较典型组高(P>0.05);且不典型FISH信号模式组中复杂核型与FLT3-ITD突变的发生率明显高于典型信号组(P<0.05)。结论具有不典型FISH信号模式的APL患者常伴有复杂核型,FLT3-ITD突变等预后不良的指标,其具体作用方式仍有待进一步探讨。
急性早幼粒细胞白血病;不典型FISH信号模式;FLT3-ITD突变;复杂核型异常
急性早幼粒细胞白血病(Acute Promyelocytic Leukemia,APL)是一种以早幼粒细胞分化受阻为主要特征的急性髓系白血病(Acute myeloid leukemia, AML)。研究表明,90%以上的APL患者的白血病细胞中均存在非随机染色体易位t(15;17)(q22;q21),该易位使得17号染色体上的维甲酸受体(retinoic acid receptor,RARα)基因与位于15号染色体上的PML(Promylocytic leukemia)基因发生融合,形成PML-RARα融合基因,并编码相应的融合蛋白[1]。PML-RARα融合蛋白以“显性负调控”的方式抑制野生型PML和RARα的功能,导致骨髓粒细胞分化受阻,被认为是APL发病的关键因素[1,2]。而全反式维甲酸(ATRA)等药物可以靶向PML/RARα蛋白降解,并诱导APL细胞分化,使得APL成为一个可以治愈的肿瘤[3]。因此,t(15;17)相关融合基因PML/RARα的检测对APL的诊断、预后评估、个体化治疗具有重要的价值。
目前,用于检测PML/RARα融合基因的方法主要有染色体显带分析、逆转录-PCR方法和荧光原位杂交方法(FISH)等[4-6]。FISH特别是双色双融合荧光原位杂交技术(DCDF-FISH),作为一种具有灵敏度高、特异性强、不受细胞周期限制的分子生物学技术,已经广泛运用于临床。采用DCDF-FISH技术检测PML/RARα融合基因时,典型的信号模式为一红一绿两融合(1R1G2F)。当出现变异性和复杂性t(15;17)易位时,FISH的信号模式可能发生改变。因此研究不同的DCDF-FISH信号模式对APL疾病的进展、治疗以及预后的影响,具有非常重要的意义。本研究采用DCDF-FISH技术对52例初诊的APL进行PML/RARα融合基因检测,发现13例具有不典型FISH信号模式,并通过细胞遗传学、形态学、分子生物学等的联合分析,并对其临床及实验室特征进行探讨。
1 材料与方法
1.1 临床病例初诊的52例APL患者均来自2010年至2012年南昌大学第一附属医院血液科,所有患者均根据WHO诊断标准,经形态学、细胞遗传学、免疫学及分子生物学综合检测确诊为APL,其中男性患者29例,女性患者23例,中位年龄为35岁(9~61岁)。
1.2 方法
1.2.1 常规细胞遗传学分析治疗前抽取骨髓标本2ml,有核细胞计数后按(1~2)×106/ml进行直接法或短期培养法制备染色体,并采用G显带技术进行核型分析,分析20个分裂相细胞。染色体核型按照《人类细胞遗传学国际命名体制(ISCN2005)》的有关规定加以识别和描述。
1.2.2 FISH分析检测PML/RARα融合基因的双色双融探针购自美国Vysis公司,探针应用SpectrumOrangeTM标记PML基因、SpectrumGreenTM标记RARα基因。FISH操作步骤包括:滴片、变性、杂交、洗涤、复染以及荧光显微镜观察间期细胞和分裂期细胞杂交信号。
1.2.3 FLT3-ITD突变检测抽取患者骨髓标本2ml,采用上海飞捷生物公司试剂盒提取细胞DNA。针对FLT3基因设计引物,正义链:5’-GCAATTTAGGTATGAAAGCCAGC-3’;反义链:5’-CTTTCAGCATTTTGACGGCAACC-3’。PCR反应体系10μl,反应条件为:95℃预变性5min后,95℃变性20s,52℃退火20s,72℃延伸20s,30个循环,最后72℃延伸7min,反应产物4℃保存。取PCR产物于3%琼脂糖凝胶,1×TAE液中电泳20min,用紫外光透视仪分析图像并照相。野生型扩增产物为329bp处出现单一峰,ITD突变型扩增产物为在大于329bp处出现的特异性条带。
1.2.4 统计学分析由于存在标本理论频数<5,采用Fisher精确概率法进行统计分析,以P<0.05为具有统计学差异。
2 结果
2.1 DCDF-FISH检测PML/RARα融合基因常见信号模式采用DCDF-FISH检测PML/RARα时,正常细胞信号模式为2红2绿(2R2G)模式(图1a)。在典型的t(15;17)易位的细胞中,可见1红1绿2融合(1R1G2F)信号模式,其中1红1绿分别是正常的PML和正常的RARα基因,2个融合信号分别PML/RARα和RARα/PML信号(图1b)。除1R1G2F信号模式(典型信号模式),我们在实验诊断中还发现5种信号模式,分被为1R1G1F,1R1G3F,2R2G1F,1R2G1F,2R1G1F(图1c-g)。
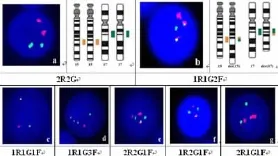
图1 DCDF-FISH方法检测PML/RARα融合基因的信号模式
已进行FISH检测的52例初诊APL患者中,51例患者存在融合信号,阳性率为98.1%,其中的38例为1R1G2F信号模式;13例出现不典型信号模式,其中2例为1R1G1F,3例为1R1G3F并伴有1R1G2F,6例为2R2G1F,1例为1R2G1F,1例为2R1G1F(表1、图2、图3)。
2.2 FISH信号模式与染色体核型关系在52例APL患者中,46例进行了常规细胞遗传学分析,其中存在t(15;17)易位的患者27例,15例患者为正常核型,4例患者无分裂象,阳性率为58.7%。在13例含不典型信号模式的标本中,12例进行了核型分析,结果显示6例为复杂异常核型,占46.2%,其中4例为伴t(15;17)(q22;q21)易位的复杂核型异常;2例为单纯的t(15;17)(q22;q21);正常核型3例;未见分裂象1例。38例典型信号模式组中,34例进行了核型分析,其中1例存在t(15;17)(q22;q21),并伴1q-、7q+、+r等复杂结构异常,占2.63%;另有18例为单纯的t(15;17)(q22;q21);正常核型12例;未见分裂象3例。不典型FISH信号模式组中复杂核型比例较典型信号组高,且两者差异显著(P=0.0006)。

表1 13例具有不典型FISH信号模式的APL患者实验室检测结果

注:a为7号患者易位模式;b为5号患者易位模式图2 2R2G1F和1R1G3F信号模式的染色体分析
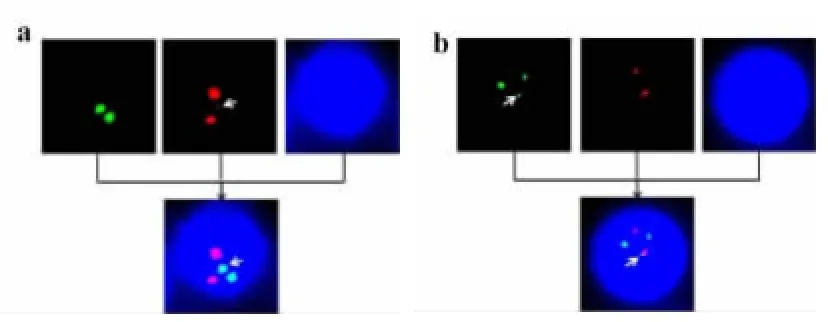
注:a箭头显示异常的红色信号和融合信号;b箭头显示异常的绿信号和融合信号图3 2R1G1F和1R2G1F的FISH信号模式
2.3 初诊WBC计数与不典型PML/RARα的FISH信号关系13例具有不典型FISH信号模式的APL患者初诊外周血白细胞计数为16.52(0.7~60.19)×109/L,其中高白细胞(>10×109/L)患者6例,所占比46.16%;而38例具有典型FISH信号模式的APL患者初诊WBC为12.05(0.5~75.8)×109/L,其中高白细胞患者11例,占28.9%。具有不典型FISH信号模式的患者中高白细胞患者较典型FISH信号模式组多,但两者无统计学差异显著性(P>0.05)。
2.4 FLT3-ITD基因突变与不典型PML/RARα的FISH信号关系52例APL患者中,有47例进行了FLT3-ITD突变检测,7例FLT3-ITD突变阳性,阳性率为14.9%。13例不典型FISH信号模式的APL患者中有6例进行了FLT3-ITD突变检测,4例阳性,阳性率为66.7%;而进行突变检测的38例典型信号模式组3例发现FLT3-ITD突变,突变率为7.89%,明显低于前者,具有统计学意义(P= 0.0026)。
3 讨论
APL是AML中一个比较特殊的亚型,约占所有AML的10%,并且具有特异的形态学特征及细胞分子遗传学特征;此病起源于髓系早幼粒细胞,由于其肿瘤细胞中存在较多的促凝颗粒,临床上多伴发弥散性微血管凝血,易导致APL患者的早期死亡。目前,对于APL患者的初始治疗多采用联合维甲酸/亚砷酸及蒽环类药物进行诱导分化治疗,以降低患者死亡率,延长患者生存寿命[3]。研究发现,90%以上的APL患者具有特征性的t(15;17)(q22;q21)染色体易位形成的PML-RARα融合基因[1]。本研究中,通过对52例APL患者进行检测,DCDF-FISH法检测PML-RARα融合基因的阳性率高达98.1%,而常规遗传学核型分析t(15;17) (q22;q21)阳性率仅为54.3%,表明DCDF-FISH检测PML-RARα融合基因敏感度高,对诊断APL具有决定性意义。
采用DCDF-FISH技术检测PML/RARα时,典型的易位t(15;17)易位形成的两条衍生的染色体der(15)和der(17)都有融合信号(图1b),但是由于在易位过程中会发生部分缺失、扩展或涉及到3条以上的染色体,FISH信号模式就会发生改变。在本研究中,我们发现13例患者的FISH结果呈不典型信号模式,占总体的25.5%。其中以2R2G1F(6例)和1R1G3F(3例)信号模式为主,通过染色体分析发现,2R2G1F信号模式为三条染色体循环易位(图2a模式),如7号患者易位方式为6p21-qter易位到17q22;17(17q21-q22)易位到15q22;15q22-qter易位到6p21(图2a)。1R1G3F由ider(17)(q10)t (15;17)产生,如5号患者中两个融合信号时由于衍生的17号染色体发生长臂等臂导致(图2b)。此外,我们还发现两例隐形易位的患者,这两位患者染色体核型为正常核型,DCDF-FISH可以看见一个非常细小的荧光信号(图3a-b示),很容易作为非特异性信号,容易造成假阴性结果。最近,Campbell LJ等总结了10例这样的病例,发现采用Vysis公司SF探针(single fusion probe)和分离探针(break apart probe)都不能检测到融合信号,采用Vysis公司的DF探针(dual fusion probe)检测到3例阳性患者(3/10),而采用Cytocell公司的DF探针以及ES探针检测阳性率为100%[7]。通过进一步分析Campbell LJ等发现该信号模式为小片段的PML或RARα插入导致,由于Vysis公司探针过长,不易与小片段杂交,从而导致阴性的出现,而Cytocell公司探针相对比Vysis公司小的多,容易与小片段杂交,因此可以检测到小片段的异常。因此,在选择FISH探针时要选择大小适中的探针,探针太小容易出现非特异信号,容易造成假阳性,而探针太大有可能会出现假阴性。
大量研究结果表明具有单纯的t(15;17)(q22; q21)的APL患者对ATRA敏感,CR(complete remission)率高(可达90%),无病生存率高,五年生存率可达到80%,预后好。但是,除t(15;17)(q22;q21)外,还伴有一些其他染色体异常(additional chromosome abnormalities,ACAs)或者FLT3-ITD突变的患者[8-11],对ATRA反应性差,无病生存率和五年生存率明显低于低于单纯性t(15;17)(q22;q21)的患者。本研究中发现通过核型分析我们发现在38例具有典型FISH信号模式的APL患者中有1例伴有复杂核型;而13例具有不典型FISH信号模式的APL患者中有6例具有复杂核型;两者差异有显著性(P<0.05)。另外,在我们的研究中还发现含有不典型FISH信号模式的患者FLT3-ITD突变明显高于典型信号模式的患者,表明具有不典型FISH信号模式的患者存在更为复杂的遗传学异常,提示不典型信号模式的患者相对典型信号患者预后要差。
APL初始白细胞数也是评价APL患者预后的一个指标。多项研究发现,当APL初始白细胞数大于10×109/L时,患者无病生成率和总生存率都明显低于初始白细胞数低于10×109/L的患者[12]。在本研究的52例患者中,具有不典型信号模式的患者中白细胞数大于10×109/L的患者(46.16%)比典型信号模式的患者(28.9%)多(P=0.256),虽然两者无显著的统计学意义,但也能提示不典型信号模式的患者预后更差可能。
以上结果表明,具有不典型FISH信号模式的APL患者常伴有ACAs,FLT3-ITD以及高白细胞血症等预后差的指标。
[1]Biondi A,Rambaldi A,Alcalay M,et al.RAR-alpha gene rearrangements as a genetic marker for diagnosis and monitoring in acute promyelocytic leukemia[J].Blood,1991,77(7):1418-1422.
[2]Melnick A,Licht JD.Deconstructing a disease:RARalpha,its fusion partners,and their roles in the pathogenesis of acute promyelocytic leukemia[J].Blood,1999,93(10):3167-215.
[3]Wang ZY,Chen Z.Acute promyelocytic leukemia:from highly fatal to highly curable[J].Blood,2008,111(5):2505-2515.
[4]王蓉,缪扣荣,仇海荣,等.间期荧光原位杂交和常规染色体分析诊断急性早幼粒细胞白血病的比较[J].中国实验血液学杂志, 2011,19(4):983-986.
[5]Lewis C,Patel V,Abhyankar S,et al.Microgranular variant of acutepromyelocyticleukemiawithnormalconventional cytogenetics,negative PML/RARA FISH and positive PML/RARA transcripts by RT-PCR[J].Cancer Genet,2011,204(9):522-523.
[6]江梅,万腊根.RQ-PCR技术检测白血病融合基因及其临床应用[J].实验与检验医学,2010,28(5):469-472.
[7]Campbell LJ,Oei P,Brookwell R,Shortt J,et al.FISH detection of PML-RARA fusion in ins(15;17)acute promyelocytic leukaemia depends on probe size[J].Biomed Res Int,2013,2013:164501.
[8]KaleemZ,WatsonMS,ZutterMM,etal.Acutepromyelocytic leukemia with additional chromosomal abnormalities and absence of Auer rods[J].Am J Clin Pathol,1999,112(1):113-118.
[9]马力,李建勇,潘金兰,等.伴有复杂核型的急性早幼粒细胞白血病的临床及实验研究[J].现代肿瘤医学,2010,18(3):0552-0554.
[10]Thiede C,Steudel C,Mohr B,et al.Analysis of FLT3-activating mutations in 979 patients with acute myelogenous leukemia:association with FAB subtypes and identification of subgroups with poor prognosis[J].Blood,2002,99(12):4326-4335.
[11]Gallagher RE,Moser BK,Racevskis J,et al.Treatment-influenced associations of PML-RARα mutations,FLT3 mutations,and additional chromosome abnormalities in relapsed acute promyelocytic leukemia[J].Blood,2012,120(10):2098-108.
[12]Fenaux P,Chastang C,Chevret S,et a1.A randomized comparison of all transretinoic acid(ATRA)followed by chemotherapy and ATRA plus chemotherapy and the role of maintenance therapy in newly diagnosed acute promyelocytic leukemia[J].Blood,1999,94(4): 1192-1200.
The clinical and laboratory research of thirteen acute promyelocytic leukemia patients with atypical signal modes in FISH detection of PML/RARα fusion
LIU Shuyuan,LUAN Shuqing,WEN Fang,et al.
The Clinical Laboratory of the First Affiliated Hospital of Nanchang University,Nanchang 330006,China
Objective To explore the clinical and laboratory characteristics of acute promyelocytic leukemia with atypical signal modes in FISH detection of PML/RARα fusion.Methods Bone marrow samples from 52 patients with newly diagnosed acute promyelocytic leukemia were detected with DCDF-FISH for PML/RARα,karyotype analysis and PCR for gene mutation of FLT3-ITD.The relations between signal modes of DCDF-FISH and other test results were analyzed.Results PML/RARα fusion was identified in 51(98.1%)among 52 patients.We found that 38 cases had a typical signal mode(1R1G2F)and 13 cases had atypical signal modes including 2 1R1G1F,3 1R1G3F,6 2R2G1F,1 1R2G1F,1 2R1G1F.Comparing the clinical and laboratory characteristics of these two groups,we found that a high WBC was more prevalent in patients with atypical FISH signal modes(P> 0.05),and the atypical FISH signal modes were associated with higher percentage of complex chromosome abnormalities and FLT3-ITD(P<0.05).Conclusion APL patients with atypical FISH signal modes are often accompanied by some poor prognostic indicators such as complex chromosome abnormality and FLT3-ITD mutation,but the mechanism needs to be further discussed.
APL;Atypical FISH signal mode;FLT3-ITD mutation;Complex chromosome abnormality
R733.7
A
1674-1129(2014)04-0374-04
10.3969/j.issn.1674-1129.2014.04.004
2014-03-17;
2014-07-03)
江西省自然科学基金项目(编号:20122BAB205025)作者简介:刘淑媛,女,出生于1989年4月,南昌大学2012级临床检验诊断学硕士研究生,研究方向:白血病的分子诊断。通信作者:张长林,男,出生于1984年8月,毕业于上海交通大学,硕士学位,中级职称,研究方向:白血病的分子诊断。

