体外诊断试剂行业标准制定工作的现状分析及展望
刘 艳,孙 楠,王玉梅,高尚先,张春涛,杨昭鹏
中国食品药品检定研究院卫生部生物技术产品检定及标准化重点实验室,北京市,100050
体外诊断试剂行业标准制定工作的现状分析及展望
【作者】刘 艳,孙 楠,王玉梅,高尚先,张春涛,杨昭鹏
中国食品药品检定研究院卫生部生物技术产品检定及标准化重点实验室,北京市,100050
该文简单介绍了标准的工作程序,总结了体外诊断试剂行业标准工作的重要性,对近10年的工作情况做了汇总分析,提出了在立项、参与度、与标准物质的联系、人才建设、制定周期等方面存在的问题和解决办法,展望了未来发展。
医疗器械;体外诊断试剂;标准
按医疗器械管理的体外诊断试剂(IVD产品),是指可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品[1]。2007年,《体外诊断试剂注册管理办法(试行)》的实施,解决了长期以来对IVD产品按药品和医疗器械分类管理的状态,明确规定除了国家法定用于血源筛查的体外诊断试剂及采用放射性核素标记的体外诊断试剂产品外,其他体外诊断试剂产品均按医疗器械注册管理,从而基本上实现了对IVD产品的统一管理。国家食品药品监督管理总局(CFDA)对包括体外诊断试剂在内的医疗器械产品行业标准制定工作的支持力度不断加大,同年,一些新的IVD行业标准陆续立项制定并发布实施。而2014年7月国家食品药品监督管理总局局令第5号发布实施新的《体外诊断试剂注册管理办法》,其中也特别强调了行业标准的作用。
1 行业标准工作的重要性
标准是一种规范性文件[2]。科学技术的迅速发展,为体外诊断试剂行业领域的技术革命奠定了基础,IVD产品的灵敏度、特异性大大提高,应用范围扩大,操作门槛降低,加之民众对健康生活质量的要求越来越高,IVD产品得到了越来越广泛的应用。虽然IVD产品风险较低,但其临床检验的不准确,也会给病人带来误诊,影响治疗。另外,根据我国分类注册管理的规定,同一类产品可能在不同属地的监管部门审批。由于没有统一的国家标准和行业标准,不同地区之间在审批同一类产品时会有很大的差异,使技术审评工作复杂程度增加,也进一步造成产品标准的混乱、生产企业的相互竞争不在一个水平上,给后续的市场抽验等监管工作带来难度和混乱。这些都不利于IVD行业的规范和发展。《体外诊断试剂注册管理办法》中第二十二条明确规定“申请人应依据国家标准、行业标准及有关文献资料,拟订产品技术要求”。
另外,我国IVD产业市场需求的潜力巨大,已然成为一个朝阳产业,“十二五”规划中,IVD行业是国内重点支持发展的产业之一,预计到2015年市场规模将达到208亿元,是2010年的2倍[3]。然而,目前我国的高端市场仍然被集成度较高的大型跨国企业掌控,国内企业的市场规模往往较小,研发投入少,低水平重复生产的现象比较普遍。这也提示应提升对标准重要性的认知程度,及时引进转化国际标准,加快国内行业标准体系建设,不断提升我国IVD产品的竞争力。
2 行业标准制定的工作程序
医疗器械行业标准制定工作程序可分为9个阶段[4]:预阶段、立项阶段、起草阶段、征求意见阶段、审查阶段、批准阶段、出版阶段、复审阶段和废止阶段。根据各阶段的工作内容,一项标准从立项到出版可长达3年时间。目前,体外诊断试剂行业标准的制定一般要求当年立项,当年报批,时间周期相对较短。另外,为了缩短标准制定周期,尤其是应对突发事件的需要,标准的制定也可以使用快速制定程序。国家标准化组织(ISO)在医学检验领域成立了临床实验室检测和体外诊断系统技术委员会(ISO/ TC212),负责实验室质量管理、参考系统、含量测定等领域的标准化工作,在我国,与之对口的机构是全国医用临床检验实验室和体外诊断系统标准化技术委员会(SAC/TC136),成立于1988年。国家局则设立了医疗器械标准管理中心,通过对各标技委的统一指导协调实现对标准工作的管理。
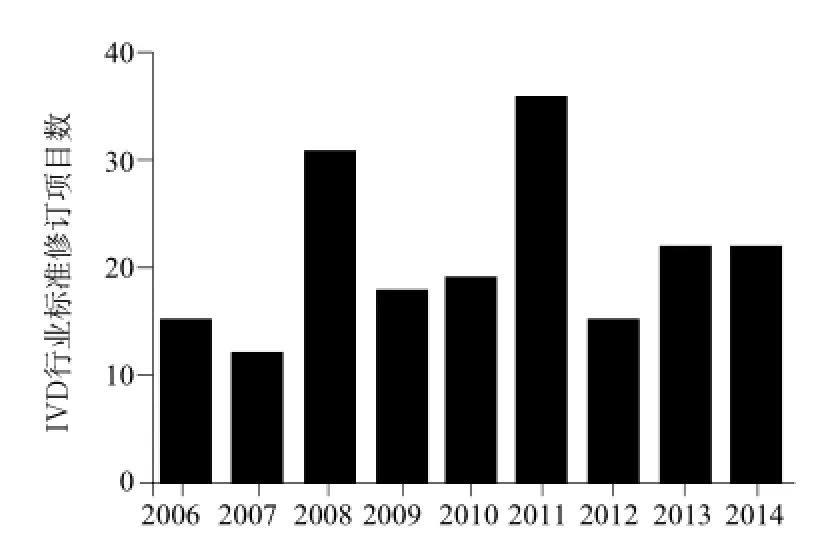
图1 历年IVD行业标准制修订项目立项统计Fig.1 Numbers of IVD industrial standards from 2006 to 2014
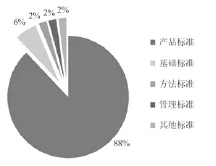
图2 不同类别IVD行业标准项目统计Fig.2 Types of IVD industrial standards from 2006 to 2014
3 IVD行业标准制定工作现状分析及展望
3.1 基本情况汇总
如图1所示,2006年至今,标准制修订项目数总体呈逐年上升的趋势,已完成了190项医疗器械体外诊断试剂行业标准的制修订和立项工作,其中98项标准已陆续发布或实施,对相关产品的研发、注册审批和市场监管工作起到了重要的技术支撑作用。因为2006年之前标准制修订工作基本处于一种空白状态,因此,上述标准中,以新制定标准为主,约占总项目数的94%,其余则为标准修订项目或国际标准转化项目。按照产品标准、基础标准、方法标准、管理标准、其他标准等分类,得到图2的统计数据。可以看到190项标准中,以产品标准为主,占到项目总数的88%。11项基础标准中,还包括了对某一类产品通用要求进行规定的行业标准,在一定程度上也可归类为产品标准。而方法标准和管理标准相对较少,仅占到项目总数的4%。167项产品标准中,又以非传染性IVD行业标准为主,约占到产品标准立项数的87%。
3.2 现状分析和问题探讨
针对我国体外诊断试剂标准混乱的问题[5],行业标准的建立对产品研发、行业监管等方面的作用是显而易见的,2006年以来,虽然IVD行业标准制修订工作成绩显著,但还是有些值得关注的问题。
3.2.1 立项的选择
目前已完成的项目中,产品标准占的比重过大,基础标准、方法标准、管理标准等则较少。众所周知,体外诊断试剂品种繁多,并且随着生物技术的不断发展,新的产品也层出不穷。按照单一产品来立项制定标准,对于风险较大、监管亟需的品种未尝不可,但对一般产品而言,这种方式效率较低,难以在短时间内解决众多产品相关的技术问题,而且,也是不现实和不科学的。因此在立项的过程中,通过合理有效的整合,根据产品大类,首先考虑对每一类别制定通用技术要求,然后根据具体需要考虑制定具体产品标准,减少标准制定的盲目性,更高效的发挥标准的效用。另外,随着对量值溯源性的不断要求,参考物质、参考测量程序的研究越来越得到重视。目前,我国体外诊断行业中也缺乏这类标准,这类标准的建立一方面将便于已有的参考测量程序更好的使用,另一方面,对各类参考实验室,也应有相关的管理标准进行有效的约束[6]。此外,提高国际标准转化率,尽快转化与我国产业发展密切相关的ISO/TC212归口的国际标准或者充分利用国内已有的资源,如《中国生物制品规程》中的成熟标准进行转化,加快标准制修订进程,完善标准体系建设[7]。
3.2.2 标准制修订工作的参与度
根据《医疗器械行业标准制修订工作规范(试行)》的规定,医疗器械行业标准制修订工作应公开、透明、高效,任何单位和个人均可参与。但目前,体外诊断试剂标准制修订的主要起草单位以医疗器械检验检测机构为主,在标准的征求意见和审定过程中也纳入了相关生产企业等的意见,但其参与的广度还远远不够。一项诊断试剂产品涉及研发、生产、检定、使用等多个方面,国家食品药品监督管理总局认证的具有诊断试剂检验能力的检测机构也有几十家之多。因此,生产单位、研究机构、检验机构等各家单位均可在自己已有的技术优势的基础上,提出标准制修订的申请,或者有效整合各方面的力量联合完成标准的制定,使标准各项条款的设置更为科学合理。
3.2.3 标准物质的重要性
标准物质是具有准确量值的测量标准[8],体外诊断试剂标准物质是实现临床检验标准化的主要工具[9]。我国在19世纪80年代开始这方面的研究,但发展缓慢,目前可供使用的生物化学、血液、免疫、微生物、核酸检测相关的诊断试剂标准物质约100多种。在有标准物质可供使用的情况下,标准的制修订应优先选择这些项目,可有效保证标准关键条款的可控性,避免生产企业各自为政的状况,也有助于通过标准的推广和应用,达到对产品质量管控的目的。标准和标准物质双管齐下,在临床使用中可较好的解决检验结果的可比性问题。
3.2.4 人才建设
标准化工作是一项专业性相对较强的工作,经过多年的队伍建设,各标准化技术委员会培养了一批标准管理人才[10],但负责标准起草工作的技术人员则多为兼职人员,对标准化工作不熟悉,标准化理论水平亟待提高。因此,应重视对体外诊断试剂领域标准化专家的培养,在掌握了技术知识后,还要重点提升对标准化的理解,只有建立一支高水平的标准化人才队伍,才能更好的推进体外诊断领域标准化工作健康快速的发展。
3.2.5 制定周期和标准宣贯
目前,一项体外诊断试剂标准的制定从立项到报批大致为一年多的时间,在时间上稍显紧张。因此,建议考虑标准制修订过程合理的时间周期,在已有基础研究的前提下,分步、分阶段的稳步进行[11]。在标准立项前,鼓励相关检测机构、企业等进行项目的预研,在研究较为成熟的情况下进行项目的申报,从而在保证质量的前提下有效的缩短周期,加快进度。另外,在标准发布之后,相关机构应及时的进行标准的宣贯工作,提高标准的使用率,推进标准的实施,更好的发挥标准的作用。
3.3 未来发展
检验医学的发展迅速推动着体外诊断试剂的产业化进程,如何使之健康有序的发展,在产业发展和监管之间找到平衡点,是管理者、生产者、经营者、使用者等各方值得思考的问题,在这个过程中,应充分发挥行业标准的技术指导作用,加强体外诊断试剂标准的基础研究力度,适应产业的创新发展,对于高风险、需要重点监管的高技术产品如适用于产前筛查和产前诊断的高通量基因测序技术、高危传染性微生物领域应重点关注。同时,积极参与国际标准化活动,在合理转化国际标准的同时,也及时得发出自己的声音。最终,在有效保证标准质量和水平的前提下,加快标准制修订的进程,提高标准数量,形成具有一定覆盖面的标准体系。
4 小结
体外诊断试剂标准体系经过近十年的快速发展,取得了丰硕的成果,但尚不能满足行业快速发展的需求。随着新的《医疗器械监督管理条例》的颁布实施和相关配套法规的修订,体外诊断试剂标准制修订工作也将面临新的机遇和挑战,各方应抓住机遇,强化自身能力,建立起更加完善的标准体系,促进行业的健康发展。
[1] 国家食品药品监督管理总局. 体外诊断试剂注册管理办法[R]. 2007-04-19.
[2] GB/T 20000.1—2002 标准化工作指南 第1部分: 标准化和相关活动的通用词汇[S].
[3] 谷威, 潘峰, 周飞. 体外诊断试剂行业发展概述[J]. 中国药物评价, 2012, (29)1: 98-101.
[4] 国家食品药品监督管理局. YY/T 1000.0—2005 医疗器械行业标准的制定 第1部分: 阶段划分 代码和程序[S].
[5] 孙立魁, 施燕平. 我国体外诊断试剂质量现状分析[J]. 中国医疗器械信息, 2011, 17(3)1-3, 55.
[6] 贺学英, 廖晓曼, 刘毅, 等. 医用临床检验实验室及体外诊断系统标准体系研究[J]. 医疗装备, 2009, 22(7): 12-16.
[7] 李海宁, 母瑞红, 任海萍, 等. 体外诊断试剂监管现状分析及思考[J]. 中国医疗器械杂志, 2011, 35(1)68-70.
[8] 全国标准物质管理委员会. 标准物质定值原则和统计学原理[M]. 北京: 中国质检出版社, 2011.
[9] ISO. SO/DIS 17511 In vitro diagnostic medical devices measurement of quantities in samples of biological originmetrological traceability of values assigned to calibrators and control materials[S].
[10] 杨晓芳, 李晓亮, 母瑞红, 等. 中国医疗器械检验机构现状与发展[J]. 中国医疗器械杂志, 2014, 38(1): 57-60.
[11] 杨振, 无源医疗器械标准制修订现状和发展方向[J]. 中国药事, 2014, 28(3): 237-239.
Situation and Suggestions on IVD Industrial Standards
【Writers】Liu Yan, Sun Nan, Wang Yumei, Gao Shangxian, Zhang Chuntao, Yang Zhaopeng
National Institutes for Food and Drug Control, Key Laboratory of the Ministry of Health for Research on Quality and Standardization of Biotech Products, Beijing, 100050
This paper briefly introduces the working procedure of in vitro diagnostic products (IVD) industrial standards, and elaborates the importance of professional standards for production and supervision. Based on the analysis of working progress during the past 10 years, some problems and countermeasures on project setting, participation, standard material, personnel training, work cycle are put forward, which are helpful for the future development of the IVD.
medical device, in vitro diagnostic products, standard
R446.6
A
10.3969/j.issn.1671-7104.2014.06.017
1671-7104(2014)06-0448-03
2014-07-07
国家高技术研究发展计划(2011AA02A115)
刘艳,E-mail: liuyan2006@nifdc.org.cn
杨昭鹏,E-mail: zpyang1208@126.com

