浅析IEC 60601-1第3.1版和GB 9706.1—2007的主要差异及实施影响
郑 佳,何 骏,余新华
1 中国食品药品检定研究院医疗器械标准管理研究所,北京市,100050
2 上海市医疗器械检测所,上海市,201318
浅析IEC 60601-1第3.1版和GB 9706.1—2007的主要差异及实施影响
【作者】郑 佳1,何 骏2,余新华1
1 中国食品药品检定研究院医疗器械标准管理研究所,北京市,100050
2 上海市医疗器械检测所,上海市,201318
该文重点分析IEC 60601-1第3.1版和GB 9706.1—2007的主要差异,并探讨这些差异对医用电气设备设计、检测等环节可能产生的影响,为该标准的转化实施提前做好准备。
IEC60601-1第3.1版;GB9706.1—2007;差异对比
GB 9706.1—2007《医用电气设备 第1部分:安全通用要求》是我国医用电气设备需遵循的强制性安全通用标准之一,直接影响医用电气设备的设计、生产、检测、监管等多个环节。目前,其对应的国际标准IEC 60601-1已更新为2012版(以下简称第3.1版),新版标准引入了基本性能及风险管理的新理念,对世界各国的医疗器械监管和产业都产生了较大影响。为了平稳顺利转化该标准,我国从2010年就开始了对IEC 60601-1第3版转化实施的专题研究工作。本文将重点分析第3.1版和GB 9706.1—2007的主要差异,并探讨这些差异可能对医用电气设备设计、检测等环节产生的影响,以期使医疗器械相关生产和监管人员更全面深入地了解第3.1版的主要变化,为该标准转化后的平稳顺利实施提前做好准备。
1 IEC 60601-1的发展及在我国的转化历程
IEC 60601-1最早来源于1930年起草的德国国家标准VDE 0750,第1版于1977年正式发布,编号为IEC 601-1:1977《医用电气设备 第1部分:安全通用要求》。1988年,国际电工委员会(IEC)发布了第2版,其编号变更为IEC 60601-1:1988,并先后在1991年和1995年发布了第2版的第1号修改件和第2号修改件。此后经过10年的努力,IEC 60601-1:2005(第3版)标准于2005年正式发布,其名称变更为《医用电气设备 第1部分:基本安全和基本性能的通用要求》。由于第3版仍存在部分指标要求不合理、非量化评价操作性差等缺陷,IEC于2008年10月开始制定第3版的第1号修改件。期间,还陆续发布了一些标准勘误表和标准解释单,最终于2012年7月13日正式发布第3版标准的第1号修改件(A1),并在2012年8月20日,融合第3版、第1号修改件、3份标准勘误表和2份标准解释单,正式发布了IEC60601-1:2012 第3.1版(简称第3.1版)。2014年7月,IEC再次发布一份勘误表。由于各个国家及地区转化实施的计划不同,从现在到今后的几年内,将出现IEC 60601-1的几个版本在世界范围内同时适用的现象。据了解,为了避免多个版本造成的误导或干扰,IEC已建议尽量在2019年前不再修订第3.1版。
1995年,等同采用IEC 60601-1:1988及第1号修改件,发布第二版GB 9706.1。2007年,等同采用IEC 60601-1:1998标准及第1号和第2号修改件,修订第二版GB 9706.1标准为现行有效版本GB 9706.1-1:2007。目前,该标准是我国医用电气设备必须要遵守的强制性技术规范,对保障医用电气设备的安全性至关重要。2012年,为了更好地和国际标准保持一致,原国家食品药品监督管理局制定了IEC 60601-1第3版转化实施方案并提出了明确的转化时间表,以保障该标准的顺利转化及相关工作的有效衔接。全国医用电器标准化技术委员会现已申请GB 9706.1:2007修订立项,并将按相关程序开展第3.1版的具体转化工作。目前,该立项项目已在国家标准委网站上公开征求意见。
2 IEC 60601-1第3.1版和GB 9706.1—2007的主要差异
2.1 直观变化
第3.1版和GB 9706.1—2007无论在名称上还是结构上都发生了重大的变化。第3.1版标准的名称,将原来的“医用电气设备 第1部分安全通用要求”更新为“医用电气设备 第1部分 基本安全和必要性能的通用要求”。从结构上看,GB 9706.1—2007标准内容分为10篇,内含59章,而第3.1版不分“篇”,只分为17章,并将GB 9706.15《医用电气设备 第1-1部分:安全通用要求 并列标准:医用电气系统安全要求》(对应IEC 60601-1-1)和YY/T 0708《医用电气设备 第1-4部分:安全通用要求 并列标准:可编程医用电气系统》(对应IEC 60601-1-4)的内容合并为标准的第14章和第16章。第3.1版标准整体篇幅较GB 9706.1—2007也大幅增加。
2.2 核心变化
相比GB 9706.1—2007,第3.1版标准最大的革新是安全理念的变化。第3.1版扩大了安全的范围和概念,引入了风险管理的流程,并要求企业在产品的整个生命周期内进行风险控制,风险控制的范围扩大到基本安全和基本性能。“基本安全”和“基本性能”概念的提出赋予了企业一定的自由度选择产品的实现方式。在第3.1版标准中,“Risk(风险)”一词出现500余次,“Hazard(危险)”相关词汇出现160余次,“Risk Management(风险管理)” 出现近200次。正是第3.1版安全理念的巨大变化,对世界各国和地区转化及实施该标准都形成了巨大挑战,这也是该标准首次发布7年后才逐步被欧美等地区采用的重要原因。
2.3 具体条款变化
参照IEC/TR 62348-2006《IEC 60601-1第3版和修订的1988版条款对照图》的格式,将第3.1版的条款细化到列项级,共829个条款,包括137个属标题型条款。在剩下的692个条款中,相比GB 9706.1—2007,第3.1版新增条款252个,有对应关系的416个,还有24个条款可在GB 9706.15和YY 0708找到对应的条款。
2.3.1 与GB 9706.1—2007有对应关系的条款
第3.1版共有440个条款和GB 9706.1等标准有对应关系,其中303个条款和GB 9706.1、YY 0708、GB 9706.15基本一致,11个条款降低了要求,均是改进原来不合理的要求和试验方法,比如根据患者与应用部分接触时间的长短而给出不同的温度限值、工作电压的限制参考了GB 4943.1等。相比于GB 9706.1等标准,第3.1版提高的条款共114条,主要集中在对结构和系统、超温等危险的防护等增加了风险分析的要求,还有约半数的条款是对术语、通用要求以及标识标签及说明书的修改。
2.3.2 新增条款
新增条款主要是分布在术语(第3章)、对电击(第8章)、机械(第9、15章)、超温的防护要求等,见图1。
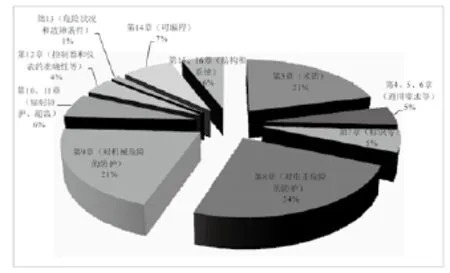
图1 新增条款在第3.1版各章节的分布图Fig.1 The chapter distribution of new clauses in Ed. 3.1
具体而言,第3.1版共增加术语53个,包括新定义了“基本性能”、“预期使用寿命”、“对操作者及患者的防护措施”等术语,以及引进其他标准已定义的术语,比如YY 0316《医疗器械 风险管理对医疗器械的应用》(对应ISO 14971)的“风险分析”、“风险控制”等,YY 0708的“可编程医用电气系统”等,GB 9706.15的“医用电气系统(ME系统)”、“患者环境”等,GB 4943《信息技术设备的安全 第1部分:通用要求》(对应IEC 60950)的“峰值工作电压”、“工作电压”等,IEC 60601-1-6《医用电气设备 第1-6部分:安全通用要求 并列标准:可用性》的“可用性”等。
第3.1版在第9章和15章中大幅增加了机械防护的要求,其中第9章的主要变化包括:参考ISO 13857(对应GB 23821)对俘获区域防护提出了具体要求;增加了对过冲终端限位装置的要求;增加了水平外力和垂直外力导致不稳定性的试验;对于移动式设备的脚轮或轮子,增加了推动力、越过门槛不失衡以及制动系统的要求;对于支撑或悬挂系统,制定了不同情况下应采用的拉伸安全系数值。关于机械强度的要求还出现在第15章,比如增加了粗鲁搬运试验包括上台阶冲击、下台阶冲击和门框冲击试验;增加了热塑性材料外壳的模压应力消除试验等。此外,第3.1版还增加了对标识标签及说明书、对所用材料可燃性等要求。
值得注意的是,GB 9706.1—2007对患者和设备操作者电击防护同等要求,而第3.1版第8章区别对待“对患者的防护措施(MOPP)”和“对操作者的防护措施(MOOP)”。对患者的防护措施,第3.1版中的“一重患者防护措施”和“两重防护患者防护措施”基本等同于GB 9706.1中的“基本绝缘”和“双重/加强绝缘”。也就是说,符合GB 9706.1要求的绝缘设计通常可符合第3.1版要求。而第3.1版“对操作者的防护措施”参考了IEC 60950:1999的绝缘理念,在某种程度上放宽了要求,可允许使用信息技术设备的系统部件比如电源、变压器、个人电脑等,这种变化将显著减少产品成本。
3 IEC 60601-1第3.1版风险分析的要求程度
第3.1版最革命性的变化就是引入了风险分析,也是对世界各国和地区医疗器械生产企业、检测及监管部门实施标准最大的挑战。在IEC 60601-1:2005版中,约有11%的条款需要由风险分析判断符合性,而第3.1版已减少了单纯依靠风险管理来判断符合性的条款比例,下降到只有约9%。也就是说,大部分条款仍需要进行指标检测或提供可量化的客观证据来验证符合性。风险管理要求程度的削弱将有助于增加标准执行的可操作性,统一执行尺度。
在第3.1版中,除去标题、术语、分类等条款,要求型条款共509个,风险分析的要求程度见图2。在仅需要风险分析的条款中,有近40%的条款集中在第4章“可编程的医用电气系统”,相关内容已在YY/T 0708有所涵盖并已开始实施。
4 IEC 60601-1第3.1版主要变化项目对医疗器械检测和生产的影响
通过对比分析两版标准,可能会对全部医用电气设备有影响的条款仅8条,比如电磁兼容性、材料相容性等;相当一部分条款仅是影响小范围产品,比如9.2.4仅是针对具有急停装置的产品,9.6.2.2仅是针对产生次声或超声能的设备。由于第3.1版较第2版新增或提高了部分要求,检测设备也应配套更新,比如需增加机械、超温防护等设备。风险分析仍是产品整改的主要方面。目前大部分产品都存在风险管理文件不完整、不完善等问题,且风险管理文档的整改普遍存在耗时多、整改难度大等问题。除风险分析外,涉及整改的条款还将集中在电气防护、机械防护、标识标签、材料相容性及控制器和仪表的准确性等条款。
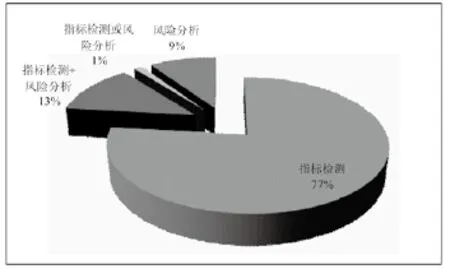
图2 第3.1版要求型条款风险分析的要求程度Fig.2 The level of requirement clauses in Ed. 3.1
5 小结
综上所述,在技术要求上,第3.1版确实改进了第2版中一些不合理的内容,要求更细致、更具针对性、更具操作性、与相关的电气标准一致性更好,较符合医疗器械产业和基础工业的发展趋势,可更好地保障产品的安全性,具有先进性和科学性。在安全理念上,风险分析的引入,赋予了企业一定的自由度选择产品的实现方式,允许企业采用更新的技术、更多的实现方式,这将有利于促进新技术的发展和利用,但也对各国医疗器械生产企业、检测及监管部门提出了新的挑战。全面而深入地了解第3.1版的主要变化并提前做好充足的准备,将有助于保障该标准的顺利、平稳转化及实施,从而促进医疗器械产业的健康、快速发展。
[1] IEC60601-1 Medical electrical equipment - Part 1: General requirements for safety[S]. Ed 2.0, 1988.
[2] IEC60601-1 Medical electrical equipment - Part 1: General requirements for basic safety and essential performance[S]. Ed 3.0, 2005.
[3] IEC60601-1 Medical electrical equipment - Part 1: General requirements for basic safety and essential performance[S]. Ed 3.1, 2012.
Analysis on the Main Difference and Impact Between IEC 60601-1 in Ed. 3.1 and GB 9706.1—2007
【Writers】Zheng Jia1, He Jun2, Yu Xinhua1
1 Institute for Medical Device Standardization Administration, National Institutes for Food and Drug Control, Beijing, 100050
2 Shanghai Testing & Inspection Institute for Medical Devices, Shanghai, 201318
For the preparation of implementing IEC 60601-1 Ed. 3.1 in advance, this paper analyzes the main difference between IEC 60601-1 Ed. 3.1 and GB 9706.1—2007, and discusses the possible infuence to medical device designing and testing.
IEC 60601-1 Ed. 3.1, GB 9706.1—2007, difference
F203
A
10.3969/j.issn.1671-7104.2014.06.015
1671-7104(2014)06-0442-03
2014-08-12
余新华,E-mail: yuxinhua@nicpbp.org.cn

