黄瓜幼苗耐低温性机理的分析
阎世江,张建军,张继宁,刘 洁
(1 山西省农业科学院蔬菜研究所,山西 太原,030031;2 鞍山市园艺科学研究所;3 山西省农业科学院农业科技信息研究所)
黄瓜(CucumissativusL)又称胡瓜、王瓜,起源于喜马拉雅山南麓的热带雨林地区,属葫芦科1年生草本蔓生攀缘植物,喜温,对低温的反应很敏感[1],随着人民生活水平的提高,冬春季对黄瓜的需求越来越高,在这段时间里进行栽培,低温成为最主要的限制因素。相对于番茄、辣椒等蔬菜而言,有关黄瓜耐低温性的研究起步较晚,目前,对于耐低温的机理已有研究,仅限于生长发育[2]、SOD活性、POD活性[3,4]、物质代谢[5]等层面,笔者认为上述的研究仅从某一方面入手,较为片面。本研究利用几份不同遗传来源耐低温性不同的黄瓜高代自交系,给予其低温处理,研究耐低温性、株高、茎粗、APX活性、脯氨酸含量、NR活性、Ca2+-ATP活性等指标的变化规律,试图从生长指标、生理指标等方面多角度综合阐述黄瓜耐低温性的机理,以期为黄瓜抗逆育种奠定理论基础。
1 材料与方法
1.1 供试材料
选取9504,9506,9507,9511,9514,9517等耐低温性不同的6份材料,上述材料均来源于华北型密刺类黄瓜。
1.2 方法
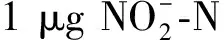
耐低温性分级标准如下:0级,全株受冻死亡或接近死亡;1级,秧苗各叶片普遍受冻,其中3~4叶受冻面积大于50%;2级,秧苗3~5叶受冻,其中2~3叶受冻面积大于50%;3级,秧苗2~4叶受冻,其中1~2叶受冻面积大于50%;4级,秧苗1~2叶受冻,受冻面积20%~30%;5级,秧苗生长正常,无任何受冻症状。
数据分析采用DPS软件,Excel统计并制图。
2 结果与分析
2.1 幼苗的耐低温性
9504和9507的耐低温性最高,达4.000以上,9511和9514的耐低温性居中,在4.000左右,9506和9517的耐低温性最低,在2.100以下(图1)。
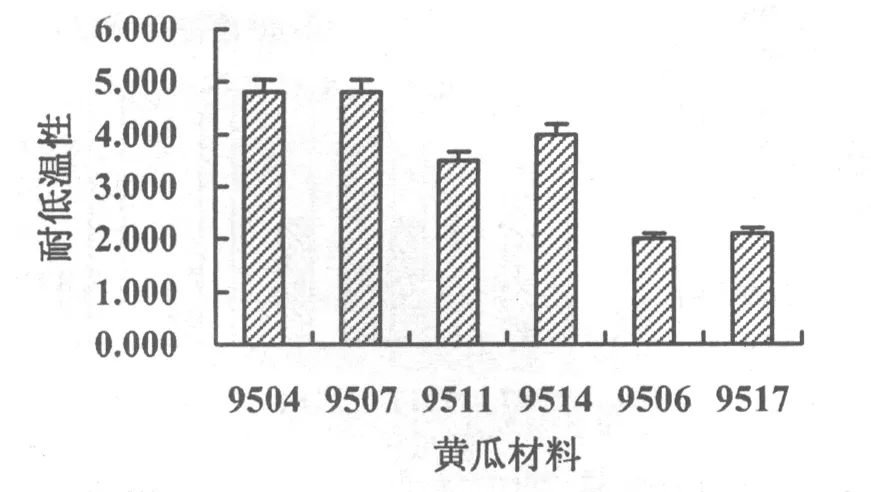
图1 各黄瓜材料幼苗的耐低温性
2.2 生长指标
在常温下各材料的株高、茎粗差异不显著,株高达12.100~12.600 cm(图2),茎粗为4.110~4.240 mm(图3)。经低温处理,各材料均呈下降的态势,9504和9507保持在较高的水平,株高在12.500 cm,茎粗在3.687 mm以上,9506和9517在较低的水平,株高在7.000 cm以下,茎粗在1.900 mm以下,9511和9514的株高茎粗保持在中等水平。

图2 低温下各材料幼苗株高的变化 图3 低温下各材料幼苗茎粗的变化
2.3 生理指标
在常温下各材料的APX活性的差异不显著,在0.802~0.912 U之间,低温处理后差异达显著水平,9504及9507的含量较高,达2.204,2.104 U;9506和9517分别达1.303,1.403 U;其余材料的活性居中(图4)。
在常温下各材料的脯氨酸含量在248.774~256.820 μg·g-1之间,差异较小,未达显著水平(图5)。经低温处理后,所有材料的脯氨酸含量均比对照有所增加,9504和9507的含量最高,为451.372,452.819 μg·g-1;9511和9514在处理后的含量居中,为358.116,359.288 μg·g-1;而耐低温性较弱的9506和9517等2份材料处理后的脯氨酸含量最低,分别为308.716,306.241 μg·g-1。

图4 低温下各材料APX活性的变化 图5 低温下各材料幼苗脯氨酸含量的变化
在常温下,各材料的NR活性在1.002~1.102 U之间,未达显著水平(图6)。经过低温处理,NR活性下降,9504和9507的NR活性达0.752,0.741 U;9511和9514分别达0.501,0.511 U;9506和9517较低,分别达0.311和0.301 U。
在常温下,各材料的Ca2+-ATP活性未达显著水平(图7);在低温下,9504和9507的Ca2+-ATP活性较高,分别为21.172,22.829 U;9506和9517较低,分别达12.776,13.245 U;9511和9514的活性居中。

图6 低温下各材料NR活性的变化 图7 低温下各材料幼苗Ca2+-ATP活性的变化
2.4 幼苗耐低温性与各性状的相关分析
由于各指标在常温下的差异未达显著水平,因此运用在低温处理后的数据计算与黄瓜幼苗耐低温性的相关系数可以发现,各材料的耐低温性与株高、脯氨酸含量呈显著正相关,与APX活性、Ca2+-ATP活性呈正相关,与NR活性呈负相关,未达显著水平;而耐低温性与茎粗的相关系数很小,分别为0.080,关系较小(表1)。

表1 耐低温性与各性状的相关系数
注:*表示相关系数达到0.05显著性。
3 讨 论
株高、茎粗是常见的农艺性状,其变化是植物对外界胁迫的综合反应,也是评估胁迫程度和植物抗逆能力的可靠标准。大量研究表明,低温胁迫条件下,植物生长受到抑制,株高、茎粗呈下降的趋势,胁迫程度越高,下降现象越明显[9,10],这与笔者的结论相同,这是因为在低温下黄瓜的生长、物质积累放缓造成的。但耐低温较强的材料仍维持其缓慢生长,保持一定的生物量增加,具有相对较高的生长量,表现出低温下株高、茎粗较高,这与育种家的设想一致。
APX是植物体内重要的抗氧化酶,主要功能是分解H2O2。已有试验报道,在一定范围内,逆境条件能够诱导APX活性的提高[11~13]。本试验结果表明,黄瓜在受到低温胁迫后,APX活性明显上升,上升程度与耐低温型密切相关,在逆境条件下,植物体内活性氧自由基超量积累和抗氧化系统清除自由基能力下降是导致植物细胞伤害的主要原因。APX是植物体重要的抗氧化酶类,能够通过催化抗坏血酸的氧化还原代谢,清除多种活性氧自由基。
植物在低温逆境条件下,都可以引起脯氨酸含量的明显增加[6]。关于脯氨酸与低温逆境的报道国内外很多,就目前研究情况来看,大多都认为在低温胁迫下,植物体内的脯氨酸量会增加,且耐低温性强的材料的增加幅度大于耐低温弱的[14,15]。本试验的结论与之相同。在低温逆境中脯氨酸累积主要存在3个方面的原因:脯氨酸合成加强,脯氨酸氧化作用受抑,蛋白质合成减弱。何若韫[16]认为脯氨酸的积累,不仅维持细胞的膨压,而且使细胞具有很高的水势,能为代谢的正常进行提供足够的自由水。同时脯氨酸具有极性,对生物体的多聚体的空间结构有保护作用,改善细胞膜和其它高分子物的水环境,增加了结构的稳定性。游离脯氨酸还能促进蛋白质水合作用,由于亲水、疏水表面的相互作用对水分有效渗透调节,提高抵御低温的能力。
有关Ca2+-ATP与低温关系的研究已有报道,多认为低温下Ca2+-ATP活性上升,与耐低温性呈正相关[19],本研究结论与之类似。其原因是在低温环境下不耐低温的植物细胞的质膜和核膜中Ca2+-ATP酶失活,胞质内和核内Ca2+的增加不能被泵回胞外或钙库,细胞死亡,而耐低温植物在低温处理时Ca2+-ATP酶活性升高,胞质内和核内Ca的增加能及时被泵回胞外或钙库中,所以细胞的存活率高。笔者推测在低温条件下,较高的Ca2+-ATP酶活性,将有利于维持胞内Ca2+稳态平衡,这可能是耐冷型品种耐低温性较强的生理学基础之一。
综上所述,在低温下黄瓜的生长受到抑制株高、茎粗下降,APX活性、脯氨酸含量、Ca2+-ATP上升,NR活性下降,耐低温性与株高、脯氨酸含量呈显著正相关;与其余性状的相关未达显著水平,耐低温性与茎粗的关系不密切。说明黄瓜幼苗耐低温的实质是低温下黄瓜的生长受到一定程度的抑制,但能够通过调节自身的生理指标来减轻低温的伤害,维持植物体的正常生长及生理代谢功能,从而表现出一定的耐低温潜力。
[1] 周长久.现代蔬菜育种学[M].北京:科学技术文献出版社,1996.
[2] 闫世江,张继宁,刘洁.黄瓜耐低温机理的研究进展[J].蔬菜, 2011(1):47-50.
[3] 闫世江,司龙亭,马志国,等.黄瓜幼苗耐低温性与种子内含物质的相关分析[J].沈阳农业大学学报,2008,39(5):542-545.
[4] 王永健,姜亦巍,曹宛虹.低温对不同品种黄瓜种子萌发、过氧化物酶及同功酶的影响[J].华北农学报,1995,10(2):72-76.
[5] Saczynska V.Chilling Suscep tibility of cucum is sativus species[J].Phytochem istry,1993,33(1):61-67.
[6] 张宪政,陈凤玉,王荣富,等.植物生理学[M].沈阳:辽宁科学技术出版社,1994.
[7] 赵世杰,刘华山,董新纯.植物生理学实验指导[M].北京:中国农业科技出版社, 1998.
[8] Lin T L,Morales M F.Application of a one-step procedure for measuring inorganic phosphate in the presence of protein:The actomyosin ATPase system[J].Anal Biothem,1977(77):10-17.
[9] 陈青君,张福墁,王永健,等.黄瓜对低温弱光反应的生理特征研究[J].中国农业科学,2003,36(1):77-81.
[10] 逯明辉,宋慧,李晓明,等.冷害过程中黄瓜叶片SOD、CAT和POD活性的变化[J].西北植物学报,2005,25(8):1 570-1 573.
[11] 马春花,马锋旺,李明军,等.外源抗坏血酸对离体苹果叶片衰老的影响[J].园艺学报,2006,33(6):1 179- 1 184.
[12] Ishikawa T,Dowdle J,Smirnoff N.Progress inmanipulating ascorbic acid biosynthesis and accumulation in plants[J].Physiologia Plantarum,2006,126(3):343- 355.
[13] Shigeru S,Takahiro I,Masahiro T,et al.Regulation and function of ascorbate peroxidase isoenzymes[J].Journal of Experimental Botany, 2002,5:1 305-1 319.
[14] 高桂花,王瑞兵,刘艳芳,等.低温胁迫下玉米幼苗生理变化的研究[J].河北农业科学,2006,10(4):16-19.
[15] 陈建林,查丁石,吴雪霞.低温胁迫对茄子幼苗生理生化的影响[J].中国蔬菜,2006(11):21-23.
[16] 何若韫.植物低温逆境生理[M].北京:中国农业出版社,1995.
[17] 刘丽,甘志军,王宪泽.植物氮代谢硝酸还原酶水平调控机制的研究进展[J].西北植物学报,2004,24(7):1 355-1 361.
[18] 庞金安,沈文云,马德华.黄瓜幼苗耐低温指标研究初报[J].天津农业科学,1998,4(2):53-56.
[19] 李素丽,李志刚,杨丽涛,等.低温对不同冷敏感型甘蔗品种根系一些生理指标的影响[J].华南农业大学学报,2012,33(2):178-182.

