甘薯中清除不同自由基的活性物质提取条件的优化
张志雯,秦素平,陈于和,乔亚科,武宝悦
(河北科技师范学院生命科技学院, 河北 秦皇岛,066600)
D.Harman提出的自由基衰老学说认为,机体衰老与体内自由基增多有关,自由基能从多方面对机体造成损伤,加速机体衰老[1~3]。自由基过多或清除过慢,还会诱发各种疾病[4~6]。随着人们对生活质量的要求不断提高和绿色环保消费意识的增强,天然的清除自由基的活性物质的研究,特别是将其应用于食品、医药保健品和化妆品等行业,日益成为研究的热点[7~10]。甘薯不仅具有很高的营养价值,同时还含有多种生物活性物质,具有独特的生理保健作用和药用价值,倍受国内外研究者的关注[11~14],关于其清除自由基活性物质的研究也有不少报道,其清除自由基的活性物质有多糖、多酚等[15~17]。目前针对清除特定自由基活性物质的研究还少有报道。由于自由基种类繁多而且代谢过程非常复杂[18,19],针对不同的自由基,寻找特定的清除剂有利于提高自由基的清除率。
笔者分别针对清除羟自由基和超氧阴离子自由基的两类不同的活性物质,探讨了溶剂、提取温度、提取时间和提取剂用量对其自由基清除率的影响,以获取最佳的提取工艺条件,为羟自由基清除剂和超氧阴离子自由基清除剂的开发利用以及更好地利用甘薯中的活性物质提供一定的理论依据。
1 材料与方法
1.1 材料
卢选1号甘薯,为本课题组引种保存。
1.2 方法
1.2.1甘薯中清除自由基活性成分的提取 甘薯→洗净→去皮→切片→烘干至恒质量→粉碎→过筛(国家标准筛,筛孔尺寸0.5 mm,)得到甘薯粉,分别称取0.2 g甘薯粉放入试管,加入不同的提取溶剂进行提取,提取上清液进行相关指标的测定。
1.2.2羟自由基清除率的测定 参照洪宗国等[20]的方法,略有改动。在试管中依次加入6 mmol/L FeSO4溶液2 mL,不同的提取液2 mL,6 mmol/L H2O2溶液2 mL,摇匀,静置10 min;再加入6 mmol/L水杨酸溶液2 mL,摇匀,静置30 min后,于波长510 nm处测定其吸光度值A。清除率计算公式如下:
清除率=[(A空白-A样品+A校正)/A空白]×100%
式中:A空白为空白对照液的吸光度值,A样品为加入样品提取液后的吸光度值,A校正为不加显色剂H2O2样品提取液本底的吸光度值。
1.2.3超氧阴离子自由基清除率的测定 参照洪宗国等[20]的方法,略有改动。取50 mmol/L pH 8.0的Tris-HCl缓冲溶液4.5 mL和不同的提取液0.1 mL,置于25 ℃水浴中预热20 min。加入25 ℃水浴中预热的2.5 mmol/L的邻苯三酚0.4 mL,混匀后置于25 ℃水浴中反应5 min,立即加入8.0 mol/L的HCl 0.1 mL终止反应。用去离子水调节仪器的零点,于320 nm处测定吸光度值。空白组以0.1 mL去离子水代替样品。清除率计算公式如下:
清除率=[(A空白-A样品+A校正)/A空白]×100%
式中:A空白为空白对照液的吸光度值,A样品为加入样品提取液后的吸光度值,A校正为不加显色剂H2O2样品提取液本底的吸光度值。
1.2.4数据的统计与分析 数据用DPS(v7.05版)软件进行分析。
2 结果与分析
2.1 清除羟自由基的活性物质提取条件的优化
2.1.1提取溶剂的确定 分别以体积分数为0(水),0.20,0.40,0.60,0.80,1.00(无水乙醇)的乙醇作为提取溶剂,在提取温度为40 ℃,提取剂用量30 mL/g条件下,提取时间3 h。结果表明:随着提取溶剂中乙醇体积分数的不断升高,提取液对羟自由基的清除率呈逐渐下降趋势(图1);当以水作为提取溶剂时,提取液对羟自由基的清除率最高。所以,清除羟自由基活性物质的提取采用水作提取溶剂为最佳。
2.1.2温度对清除率的影响 以水为提取溶剂,提取剂用量30 mL/g,分别在20,40,60,80,100 ℃条件下提取3 h。结果表明:当提取温度低于40 ℃时,提取液对羟自由基的清除率随温度升高而升高(图2);40 ℃时清除率最高;当提取温度高于40 ℃后,随着温度的升高,提取液对羟自由基的清除率呈逐渐下降趋势。所以,应将提取温度控制在大约40 ℃较为合适。

图1 溶剂对羟自由基清除率的影响 图2 温度对羟自由基清除率的影响
2.1.3提取时间对清除率的影响 以水为提取溶剂,提取温度为40 ℃,提取剂用量为30 mL/g的条件下分别提取1,2,3,4,5 h。结果表明:浸提时间在3 h内,随提取时间的延长,提取液对羟自由基的清除率逐渐升高(图3);而当提取时间超过3 h后,提取液对羟自由基的清除率随时间延长而逐渐下降。因此,提取时间应控制在大约3 h。
2.1.4提取剂用量对清除率的影响 以水为提取溶剂,提取温度为40 ℃,提取时间为3 h的条件下,分别以提取剂用量10,20,30,40,50 mL/g进行提取。从图4可知,结果表明:在提取剂用量10~40 mL/g范围内,提取液对羟自由基的清除率随用量增大而增大(图4);提取剂用量高于50 mL/g后,提取液对羟自由基的清除率有所下降。因此,提取剂用量应控制在大约40 mL/g。
2.1.5正交试验 根据以上单因素试验结果,清除羟自由基活性物质提取的最佳溶剂为水,较佳提取温度为40 ℃,较佳提取时间为3 h,较佳提取剂用量为40 mL/g,在此基础上设计并进行正交试验。结果表明:清除羟自由基活性物质的最佳提取温度为45 ℃,最佳提取时间2.5 h,最佳提取剂用量为45 mL/g(表1)。根据极差的大小,可以得到各因素对清除羟基自由基能力的影响次序由大到小依次为:提取温度、提取时间、提取剂用量。由表2方差分析可知,提取温度、提取剂用量和提取时间对羟自由基清除率的影响均极显著。

图3 提取时间对羟自由基清除率的影响 图4 提取剂用量对羟自由基清除率的影响

表1 甘薯中清除羟自由基活性物质提取条件的正交试验结果及直观分析

表2 甘薯中清除羟自由基活性物质提取条件的正交试验方差分析
注:F0.05(2,16)=3.63,F0.01(2,16)=6.23,下同。
在试验范围内,得到的优化工艺组合为:以水为提取溶剂,提取剂用量45 mL/g,提取温度45 ℃,提取时间2.5 h,此组合不在正交试验中,将其编号为组合10。对其进行试验验证,将验证结果与正交试验结果进行比较,结果表明:用组合7,组合9,组合10等3种条件进行活性物质的提取,羟自由基清除率最高,极显著高于其他组合,且三者差异不显著(表3)。综合考虑提取效率,节省时间,清除羟自由基活性物质的最佳提取工艺为:以水作为提取溶剂,提取剂用量45 mL/g,提取温度45 ℃,提取时间2.5 h。
2.2 清除超氧阴离子自由基活性物质提取条件的优化
2.2.1提取溶剂的确定 分别以体积分数为0(水),0.20,0.40,0.60,0.80,1.00(无水乙醇)的乙醇作为提取溶剂,在提取温度为40 ℃,提取剂用量30 mL/g的条件下,提取3 h。结果表明:随着提取溶剂中乙醇体积分数的不断升高,提取液对超氧阴离子自由基的清除率呈逐渐上升趋势,当以无水乙醇作为提取溶剂时,提取液对超氧阴离子自由基的清除率达到最高(图5)。所以,清除超氧阴离子自由基活性物质的提取采用无水乙醇作提取溶剂为最佳。

表3 甘薯中清除羟自由基活性物质提取条件的正交试验与验证试验结果比较
2.2.2提取温度对超氧阴离子自由基活性物质清除率的影响 以无水乙醇为溶剂,提取剂用量30 mL/g,分别在20,40,60,80,100 ℃条件下提取3 h。结果表明:当提取温度低于40 ℃时,提取液对超氧阴离子自由基的清除率随温度升高而升高(图6);提取温度为40 ℃时清除率最高;当提取温度高于40 ℃后,随着提取温度的升高,提取液对超氧阴离子自由基的清除率呈逐渐下降趋势。所以,应将提取温度控制在大约40 ℃较为合适。

图5 溶剂对超氧阴离子自由基清除率的影响 图6 温度对超氧阴离子自由基清除率的影响
2.2.3提取时间对超氧阴离子自由基活性物质清除率的影响 在无水乙醇为提取溶剂,温度为40 ℃,提取剂用量为30 mL/g的条件下分别提取1,2,3,4,5 h。结果表明:浸提时间在3 h内,随提取时间的延长,提取液对超氧阴离子自由基的清除率逐渐升高(图7);而当提取时间超过3 h后,提取液对超氧阴离子自由基的清除率随时间延长而逐渐下降。因此,提取时间应控制在大约3 h。
2.2.4提取剂用量对超氧阴离子自由基活性物质清除率的影响 在无水乙醇为提取溶剂,提取温度为40 ℃,提取时间为3 h的条件下,分别以提取剂用量10,20,30,40,50 mL/g进行提取。结果表明:提取剂用量在10~30 mL/g范围内,提取液对超氧阴离子自由基的清除率随提取剂用量增大而增大(图8);提取剂用量高于30 mL/g后,提取液对超氧阴离子自由基的清除率有所下降。因此,提取剂用量应控制在大约30 mL/g。
2.2.5正交试验 根据以上单因素试验结果,清除超氧阴离子自由基活性物质提取的最佳提取溶剂为无水乙醇,较佳提取温度为40 ℃,提取时间为3.0 h,提取剂用量为30 mL/g,在此基础上设计并进行正交试验。结果表明:清除超氧阴离子自由基活性物质的最佳提取温度为45 ℃,最佳提取时间3.0 h,最佳提取剂用量为35 mL/g(表4)。由极差的大小,可以得到各因素对超氧阴离子基自由基清除能力的影响次序由大到小依次为:提取温度,提取剂用量,提取时间。由表5方差分析可知,提取温度、提取剂用量和提取时间对羟自由基清除率的影响均极显著。
在试验范围内,得到的优化工艺组合为:以无水乙醇为提取溶剂,提取剂用量35 mL/g,提取温度45 ℃,提取时间3.0 h,这与表4中的组合9一致。将正交试验结果进行多重比较,结果表明,用组合9进行活性物质的提取,所得提取液对超氧阴离子自由基的清除率最高,显著高于其他组合(p<0.05)。所以,清除超氧阴离子自由基活性物质的最佳提取工艺为:以无水乙醇作为提取溶剂,提取剂用量35 mL/g,提取温度45 ℃,提取时间3.0 h。
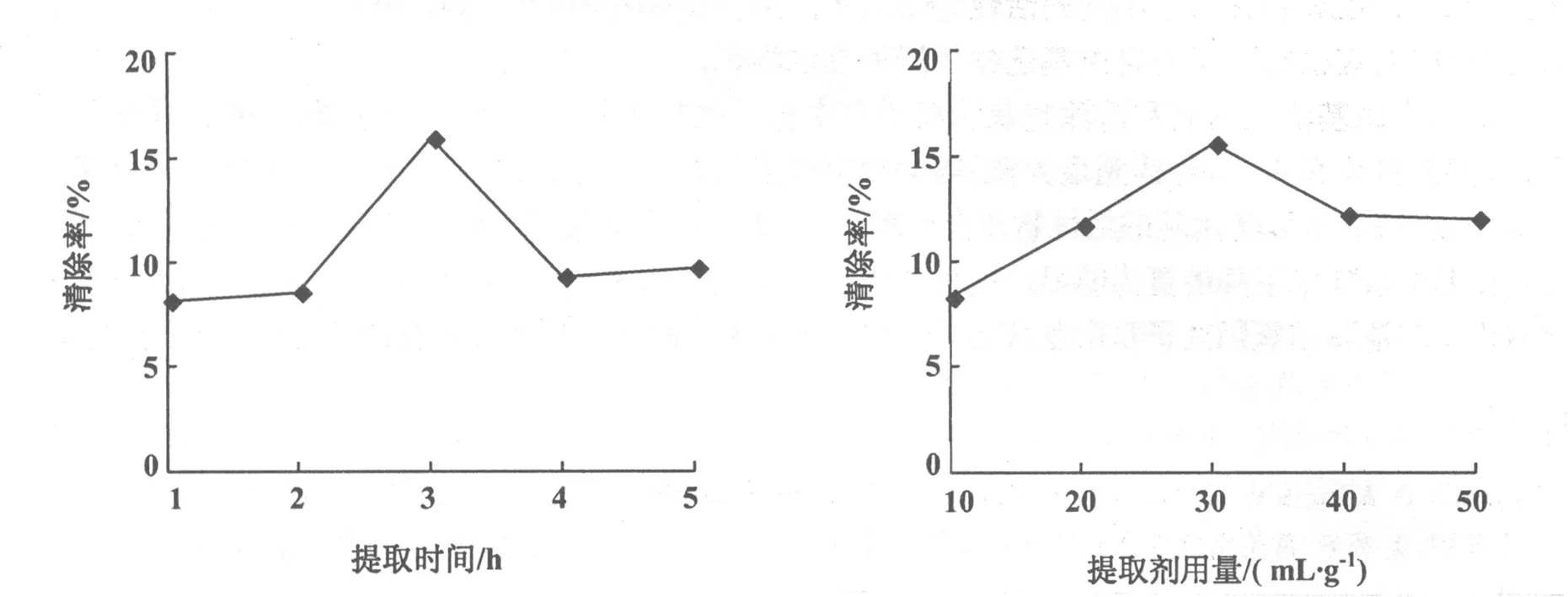
图7 提取时间对超氧阴离子自由基清除率的影响 图8 提取剂用量对超氧阴离子自由基清除率的影响

表4 甘薯中清除超氧阴离子自由基活性物质正交试验结果及直观分析

表5 甘薯中清除超氧阴离子自由基活性物质正交试验方差分析
3 结论与讨论
本次研究结果表明,甘薯中清除羟自由基活性物质的最佳提取工艺为:以水作为提取溶剂,提取剂用量35 mL/g,提取温度45 ℃,提取时间2.5 h;甘薯中清除超氧阴离子自由基的活性物质的最佳提取工艺为:以无水乙醇为提取溶剂,提取剂用量35 mL/g,提取温度45 ℃,提取时间3.0 h。清除不同自由基活性物质的最佳提取条件存在差异。
黄洪光[21]的研究结果表明,甘薯中的酚酸具有抗氧化活性;李利华等[16]的研究结果表明,甘薯多糖具有抗氧化活性。本次研究从不同的角度,即从清除不同自由基能力的角度研究甘薯活性物质的最佳提取工艺。结果表明,甘薯中的活性物质具有清除羟自由基和超氧阴离子自由基的能力,前者的最佳提取溶剂是水,而后者的最佳提取溶剂是无水乙醇。这可能是因为两类活性物质主要成分及性质存在差异造成的,这也说明甘薯中不同的活性物质对不同的自由基有不同的清除效果。所以,在利用甘薯的抗氧化活性时,应根据不同的自由基选择不同的提取溶剂。
清除羟自由基活性物质和清除超氧阴离子自由基活性物质的提取率,均随提取温度的升高呈先升后降的趋势,且均在40 ℃时达到最大值;随着提取温度的进一步升高,清除率均逐渐下降。这可能是由于随着温度升高,清除自由基的活性物质会出现降解,从而影响清除率。但二者的下降幅度不同,超氧阴离子自由基的清除率下降的更为明显。这也说明了两类活性物质主要成分及性质的不同。关于甘薯中清除羟自由基和清除超氧阴离子自由基两类活性物质的主要活性成分及其含量有待于进一步研究分析。
[1] Harman D.Aging:a theory based on free radical and radiation chemistry[J].J Ceron,1956(11):298.
[2] 段亚丽,谢梅冬.黄芪化学成分及其有效成分黄芪甲苷含量测定的研究现状[J].中国兽药杂志,2005,39(3):35-38.
[3] 吴建新,蒋莹,严永清.黄芪、当归及其配伍对大鼠血小板聚集和血小板中cAMP、cGMP的影响[J].中药药理与临床,1992,8(1):16-17,22.
[4] 顾有方,陈会良,刘德义,等.自由基的生理和病理作用[J].动物医学进展,2005,26(1):94-97.
[5] 邱秀芹.自由基与抗氧化及对人体健康的再评价[J].实用医技杂志,2007,14(32):4 498-4 500.
[6] 潘英明,粱英, 王恒山,等.槐花米中清除自由基活性成分的提取及其性能研究[J].现代化工,2006,26(增刊):188-190.
[7] 王忠合,林泳生.罗勒叶黄酮的提取及其清除自由基作用[J].农产品加工·学刊,2009(3):57-61.
[8] 潘英明,张晓璞,朱金婵,等.虎杖中抗氧化成分的提取分离及其活性研究[J].精细化工,2005,22(11):835-837,841.
[9] Scartezzini P,Speroni E.Review on some plants of Indian traditional medicine with antioxidant activity[J].Journal of Ethnopharmacology,2000,71:23-43.
[10] Malaya Gupta,Upal Kanti Mazumdar,Periyasamy Gomathi,et al.Antioxidant and Free Radical Scavenging Activities of Ervatamia coronaria Stapf. Leaves[J].Iranian Journal of Pharmaceutical Research,2004(2):119-126.
[11] 杜方岭,王文亮,王守经.甘薯的营养价值及其开发利用研究[J].中国食品与营养,2008(9):27-28.
[12] 王金亭.甘薯多糖的生物活性及其作用机制研究进展[J].食品研究与开发,2008,29(7):183-185.
[13] 张宽超,李冬磊,陈曼曼,等.甘薯渣多酚粗提液的抗氧化活性研究[J].食品工业科技,2011,32(3):163-165.
[14] Kusano S,Abe H,Tamura H.Isolation of antidiabetic component s from white-skinned sweet potato (IpomoeabatatasL.)[J].Bioscience Biotechnology and Biochemistry,2001,65(1):109-114.
[15] 王梅,丁祥,何素兰,等.甘薯不同品种叶片中抗氧化相关活性成分的动态变化研究[J].西华师范大学学报:自然科学版,2012,33(4):330-337.
[16] 李利华.甘薯多糖超声辅助提取及其抗氧化活性的研究[J].食品工业科技,2012,33(18):257-260.
[17] 刘栋,钱建亚,翁利珍.甘薯水溶性紫色素清除DPPH自由基活性研究[J].食品科技,2003(12):50-52,60.
[18] 叶红英,俞茂华,游利,等.黄芪多糖对STZ糖尿病大鼠物质代谢和心功能的影响[J].上海医科大学学报,2000,27(5):357-358.
[19] 李先荣,董彦敏,程林忠,等.黄芪多糖冲剂治疗II型糖尿病的临床研究[J].山西中医,1995,11(1):16-17.
[20] 洪宗国,易筠,王东.蕲艾总鞣酸对羟自由基和超氧阴离子自由基的清除作用[J].中南民族大学学报:自然科学版),2010,29(4):50-53.
[21] 黄洪光.甘薯抗氧化物质的分离提取及其生物活性的研究[D].大连:辽宁师范大学,2004.

