环磷酰胺联合强的松建立人乳腺癌小鼠移植模型*
嵇 健 刘民锋 杨翼鹏 郭昭泽 董建宇 叶长生
环磷酰胺联合强的松建立人乳腺癌小鼠移植模型*
嵇 健 刘民锋 杨翼鹏 郭昭泽 董建宇 叶长生
目的:将人乳腺癌细胞接种于具有正常免疫功能但受抑制状态的小鼠,以期建立乳腺癌小鼠模型。方法:将40只雌性BALB/c随机平均分成4组,按环磷酰胺和强的松用量多少分为对照组、低剂量组、中剂量组、高剂量组。将人乳腺癌细胞接种于小鼠背部,观察小鼠成瘤时间、成瘤率、肿瘤的影像、病理学表现及其重要内脏器官转移情况等。结果:高剂量组成瘤率高,成瘤时间早,且内脏器官转移多,小鼠死亡率高。中剂量组成瘤率较低,成瘤时间较晚,内脏器官转移少,小鼠死亡率低。对照组和低剂量组未见成瘤和小鼠死亡。结论:本实验成功用环磷酰胺联合强的松在免疫正常的小鼠中建立人乳腺癌小鼠移植瘤模型,较好的模仿乳腺癌在免疫正常的机体里的发生、发展过程。
环磷酰胺 强的松 免疫抑制 乳腺癌 小鼠 PET/CT
乳腺癌是严重危害妇女健康的恶性肿瘤之一,在美国,已成为女性癌症的第二大死因[1]。我国乳腺癌发病率也呈逐年上升趋势,在大城市女性中居首位[2]。为了探索乳腺癌的生物学特点和新的治疗方法,国内外研究者借助乳腺癌动物模型,来对乳腺癌的发病机制、早期诊断和治疗展开研究。既往报道的人源性乳腺癌动物模型多采用裸鼠,但裸鼠费用高、生长环境要求高、寿命短。对于长期研究,裸鼠最大的缺点在于缺少对肿瘤的免疫反应。本实验则是将人乳腺癌细胞接种于具有免疫功能但受抑制状态的小鼠体内,以期建立具有正常免疫功能的乳腺癌动物模型。
1 材料与方法
1.1 材料
1.1.1 试剂 环磷酰胺(sigma)、甲基强的松龙琥珀酸钠购自比利时法玛西亚普强公司,青霉素钠注射液购自北京悦康凯悦制药有限公司,RPMI 1640培养基、胎牛血清、胰蛋白酶及PBS溶液均购自美国Gibco公司。
1.1.2 细胞株 人乳腺癌细胞株MDA-MB-231购自上海细胞生物研究所。RPMI 1640培养基含10%胎牛血清和100 U/mL的青链霉素,在5%CO2、37℃培养箱中培养,隔天换培养基,采用胰蛋白酶消化传代。
1.1.3 动物 BALB/c小鼠40只,雌性,4周龄,体质量12~15 g,购于南方医科大学动物实验中心,饲养于南方医科大学南方医院动物中心[实验动物质量合格证号44002100001315,许可证号SYXK(粤)2010-0056]。全部动物实验过程均符合动物伦理委员会相关法规。
1.2 方法
1.2.1 小鼠乳腺癌模型的建立和鉴定 1)实验分组:将40只BALB/c小鼠随机分成对照组:无免疫抑制+接种人乳腺癌细胞;低剂量组:低剂量免疫抑制+接种人乳腺癌细胞;中剂量组:中剂量免疫抑制+接种人乳腺癌细胞;高剂量组:高剂量免疫抑制+接种人乳腺癌细胞。2)小鼠免疫抑制处理:实验的第1d,低、中、高剂量组小鼠分别腹腔注射环磷酰胺150 mg/kg、200 mg/kg、250 mg/kg。第2d,低、中、高剂量组腹腔分别注射甲基强的松龙50 mg/kg、100 mg/kg、150 mg/kg,之后连续3 d,3组小鼠腹腔注射青霉素8万IU/只,预防感染。第2周再进行1次上述操作。对照组小鼠同时间予以腹腔注射等体积的生理盐水。3)小鼠乳腺癌动物模型制备和处理:人乳腺癌细胞株MDA-MB-231购自上海细胞生物研究所。取对数生长期的细胞,活细胞数>95%,使用1×PBS液清洗3次,再用1×PBS液重悬细胞,调整细胞浓度为1×108/mL,制备成细胞悬液放在4℃冰上备用。第3周于4组小鼠的背部接种细胞悬液0.2 mL/只,接连注射5 d。4)观察指标:肿瘤细胞接种后,每天观察小鼠食欲及活动度,同时观察记录小鼠成瘤时间、肿瘤形态和肿瘤溃疡出现的时间。每周测量肿瘤的长径(a)和短径(b),根据肿瘤体积公式[3]V=1/2×a×b2,计算出肿瘤的体积。第8周小鼠禁食不禁水24 h,次日用水合氯醛进行腹腔麻醉,鼠尾静脉注射18F-FDG 0.2 mci/只,注射50 min之后进行PET/CT扫描。第9周脱颈处死荷瘤鼠,完整取出肿瘤组织,记录肿瘤的质量、质地、浸润以及坏死程度。肿瘤组织和心、肺、肝、肾、脾进行常规石蜡包埋切片和HE染色,光镜观察。对于实验过程中死亡的小鼠,于死亡当天进行上一步操作。
1.3 统计学分析
2 结果
2.1 小鼠一般情况和死亡率
第4周开始,高、中剂量组与对照组比较,小鼠食欲不佳,活动度减少,但体质量无明显差异。低剂量组和对照组比较,食欲、活动度、体质量无明显差异(表1)。高剂量组分别有2只小鼠死于第7周和第8周,死亡率达40%。中剂量组有1只小鼠死于第8周,死亡率为10%。
2.2 成瘤时间、成瘤率与移植瘤性质
中剂量组和高剂量组接种成功率分别为60%(6/ 10只)和80%(8/10只),对照组和低剂量组均无小鼠成瘤。高剂量组在种植后4~6 d即可触及肿瘤,中剂量组在种植后8~10 d可触及肿瘤。两组移植瘤形态都较规整,多为圆形。高剂量组小鼠溃疡出现较早(第7周),中剂量组溃疡出现时间较晚(第8周)。中剂量组虽然成瘤时间较晚,但移植瘤的坏死较少,更适合PET/CT显像(图1)。
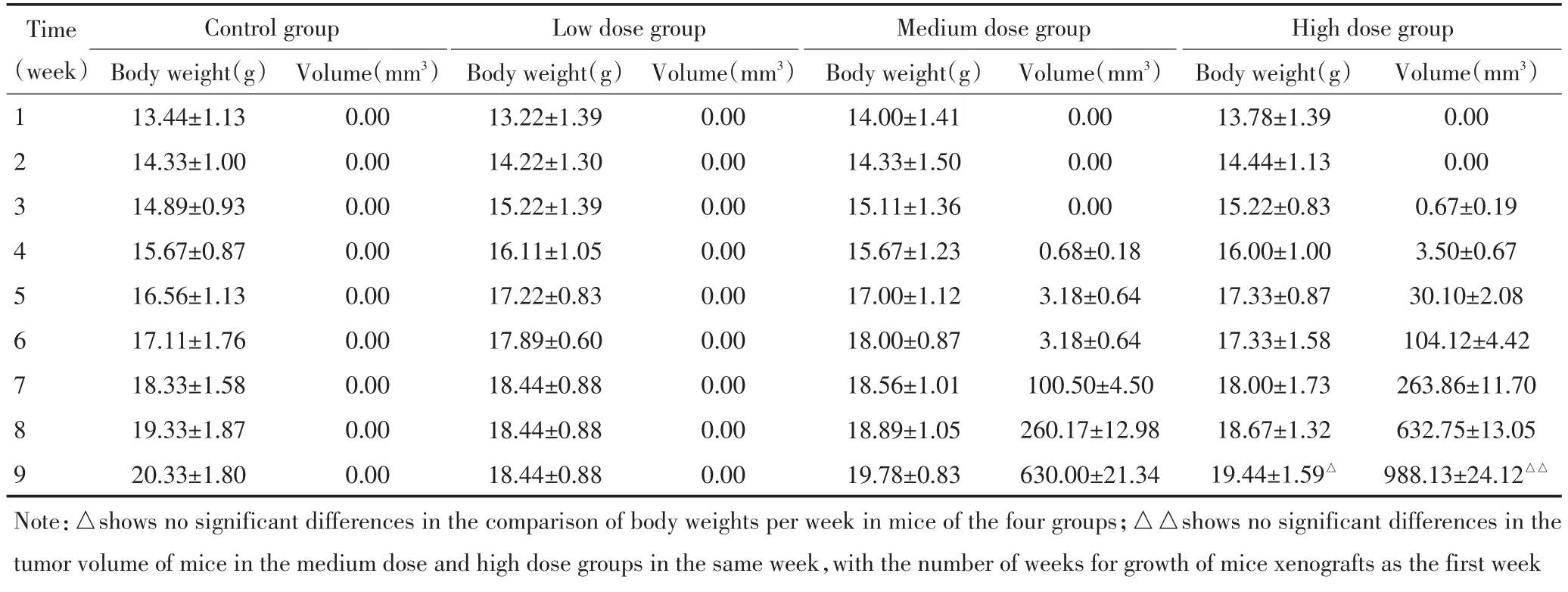
表1 不同时间小鼠体质量和移植瘤体积Table 1 Body weight and tumor volume of mice at different times
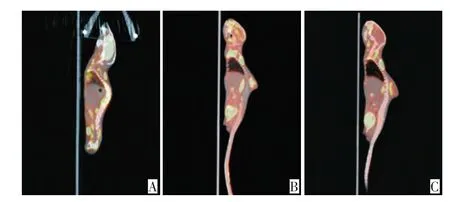
图1 中剂量组和高剂量组小鼠PET/CT显像Figure 1 Positron emission tomography-computed tomography images in the medium dose and high dose groups
2.3 移植瘤体积与生长曲线
比较高剂量组和中剂量组各时期移植瘤的体积可以看出,虽然成瘤的时间不同,但两组移植瘤的生长曲线较相似(表1、图2)。
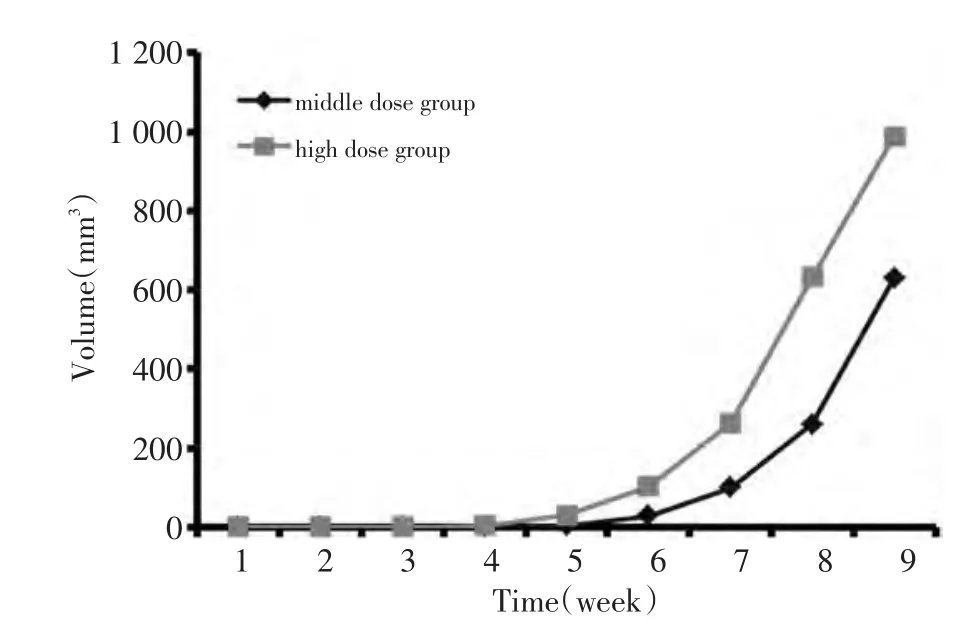
图2 移植瘤生长曲线Figure 2 Growth curves of the transplanted tumors
2.4 病理学检查
2.4.1 大体检查 取出的瘤体大致呈圆形,高剂量组种植瘤表面可见溃疡,质地较软,中央坏死多。中等剂量组瘤体较硬,中央坏死较少,表面溃疡较少见。高剂量组的8只荷瘤鼠有3只发生肺转移(共3个转移病灶),2只发生肝转移(共2个转移病灶),1只发生脾转移(共1个转移病灶)。中剂量免疫抑制组的6只荷瘤鼠有2只出现肺转移(共2个转移病灶),1只发生肝转移(共1个转移病灶),未见脾转移。两组成瘤后出现主要脏器转移的情况无显著性差异(表2)。
2.4.2 光镜检查 低剂量组和对照组未见癌组织,高剂量组和中剂量组的癌组织在光镜下可见细胞大小形态不一,核大深染,异形性明显,呈巢状、腺管状或杂乱排列,并伴有坏死(图3)。镜下观察肿瘤组织、坏死面积占切片总面积的5%~25%,记1分;坏死面积占切片总面积的26%~50%,记2分。高剂量组8例组织中,有1例记为1分,7例记为2分。中剂量组6例组织中,5例记为1分,1例记为2分。高剂量组得分比中剂量组明显较高(P<0.05,表2)。
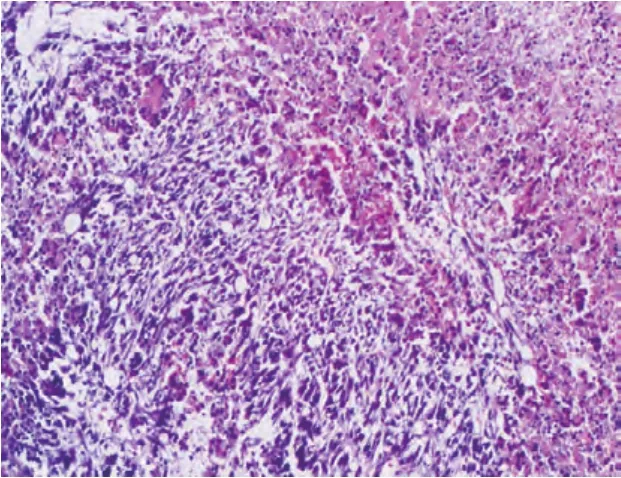
图3 MDA-MB-231乳腺癌移植瘤(HE×100)Figure 3 Pathological sections of the transplantated tumors(HE×100)

表2 小鼠内脏转移情况和镜下移植瘤坏死面积Table 2 Visceral metastasis of mice and tumor necrosis observed by microscopy
3 讨论
动物模型的建立对早期诊断、病因、发病机制、基因治疗以及临床干预之后的疗效随访中有极其重要的价值[4-8]。
在国内外开展的人源性乳腺癌动物模型多采用裸鼠,技术较成熟,成瘤率高,操作较简单,研究较深入。裸鼠模型固然有不可比拟的优点,但也表现出费用高、生长环境要求高、食物和水都需要严格的消毒、寿命短等缺点。本实验则采用环磷酰胺和强的松抑制具有正常免疫功能的BALB/c小鼠,再注射乳腺癌细胞悬浮液进行模型构建。虽技术操作方面较为复杂,但在长期试验中,此种模型可表现出对肿瘤的免疫反应,更好的模仿乳腺癌在免疫正常的机体里的发生、发展过程,并且此种模型生存期长,耐受力强,对于需要长期实验以及后续治疗展现出独特的优势。1980年,Steel等[9]提出对免疫功能正常的动物进行轻度的免疫抑制,从而耐受人癌细胞,制备荷瘤鼠模型。Akhte等[10]使用适当的环孢素A对SD大鼠进行轻度免疫抑制,将人结肠癌细胞HT29悬液注入大鼠腹腔,可成功制备出腹膜转移癌动物模型。
目前国内外可用于建立乳腺癌动物模型的方法大概有以下4种:自发性、诱发性、移植性、转基因和基因敲除性。其中移植法是现在实验室多采用的建立乳腺癌动物模型的方法,其制作的动物模型具有周期短、成本低、成瘤率高、肿瘤的生长速度较一致、个体差异较小等优点[11-13]。目前,因非激素依赖性肿瘤治疗方法较局限[11],本实验采用MDA-MB-231细胞为非激素依赖性肿瘤提供新的研究途径。在预实验过程中,一次性注射1×108/mL细胞后,小鼠在未成瘤之前多死亡。与文献有所出入,对本实验进行改进,将1×108/mL细胞分次注射,分成2、3、4、5次进行注射,最后发现分5次注射,可以控制在成瘤之前无小鼠死亡,且肿瘤的形态和大小与1次性注射1×108/ mL细胞无明显差异。故采用分5次注射,每天小鼠注射0.2 mL/只,浓度为1×108/mL细胞。至于一次性注射1×108/mL细胞死亡率高的原因是否因为在接受细胞注射之前进行了环磷酰胺和强的松处理,仍需要进行进一步的实验和论证。为研究成瘤和免疫抑制剂的剂量关系,本实验将小鼠随机分成4组,分别对4组小鼠予以低、中、高剂量的免疫抑制和生理盐水。实验结果表明,高剂量组小鼠成瘤率最高,但小鼠死亡率最高,达40%(4/10);中剂量组小鼠成瘤率次之,小鼠死亡率较高剂量组明显降低,但仅有1只小鼠在实验过程中死亡。对照组和低剂量免疫抑制组无小鼠成瘤,亦无小鼠死亡。
在临床工作中,PET/CT主要用于肿瘤、心血管系统、神经系统等方面的疾病。由于科学家在对某种疾病的认识和研究过程中,逐步意识到动物模型的建立对于了解疾病的发生、发展及其演变有着举足轻重的地位,因此PET/CT在小动物领域的研究也逐步展开[14-15]。本实验小鼠PET/CT显像提示中剂量组比高剂量组瘤体成像质量好,强化更均匀,更适合于成像研究。病理学检查是目前疾病诊断的“金标准”,高剂量组和中剂量组的癌组织在光镜下细胞形态和排列无明显差别,但高剂量组瘤体组织坏死面积较大。不论是从PET/CT,还是病理学观察,都能表明本实验可成功制备出人乳腺癌小鼠移植模型。总之各种动物模型都有其适用范围,每个研究者必须根据自己的实验目的,一方面致力于建构新的更方便更符合实验要求的模型,另一方面对己有模型继续研究加以改进,制备出最适合自己实验的动物模型。
1 Goldner B,Behrendt CE,Schoellhammer HF,et al.Incidence of inflammatory breast cancer in women,1992-2009,United States[J]. Ann Surg Oncol,2014,21(4):1267-1270.
2 Wang J,Lu Wl,Wang Y.Optimization strategy and analysis of breast cancer in Chinese women[J].Maternal and Child Health Care of China,2013,28(18):2864-2867.[王 璟,芦文丽,王 媛.中国女性乳腺癌筛查现状分析及优化策略[J].中国妇幼保健,2013,28 (18);2864-2867.]
3 Ogawa K,Mukai T,Asano D,et al.Therapeutic effects of a 186Re-complex-conjugated bisphosphonate for the palliation of metastatic bone pain in an animal model[J].J Nucl Med,2007,48 (1):122-127.
4 Goldner B,Behrendt CE,Schoellhammer HF,et al.Incidence of inflammatory breast cancer in women,1992-2009,United States[J]. Ann Surg Oncol,2014,21(4):1267-1270.
5 Storvold GL,Andersen TI,Perou CM,et al.siRNA:a potential tool for future breast cancer therapy[J]?Crit Rev Oncog,2006,12 (1-2):127-150.
6 Chen X,Yang Y,Zhou Q,et al.Effective chemoimmunotherapy with anti-TGFbeta antibody and cyclophosphamide in a mouse model of breast cancer[J].PLoS One.2014,9(1):e85398.
7 Doornebal CW,Klarenbeek S,Braumuller TM,et al.A preclinical mouse model of invasive lobular breast cancer metastasis[J].Cancer Res,2013,73(1):353-363.
8 Iorns E,Drews-Elger K,Ward TM,et al.A new mouse model for the study of human breast cancer metastasis[J].PLoS One,2012,7 (10):e47995
9 Steel GG,Peckham MJ.Human tumour xenografts:a critical appraisal[J].Br J Cancer Suppl,1980,4:133-141.
10 Akhter J,Yao P,Johnson LA,et al.A new peritoneal carcinomatosis model in cyclosporine immunosuppressed rats[J].Anticancer Res, 2008.28(1A):105-108.
11 Akla B,Monteil J,Paraf F,et al.A new orthotopic model of human breast cancer in immunocompetent rats[J].Anticancer Res,2003,23 (5A):3761-3766.
12 Yu WB.Establishment of breast carcinoma model in mice[J].Foreign Medical Sciences(section of Surgery),2005,32(1):63-66.[余微波.乳腺癌动物模型的建立[J].国外医学:外科学分册,2005,32(1); 63-66.]
13 Zhen LL,Wu ZY,Fan P,et al.Establishment of human breast carcinoma model in nude mice[J].Acta Universitatis Medicinalis Nanjing,2001,21(6):509-510.[甄林林,武正炎,范 萍,等.人乳腺癌裸鼠移植模型的建立[J].南京医科大学学报:自然科学版,2001,21(6): 509-510.]
14 Davison CA,Chapman SE,Sasser TA,et al.Multimodal optical, X-ray CT,and SPECT imaging of a mouse model of breast cancer lung metastasis[J].Curr Mol Med,2013,13(3):368-376.
15 Chen XQ,Wang RF.Advancement in researches of small animal PET/CT and its application in disease models[J].China Medical Equipment,2013,10(1):55-59.[陈雪祺,王荣福.PET/CT在动物领域的研究进展[J].中国医学装备,2013,01:55-59.]
(2013-11-15收稿)
(2014-03-05修回)(本文编辑:贾树明)
Cyclophosphamide and prednisone established a human breast carcinoma model in mice
Jian JI,Minfeng LIU,Yipeng YANG,Zhaoze GUO,Jianyu DONG,Changsheng YE
Changsheng YE;E-mail:yechsh2006@126.com
Department of Breast Surgery,Nanfang Hospital of Southern Medical University,Guangzhou 510515,China
Objective:This study aimed to establish a mouse model of breast cancer by inoculating human breast cancer cells into mice with normal immune function.Methods:Forty female BALB/C mice were randomized into four groups,with 10 mice in each group. The four groups were established according to the dosage of cyclophosphamide and prednisone,namely,the control group,low dose group, medium dose group,and high dose group.The mouse models of breast cancer were established by injecting human breast cancer cells into the fat pad of the right second breast of mice in the groups.Mice in the four groups were observed based on the time of tumorigenesis,rate of tumor formation,tumor imaging and pathological features,and metastasis of vital internal organs.Results:In the high dose group,the time of tumor formation was lower than that of the other groups,but the rate of tumor formation was high.Some visceral metastases occurred in the mice.By contrast,the medium dose group revealed completely opposite results.No death and tumor formation in both the control and low dose groups were reported.Conclusion:Ahuman breast carcinoma model in mice was successfully established.Using this model,the onset and development of breast cancer could be much better imitated in the normal immune system of mice.
cyclophosphamide,prednisone,immune suppression,breast neoplasm,animal model,positron emission tomography-computed tomography
10.3969/j.issn.1000-8179.20131920
南方医科大学南方医院乳腺科(广州市510515)
*本文课题受广东省科技计划基金项目(编号:2012B010300013)资助
叶长生 yechsh2006@126.com
This work was supported by a grant from the Guangdong Provincial Funds of Science and Technology Projects(No.2012B010300013)

嵇健 在读硕士研究生。研究方向为乳腺肿瘤疾病。E-mail:irisjijian@163.com

