正常和炎症来源的人牙周膜干细胞内皮向分化能力的比较
叶 菁,张 戎,褚云娟,李 晶,王 萌,陈 芳,王 欣,刘玲侠,王勤涛
(第四军医大学口腔医学院,陕西西安 710032)
正常和炎症来源的人牙周膜干细胞内皮向分化能力的比较
叶 菁,张 戎,褚云娟,李 晶,王 萌,陈 芳,王 欣,刘玲侠,王勤涛
(第四军医大学口腔医学院,陕西西安 710032)
目的:比较炎症和正常牙周膜组来源的牙周膜干细胞(iPDLSCs和PDLSCs)体外成血管的能力。方法:组织块酶消化法培养iPDLSCs和PDLSCs,并经有限稀释法纯化和干细胞表面标记物检测鉴定后,对其进行成血管诱导,并通过免疫荧光染色、实时定量PCR、Matrigel assay检测其内皮细胞相关标记物的表达水平及毛细血管网形成状况。结果:两种细胞经纯化后均阳性表达干细胞标记物CD90、CD29、CD105、CD146;iPDLSCs比PDLCSs具有更高的克隆形成能力;两种细胞经内皮向诱导培养后其内皮细胞标记物VEGF、vWF、CD31、VE-cadherin mRNA的表达水平均较诱导前明显上调(P<0.05),并且均能在体外形成管腔样结构;iPDLSCs中CD31、VE-cadherin mRNA的表达水平和管腔长度、分支节点数等均明显高于PDLSCs(P<0.05)。结论:正常和炎症来源的人牙周膜干细胞均具有成血管能力,并且炎症来源的成血管能力更高。
牙周膜干细胞;分化;血管化
[牙体牙髓牙周病学杂志,2014,24(1):7]
[Chinese Journal of Conservativedentistry,2014,24(1):7]
牙周组织缺损能否获得再生,关键在于能否募集并激活所需细胞并使其发挥作用[1]。来源于牙周膜的细胞在牙周组织再生中起重要作用,是目前公认的牙周组织再生最佳来源细胞[2]。除了健康牙周膜来源的干细胞外,Park JC等[3]还从骨缺损位置的牙周膜组织中成功分离培养了炎症来源的人牙周膜干细胞(inflammatoryderived periodontal ligament stem cells,iPDLSCs),经比较发现,正常和炎症来源的hPDLSCs均能在成骨、成脂微环境中正常分化,两者的分化潜能无差异,但炎症来源的hPDLSCs迁移能力明显强于健康来源者。在牙周组织工程所涉及的根面和需要重建的大量牙槽骨缺损处,必须有血管的形成才能为再生组织提供营养,这是保证牙周再生获得成功不可缺少的一环。Oswald[4]、Portalska 等[5]报道人骨髓来源的间充质干细胞,在体外诱导下具有向内皮细胞分化的能力,从而促进血管的构建。Ye等[6]研究发现,炎症环境在脂肪干细胞向内皮细胞和脂肪细胞分化的过程中起重要调节作用,可促进其向内皮细胞分化。本研究旨在探索牙周膜干细胞是否具有成血管能力,并同时比较健康和炎症来源的牙周膜干细胞成血管能力的差异,以期为牙周组织工程的实现提供参考。
1 材料和方法
1.1 主要试剂和仪器
α-MEM培养液、胎牛血清、penicillin streptomycin solution双抗(Hyclone公司,美国);I型胶原酶(Gibco,美国);胰蛋白酶(Amresco,美国);人重组血管内皮生长因子VEGF165、人重组肿瘤坏死因子TNF-α(PeproTech,美国);人碱性成纤维细胞生长因子bFGF(Millipore,美国);兔抗人CD31单克隆抗体、兔抗人vWF单克隆抗体、兔抗人VEGF单克隆抗体(Epitomics,美国);Cy3荧光标记的山羊抗兔IgG(北京康为世纪生物科技有限公司);RNAiso Plus、PrimeScriptTMRT Master Mix(Perfect Real Time)、SYBR Premix Ex TaqII(Tli RNaseH plus)(Takara,日本);Matrigel基底膜基质胶(BD公司,美国);SW-CJ-2D型超净工作台(苏州净化设备公司);CO2孵箱(Shellab,美国);XDS-1B型倒置相差显微镜(重庆光电设备厂);照相系统(SONY,日本);7500 Real Time PCR System(Applied Biosystems,美国)。
1.2 正常和炎症来源hPDLSCs的培养和鉴定
1.2.1 原代培养
临床选择20~40岁志愿者,因正畸减数或阻生而拔除的前磨牙、第三磨牙10例,均无牙周组织炎症,无牙髓炎、根尖周炎和牙根吸收;同时选取20~45岁患者因重度牙周炎而拔除的患牙13例,均无牙髓炎、根尖周炎、牙根吸收(所有供牙者均年龄相近,性别相同。牙齿拔除后,立即用PBS漂洗3遍,然后刮取根中1/3牙周膜,将其剪成约2 mm×2 mm×2 mm的组织块,离心后加入2.5g/L胰蛋白酶和3 mg/mL的 I型胶原酶,置37℃孵箱中消化40 min后,离心,弃上清,用2 mL α-MEM培养基(含100 mL/L胎牛血清、10 mL/L青霉素、链霉素混合液)重悬,并接种于6孔板,置于37℃,50 mL/L CO2孵箱中培养,每3d换液1次。
1.2.2 有限稀释法纯化细胞并传代
原代细胞培养至80%汇合时用2.5g/L胰蛋白酶消化,离心弃上清,α-MEM培养基重悬并调整细胞密度为10~20/mL后,以1~2/孔的密度接种于96孔板,37℃,50 mL/L CO2孵箱中培养。次日在显微镜下标记出单个细胞孔后继续培养,每3d换液1次;待细胞形成克隆集落(≥50个细胞)时胰酶消化,常规传代培养。
1.2.3 鉴定
1.2.3.1 细胞表面标记物检测
分别取正常和炎症第3代hPDLSCs,2.5g/L胰酶消化,离心弃上清,细胞沉淀用预冷PBS洗3遍后再用含30 mL/L胎牛血清的PBS重悬,并调整细胞密度为2×106/mL;然后将细胞悬液分装于EP管中(每管100 μL),其中一管为裸细胞用于对照,其余各管分别加入相应的直标抗体2 μL,室温避光孵育1 h后,离心弃上清;预冷PBS洗3遍,每管用500 μL含30 mL/L胎牛血清的 PBS重悬,4℃避光保存;BD流式细胞仪检测CD90、CD29、CD105、CD146、CD45、CD34 等表面标记物的表达。
1.2.3.2 细胞生长曲线检测
分别取正常及炎症来源的第3代hPDLSCs,以2×103/孔的密度接种于96孔板,每孔加入100 μL α-MEM培养基后,常规条件下连续培养7d。每天取两种细胞(各 3复孔),并于每孔中各加入100 μL CCK-8 检测液(用无血清 α-MEM 按1∶10的比例配制),常规孵育3 h后用酶标仪检测各孔450 nm波长处的OD值(以无细胞的空白孔调零),然后以时间为横坐标,OD值为纵坐标绘制细胞生长曲线。
1.2.3.3 克隆形成率检测
分别取正常及炎症来源的第3代hPDLSCs,以2×103/皿的密度均匀接种于直径10 cm的平底培养皿,十字法混匀后常规条件下培养。10d后弃原培养液,PBS洗3遍;40g/L多聚甲醛固定20 min,PBS洗3遍;1g/L甲苯胺蓝染色20 min,PBS洗3遍;倒置显微镜下观察;以不少于50个细胞的集落算作一个克隆,按公式计算克隆形成率。
克隆形成率(%)=克隆数/接种细胞数×100%
1.3 两种hPDLSCs内皮分化及管腔形成能力观察
1.3.1 诱导培养及细胞形态的观察
取正常及炎症来源的第3代hPDLSCs分别接种于瓶底或孔底,常规培养至细胞生长达80%~90%汇合时,弃原培养液,并将两种细胞各随机分为实验组和对照组;实验组加入内皮分化诱导培养基(含20 mL/L胎牛血清,10 mL/L青霉素、链霉素混合液,25 ng/mL VEGF,25 ng/mL bFGF 的α-MEM培养液),对照组加入含20 mL/L胎牛血清的α-MEM培养液,常规条件下进行诱导培养,诱导10d后取各组细胞,倒置相差显微镜观察细胞形态变化,并拍照。
1.3.2 免疫荧光染色检测VEGF、vWF的表达
取正常和炎症来源的第3代hPDLSCs制作细胞爬片,并按1.3.1分组和方法进行内皮分化诱导培养。诱导培养10d后。取细胞爬片用40g/L多聚甲醛固定30 min,PBS洗3遍;3g/L triton浸泡20 min,PBS洗3遍;山羊血清室温封闭2 h后分别滴加1∶500的抗VEGF一抗和1∶500的抗vWF一抗,4℃过夜;次日PBS洗3遍,滴加1∶200 Cy3荧光标记的二抗IgG,常温避光孵育1 h;PBS洗3遍,Hoechst复染10 min,荧光显微镜观察并拍照。
1.3.3 Real Time PCR检测内皮细胞相关标记物的表达
分别取1.3.1诱导培养10d后的各组细胞,用RNAiso Plus提取细胞总RNA,经Nanotrop微量紫外分光光度计定量后,再用 PrimeScriptTMRT Master Mix(Perfect Real Time)反转录试剂盒反转录合成cDNA;然后以cDNA为模版,以GAPDH为内参照,用7500 Real Time PCR System进行荧光实时定量 PCR,分别检测 CD31、vWF、VE-cadherin mRNA表达水平。PCR反应体系、反应条件以及各操作步骤均严格按产品说明书要求;所用引物由Takara公司设计并合成,各引物序列见表1。

表1 RT-PCR引物及其序列
1.3.4 Matrigel assay 检测管腔形成能力
取Matrigel基质胶用无血清培养液按1∶1的比例稀释后,均匀铺于96孔板(50 μL/孔),置于37℃培养箱孵育45~60 min备用。然后取1.3.1诱导培养10d后的各组细胞,用2.5g/L胰蛋白酶消化并用诱导培养液重悬;细胞计数后以4×104/孔的密度接种于铺有Matrigel胶的96孔板,置于培养箱内培养。6 h后倒置相差显微镜观察、拍照,并随机选取5个视野,用IPP软件半定量分析其平均分支节点数、管腔长度以及管腔面积。
1.4 统计学分析
2 结果
2.1 两种来源hPDLSCs形态学观察
正常和炎症来源的牙周膜组织用组织块酶消化法培养3~7d时,即可见成纤维样细胞从组织块边缘爬出,2周左右达70%~80%汇合,细胞均呈长梭形(图1)。
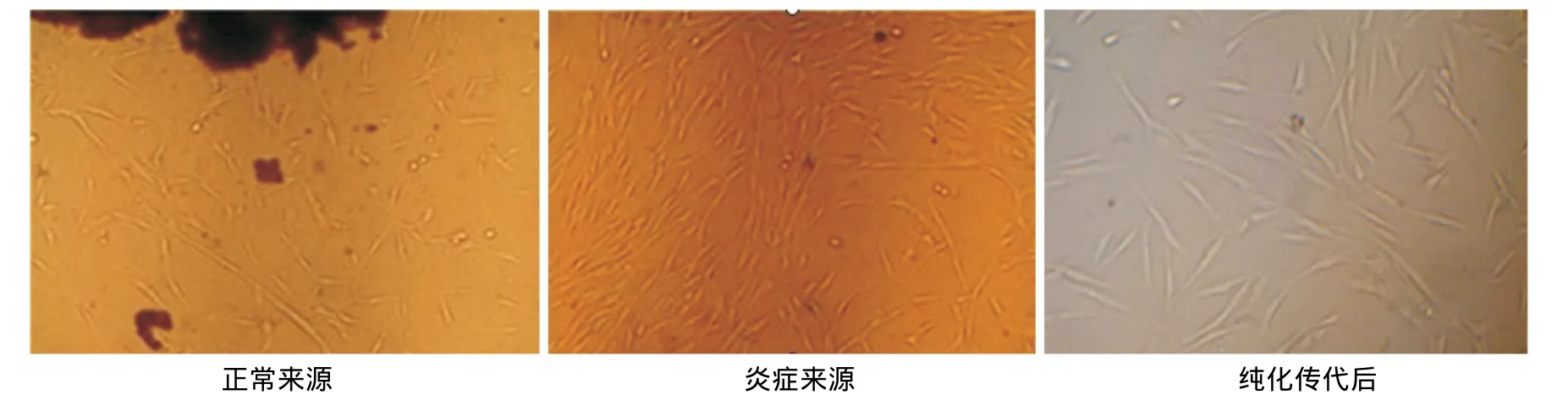
图1 两种hPDLSCs的形态学比较(×50)
2.2 干细胞表面标记物鉴定结果
用流式术检测显示正常牙周膜组织来源的PDLSCs各表面标记物的阳性表达率分别为:CD90(99.3%)、CD29(99.7%)、CD105(98.1%)、CD146(94.5%)、CD34(1.3%)、CD45(1.3%);炎症牙周膜组织来源的PDLSCs各表面标记物的阳性表达率分别为:CD90(98.4%)、CD29(92.8%)、CD105(82.5%)、CD146(80.8%)、CD34(1.1%)、CD45(1.1%),略低于正常来源者,但两者无统计学差异(P>0.05),均符合间充质干细胞的表达特性。
2.3 两种来源hPDLSCs生长曲线比较
正常和炎症牙周膜组织来源hPDLSCs的生长曲线均呈“S”型,即在第6天前细胞数量呈上升趋势,6d起进入平台期;6d前各时间点,炎症PDLSCs的数量高于正常PDLSCs,尤其是第3和第4天,具有统计学意义(P<0.05),之后炎症PDLSCs数量低于正常PDLSCs,但无统计学意义(P >0.05)(图2)。
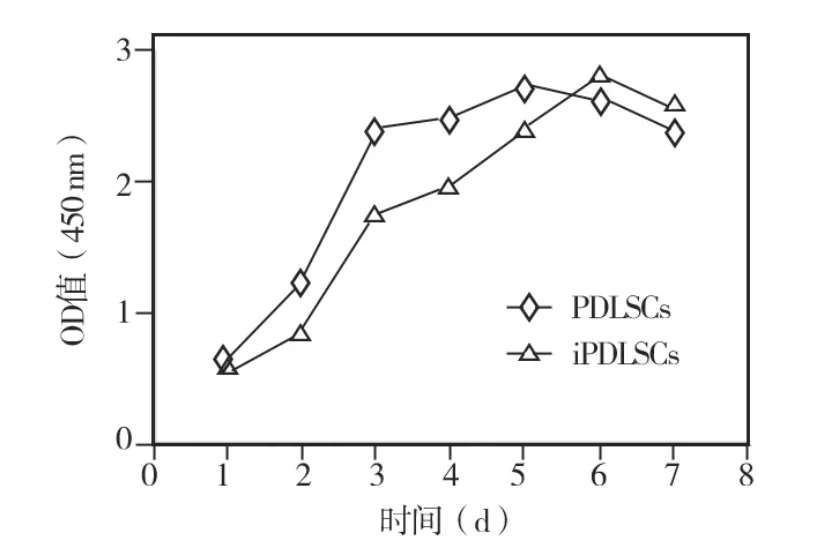
图2 两种hPDLSCs的生长曲线比较
2.4 两种来源hPDLSCs的克隆形成率比较
培养10d后两种来源的PDLSCs均形成了克隆集落,显微镜下可见细胞呈集落状生长,排列紧密。其中正常来源者获得121各克隆株,克隆形成率为6.05%;炎症来源者获得187个克隆株,克隆形成率为9.35%,明显高于正常 PDLSCs,差异有统计学意义(P <0.05)。
2.5 两种来源hPDLSCs成血管能力比较
2.5.1 内皮分化诱导后细胞形态变化
内皮向诱导培养10d后,两种来源PDLSCs的形态均发生了明显改变,部分细胞皱缩、变圆,类似“鹅卵石”样,与内皮细胞形态基本相同(图3)。
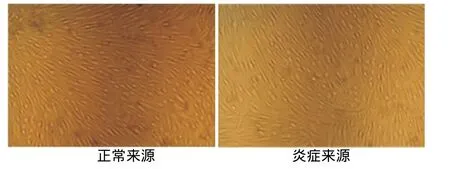
图3 两种hPDLSCs内皮向诱导后的形态比较(×50)
2.5.2 免疫荧光检测 VEGF、vWF 表达
内皮向诱导培养10d后免疫荧光染色观察显示,正常和炎症来源的PDLSCs均阳性表达内皮细胞标记物VEGF、vWF,其中炎症来源者的阳性表达高于正常来源者(图4~7)。
图4 两种hPDLSCs对照组VEGF的表达(×200)
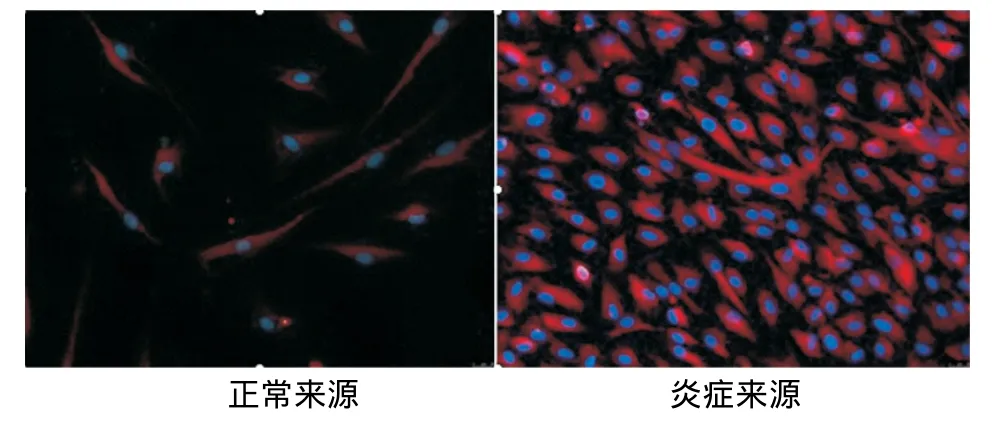
图5 两种hPDLSCs诱导后VEGF的表达(×200)
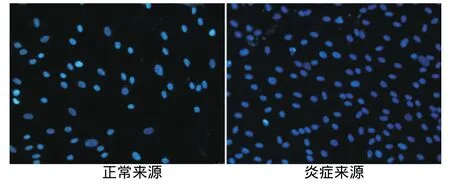
图6 两种hPDLSCs对照组vWF的表达(×200)
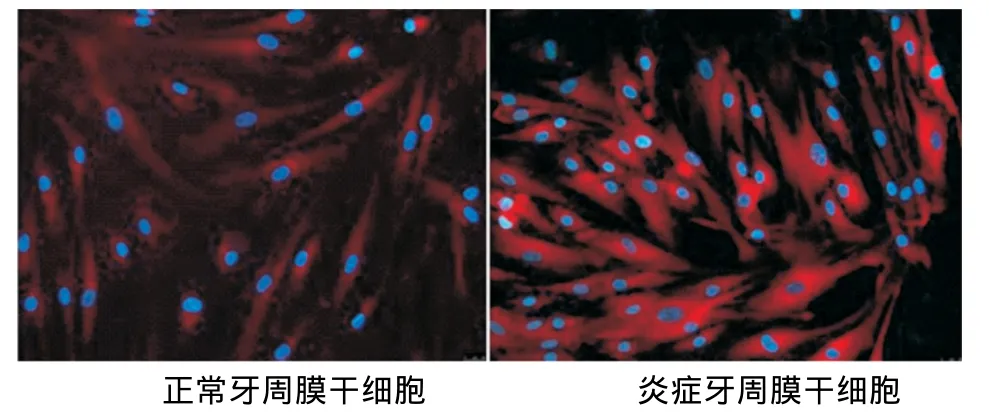
图7 两种hPDLSCs诱导后vWF的表达(×200)
2.5.3两种hPDLSCs内皮细胞相关标记物表达水平的比较
内皮向诱导培养前(对照组)正常和炎症来源的PDLSCs均低表达 CD31、vWF、VE-cadherin等内皮细胞标记物,其中正常来源者的CD31 mRNA表达水平最低;内皮向诱导培养10d后,两种hPDLSCs的 CD31、VE -cadherin、vWF mRNA 的表达水平均明显上调,分别与其未经诱导的对照组相比,差异均有统计学意义(P<0.05);诱导培养后两种来源hPDLSCs的各内皮细胞标记物表达水平相比,炎症来源者的CD31、VE-cadherin mRNA表达水平均明显高于正常来源者,差异有统计学意义(P <0.05)(图8~10)。
2.5.4 两种来源hPDLSCs体外成管腔能力比较
经诱导培养的两种hPDLSCs接种于Matrigel基质胶上培养6 h后,倒置相差显微镜观察显示,未经诱导的正常和炎症来源的hPDLSCs均不能形成完整的管腔样结构,而诱导后的两种细胞均能在Matrigel基质胶上形成管腔样结构,并相连成网状(图11),通过软件半定量分析,炎症来源者形成的分支节点数、管腔长度均高于正常来源者,差异有统计学意义(P<0.05)(图12)。
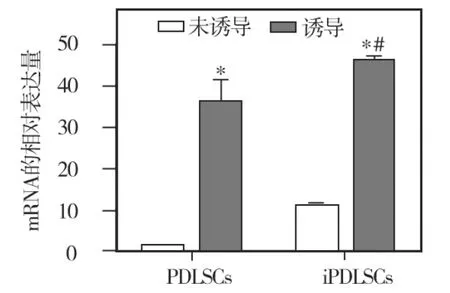
图8 两种细胞诱导前后CD31 mRNA的表达
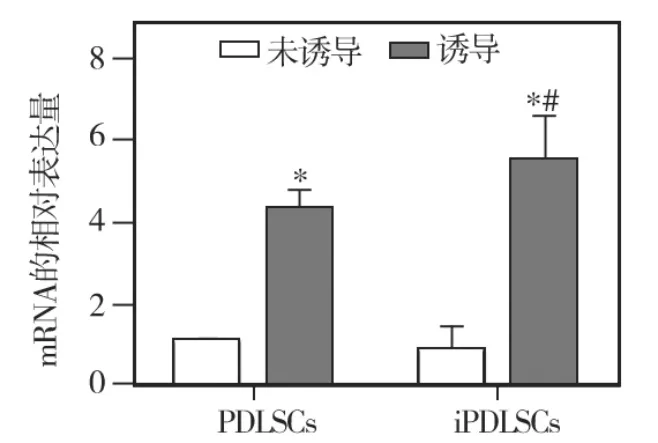
图9 两种细胞诱导前后VE-cadherin mRNA的表达
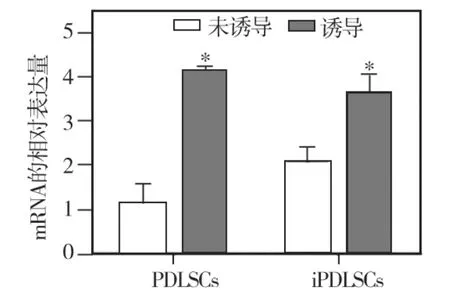
图10 两种细胞诱导前后vWF mRNA的表达
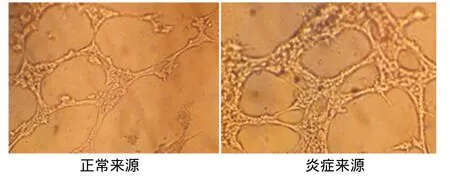
图11 两种来源hPDLSCs诱导后体外管腔结构的形成(×50)
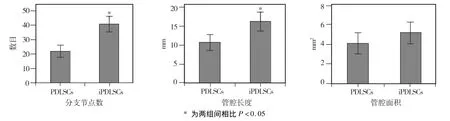
图12 两种来源hPDLSCs所成管腔的半定量分析比较
3 讨论
PDLSCs在牙周组织再生过程中起着至关重要的作用,除健康牙周组织来源的,Park JC[3]和谈珺等[7]还从炎症的牙周膜及炎性肉芽组织中分离出了具有增殖能力、克隆形成能力和成骨成脂能力的干细胞,从而为牙周组织工程提供了一个新的种子细胞的选择。本实验参照谈珺等[7]的方法,分别从健康和炎症牙周膜组织中分离培养出两种来源的hPDLSCs,经比较发现,炎症牙周膜组织来源的hPDLSCs的增殖能力和克隆形成能力均强于正常来源者,与相关文献报道一致。
组织工程不可或缺的三要素是种子细胞、支架材料和信号分子,除此之外,血液的供给也十分重要,它关系到再生的组织能否存活及存活时间的长短。目前已明确,骨髓、脂肪以及皮肤来源的间充质干细胞等通过诱导均具有向内皮细胞分化的能力,本实验中也发现,健康和炎症牙周膜组织来源的间充质干细胞也可以被诱导分化成内皮细胞。
vWF即血管性血友病因子,是血浆中的一种具有粘附功能的糖蛋白,它能介导血小板在血管损伤部位的粘附,参与血小板聚集过程,是内皮细胞损伤及功能障碍的标志物。VEGF即血管内皮生长因子属于血小板衍生生长因子(plateletderivedgrowth factor,PDGF)家族,由血管内皮细胞邻近的细胞所产生,具有促进体内新生血管生成并增加血管通透性的作用[8],因此又被称为血管通透因子;此后的研究证实该因子还能够诱导内皮细胞的增殖和迁移,并通过促进有丝分裂和抑制凋亡来增加内皮细胞的存活[9]。本实验中通过免疫荧光染色观察发现正常和炎症来源的hPDLSCs经内皮向诱导后均阳性表达 vWF和VEGF,表明两种来源的hPDLSCs通过诱导使之向内皮细胞分化。
CD31又被称为血小板-内皮细胞粘附分子,是一种跨膜糖蛋白,属于免疫球蛋白超家族成员,除在血管生成、血小板功能、血栓形成中起不同作用外,还在内皮细胞间的相互联系过程中起重要作用[10]。由于CD31在所有血管内皮细胞中都有高水平表达,故常被用来作为血管内皮细胞的标志物。本实验发现,未诱导的ihPDLSCs也能表达CD31 mRNA,而正常来源的hPDLSCs几乎不表达,这可能是因为炎症环境中某些炎性因子具有刺激血管生成的作用;诱导培养10d后,两种hPDLSCs中的CD31 mRNA表达水平均较对照组明显升高,而且炎症来源者明显高于正常者。提示两者均具有形成血管的能力,其中炎症来源者的血管形成能力较强。
VE-cadherin是血管内皮的特异性钙黏蛋白,特异性表达于血管内皮细胞的表面,并集中分布于内皮细胞连接处,是粘附连接的主要分子。大量研究表明,血管内皮钙黏蛋白对维持血管内皮细胞的极性和血管的完整性是必不可少的[11],是血管内皮再生的标志物。本实验中发现,经诱导的iPDLSCs中表达VE-cadherin mRNA的表达水平明显高于hPDLSCs,再一次证明iPDLSCs的成血管能力强于hPDLSCs。
基于Matrigel基质胶的实验是研究血管化的方法之一[12],通过观察细胞在Matrigel基质胶上能否形成管腔样结构可以判断该细胞的体外成血管能力。本实验通过Matrigel实验发现,炎症和正常来源的hPDLSCs经诱导后均能形成管腔样结构,虽然两者所形成的管腔面积无明显差异,但ihPDLSCs的分支节点数、管腔长度均明显高于hPDLSCs,进一步表明iPDLSCs的成血管能力强于hPDLSCs。
本实验初步证实了PDLSCs可以在体外诱导下分化为内皮细胞,并发现炎症来源的PDLSCs成血管能力更强,但还需要体内实验进一步验证。
[1]Wang HL,Cooke J.Periodontal regeneration techniques for treatment of periodontaldiseases[J].Dent Clin North Am,2005,49(3):637 -659.
[2]Lekic PC,Rajshankard,Chen H,et al.Transplantation of labeled periodontal ligament cells promotes regeneration of alveolar bone[J].Anat Rec,2001,262(2):193 -202.
[3]Park JC,Kim JM,Jung IH,et al.Isolation and characterization of human periodontal ligament(PDL)stem cells(PDLSCs)from the inflamed PDL tissue:in vitro and in vivo evaluations[J].J Clin Periodontol,2011,38(8):721 - 731.
[4]Oswald J,Boxberger S,Jorgensen B,et al.Mesenchymal stem cells can bedifferentiated into endothelial cells in vitro[J].Stem Cells,2004,22(3):377 -384.
[5]Portalska KJ,Leferink A,Groen N,et al.Endothelialdifferentiation of mesenchymal stromal cells[J].Plos one,2012,7(10):e46842.
[6]Ye J,Gimble JM.Regulation of stem celldifferentiation in adipose tissue by chronic inflammation[J].Clin Exp Pharmacol Physiol,2011,38(12):872 -878.
[7]谈珺,王新文,周丽华,等.人牙周炎症组织中干/祖细胞的分离培养及初步鉴定[J].牙体牙髓牙周病学杂志,2011,21(3):130-133.
[8]Dvorak HF,Brown LF,Detmar M,et al.Vascular permeability factor/vascular endothelialgrowth factor,microvascular hyperpermeability,and angiogenesis[J].Am J Pathol,1995,146(5):1029-1039.
[9]Hoeben A,Landuyt B,Highley MS,et al.Vascular endothelialgrowth factor and angiogenesis[J].Pharmacol Rev,2004,56(4):549-580.
[10]CaogY,Fehrenbach ML,Williams JT,et al.Angiogenesis in platelet endothelial cell adhesion molecule-1-null mice[J].Am J Pathol,2009,175(2):903 -915.
[11]Corada M,Mariotti M,Thurstong,et al.Vascular endothelial-cadherin is an importantdeterminant of microvascular integrity in vivo[J].Proc Natl Acad Sci USA,1999,96(17):9815 -9820.
[12]Carolyn AS,Stephen MS,Simon T,et al.Current methods for assaying angiogenesis in vitro and in vivo[J].Int J Exp Pathol,2004,85(5):233 -248.
A comparative study on the endothelial celldifferentiation of human healthy and inflammatory periodontal ligament stem cells
YE Jing,ZHANG Rong,CHU Yun-juan,LI Jing,WANG Meng,CHEN Fang,WANG Xin,LIU Ling-xia,WANG Qin-tao
(School of Stomatology,The Fourth Military Medical University,Xi’an 710032,China)
AIM:To compare the angiogenesis ability of the stem cellsderived from inflammatory and healthy periodontal ligament tissues(iPDLSCs and PDLSCs)in vitro.METHODS:iPDLSCs and PDLSCs were primarily cultured by tissuedigestion method.Cells were passaged and identified by stem cell surface marker expression using flow cytometry.The angiogenesis ability of the cells weredetermined by angiogenesis induction,immunofluorescence test,real-time quantitative PCR and Matrigel assay.RESULTS:The two types of cells both expressed stem cell markers CD90,CD29,CD105 and CD146.iPDLSCs showed higher colony forming capacity.After angiogenesis induction,both cells could express endothelial cell markers VEGF,vWF,CD31,VE-cadherin and form tube structure in vitro.However,CD31 and VE -cadherin expression of iPDLSCs was higher than that of PDLSCs(P <0.05),the vessel length and branch points in the culture of iPDLSCs were more than those in the culture of PDLSCs.CONCLUSION:Human PDLSCs and iPDLSCs both have angiogenesis ability in vitro,and the ability of iPDLSCs is stronger than that of PDLSCs.
periodontal ligament;stem cells(PDLSCs);differentiation;vascularization
R780.2
A
1005-2593(2014)01-0007-06
2013-08-31;
2013-11-28
国家自然科学基金项目资助(81271137)
叶菁(1989-),女,汉族,安徽安庆人。硕士生(导师:王勤涛)
王勤涛,E -mail:yznmbk@fmmu.edu.cn

