Hedgehog信号通路分子Shh、Ptch和Smo在化学诱导小鼠肝癌模型过程中的动态表达
李韵秋 匡志鹏 吴继宁 孔 娜 杨 帆
原发性肝细胞肝癌(primary human hepatocellular,HCC)是现今常见的恶性肿瘤之一,其发生率在我国有明显增加趋势,比欧美国家高5~10倍,是全球发生率最高的国家[1,2]。有研究显示,肝癌的发生、发展是肝癌细胞无限增殖与凋亡减少的结果,信号转导通路在其中扮演着重要角色,随着对肝癌信号转导通路研究的不断深入,人们发现肝癌细胞内部的某些信号转导通路的激活或抑制与肝癌的发生、发展等有着紧密的联系。近几年来,Hedgehog信号通路在肝癌发生、发展变化中的作用进行了初步的探索,大多数报道结果为肝癌发生与Hedgehog信号通路关系密切,并且是最近探讨肝癌机制研究的热点,但是具体作用尚不清楚[3]。本研究通过观察HH信号通路成员Shh、Ptch和Smo在化学诱发小鼠肝癌模型中的动态表达情况,探讨Hedgehog信号通路与肝癌发生、发展的关系。
材料与方法
1.主要试剂与药品:免疫组织化学用Shh、Ptch和Smo兔抗鼠多克隆抗体(博奥森生物技术有限公司)。SP试剂盒(北京中杉金桥生物技术有限公司)。总RNA提取试剂Trizol(美国Invitrogen公司)。M-MuLV反转录试剂盒(加拿大MBI Fermentas公司)。引物由上海生工生物有限公司合成。Real-Master Mix(SYBR Green)(Takara公司)。定量PCR仪为美国MJR公司产品。组织蛋白裂解液及发光底物试剂盒(上海碧云天Beyotime公司),蛋白质印迹检测用Shh和Ptch兔抗鼠多克隆抗体(美国Millipore公司),Smo兔抗鼠多克隆抗体(美国Abcam公司),GAPDH单克隆抗体和羊抗兔二抗(美国CST公司)。
2.C57BL/6J小鼠肝癌模型制备:小鼠造模阶段已在前期实验中获得成功,简要过程如下:选取符合标准的95只正常C57BL/6J雄性小鼠,随机分为对照组45只及诱癌组50只,对照组仅喂以小鼠颗粒饲料及灭菌普通水,诱癌组采用化学法[二乙基亚硝胺(DEN)/四氯化碳(CCl4)/乙醇]诱发小鼠肝癌,于诱癌开始后第4周随机处死诱癌组及对照组小鼠各5只,此后以相同方法处理第6、8、10、12、14、16、18 和 20 周的两组小鼠,获取各周期诱癌组和对照组肝组织标本,苏木精-伊红(HE)染色镜检提示成功诱发小鼠肝癌,具体步骤参见文献[4]。
3.免疫组织化学检测Shh、Ptch和Smo的表达:SP法简略步骤:组织标本石蜡包埋-切片-脱蜡-抗原修复-滴加一抗4℃过夜-按照试剂说明书二抗孵育-DAB显色-苏木素复染-脱水封片。每例切片随机选取10个高倍视野,根据阳性细胞百分率及显色深浅采用半定量积分法分级[5],评分标准为:(1)阳性细胞百分率:未见阳性细胞者为0分,<25%为1分,25% ~75%为2分,>75%为3分。(2)显色深浅:不显色或显色不清为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分,将以上2项相加最终评定结果,0~1分为阴性(-),2~3分为弱阳性(+),4~5分为中度阳性(++),>5分为强阳性(+++),且阳性结果定义为细胞质伴或不伴有细胞膜上呈现棕黄色或者棕褐色Shh、Ptch蛋白颗粒,细胞核伴或不伴有细胞膜上呈现棕黄色或者棕褐色Smo蛋白颗粒。
4.RT-PCR法检测Shh、Ptch和Smo mRNA的表达:按照试剂盒对组织标本进行总RNA的提取及cDNA的反转录。Shh基因上游引物:5'-AAAGCTGACCCCTTTAGCCTA-3';下游引物:5'-TTCGCAGTTTCTTGTGATCTTCC-3'。Ptch基因上游引物:5'-AAAGAACTGCGGCAAGTTTTTG-3';下游引物:5'-CTTCTCCTATCTGACGGGT-3'。Smo基因上游引物:5'-ATGATGGACCTGTTGCG-3';下游引物:5'-GTTGGCTTGTTCTTCTGG-3'。β-actin基因上游引物:5'-GTCCCTCACCCTCCCAAAAG-3';下游引物:5'-GCTGCCTCAACACCTCAACCC-3'。按25μl反应体系进行。反应条件为:95℃30s,95℃ 5s,62.2℃ 30s,共 40 个循环。得到目的基因及相应内参的CT值。
5.Western blot法检测 Shh、Ptch和 Smo蛋白的表达:内参选用GAPDH,实验简要步骤:提取组织总蛋白测定其浓度-电泳-转膜-封闭-滴加一抗4℃培育过夜-加入羊抗兔IgG-HRP二抗-洗膜,然后按化学发光法试剂盒的说明书进行发光、压片。
6.统计学方法:统计学分析软件SPSS 16.0。计量资料以均数±标准差(±s)表示,均数间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1.免疫组织化学法检测结果:对照组小鼠肝组织中未检测到Shh、Ptch和Smo蛋白的表达(图1A、图2A和图3A)。在诱癌组中,3种蛋白在小鼠肝癌组织中的表达结果为第6周时检测Shh蛋白的表达为弱阳性(图1B),第16周时出现中度阳性(图1C),到第20周时Shh蛋白在小鼠肝癌组织中的表达为强阳性(图1D)。诱癌组小鼠肝癌组织中Ptch蛋白在第8周时的表达结果为弱阳性(图2B),第16周时在小鼠肝癌组织中的表达结果为中度阳性(图2C),到第20周时表达结果为强阳性(图2D)。且小鼠肝癌组织中Smo蛋白分别在第10周、第16周和第20周时出现弱阳性、中度阳性和强阳性表达(图3B~D)。
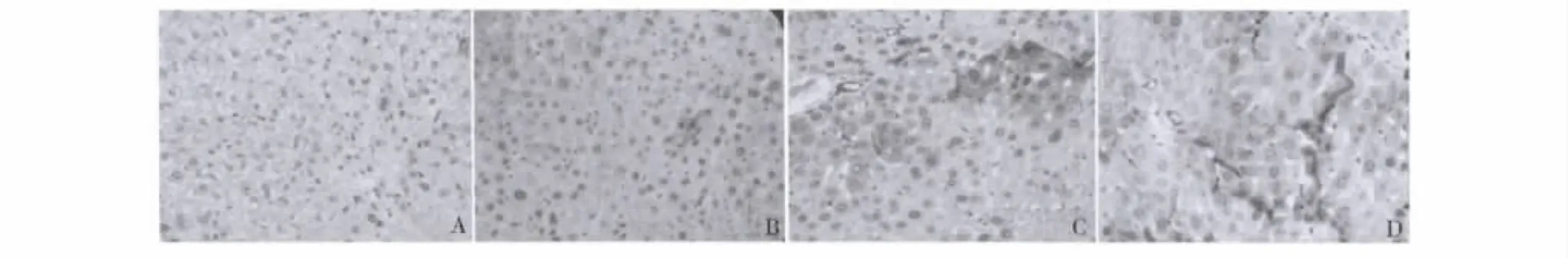
图1 免疫组织化学法检测Shh在化学诱导小鼠肝癌组织中表达情况(×400)
2.实时荧光定量PCR检测结果:通过已知相对定量方法分析数据:①改变的倍数(fold change)=2-ΔΔCT;②ΔΔCT=(CT 靶基因 -CT 内参)诱癌组-(CT靶基因-CT内参)实验组。如表1所示,诱癌组小鼠肝组织和其对应的正常对照组小鼠肝组织的表达显示:诱癌组与对照组两者的小鼠肝组织中Shh mRNA和Ptch mRNA的表达在第4周时差异均无统计学意义(P>0.05)。从第6周开始(包括第6周),诱癌组中Shh mRNA和Ptch mRNA的表达均明显高于对照组中的表达,差异有统计学意义(P<0.05,P<0.001)。而Smo诱癌组与Smo对照组两者的小鼠肝组织中Smo mRNA的表达在第4周和第6周时差异均无统计学意义(P>0.05)。从第8周开始(包括第8周),Smo诱癌组中Smo mRNA的表达才明显高于Smo对照组中的表达,差异有统计学意义(P<0.05,P <0.001)。
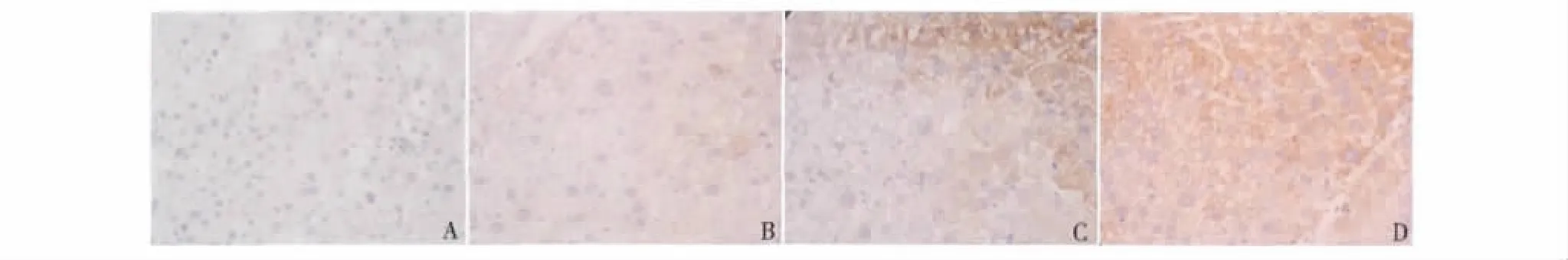
图2 免疫组织化学法检测Ptch在化学诱导小鼠肝癌组织中表达情况(×400)

图3 免疫组织化学法检测Smo在化学诱导小鼠肝癌组织中表达情况(×400)

表1 不同诱癌周期小鼠肝组织中Shh mRNA、Ptch mRNA和Smo mRNA分别在其诱癌组的表达与其相对应对照组的表达比较(2-ΔΔCT)
同一对照组中各周期之间的表达显示:对照组中小鼠肝组织中的Shh mRNA、Ptch mRNA和Smo mRNA 的表达在第4、6、8、10、12、14、16、18、20 周变化均无统计学意义(P>0.05)。而同一诱癌组中后一周期与前一周期之间的表达显示:Shh诱癌组中,9个阶段中,后一周期Shh mRNA的表达水平均显著高于前一周期的表达水平,表达差异有统计学意义(P<0.05,P <0.001)。Ptch诱癌组中,Ptch mRNA 在第 6周的表达与第4周的表达比较无统计学差异(P>0.05),第8周时的Ptch mRNA表达明显高于第6周(P<0.05),第10周时的表达同样明显高于第8周(P<0.05),第12周的表达与第10周的表达差异却无统计学意义(P>0.05)。此后,后一周期Ptch mRNA的表达水平均显著高于前一周期的表达水平,表达差异有统计学意义(P <0.05,P <0.001)。Smo诱癌组中,Smo mRNA在第6周的表达与在第4周的表达比较,差异无统计学意义(P>0.05),第8周时的Smo mRNA表达与第6周时的表达、第10周时与第8周时的表达差异有统计学意义(P<0.05),到第12周时,Smo mRNA的表达与第10周时比较无统计学差异(P>0.05)。此后,第14周表达明显高于第12周(P<0.05),第16周明显高于第14周(P<0.05),第 18周明显高于第 16周(P<0.05),第20周时达最高,与第18周时比较无统计学意义(P>0.05)。
从整个诱癌过程可以看出,随着小鼠诱癌周期的增长,诱癌组的3种mRNA的表达量分别均呈逐步上升趋势,至第20周时3组诱癌组中三者表达水平均达到各自的最高值,分别是Shh mRNA为15.986±1.784,Ptch mRNA 为 11.272 ± 0.295,Smo mRNA为10.185 ±0.716。
4.蛋白质印迹法检测结果:如图4所示。以诱癌组中GAPDH(37kDa)(图4中D1)的表达条带为准,设定为强表达。3种蛋白在诱癌组小鼠肝癌组织中的表达结果为诱癌组第4周时,未检测出Shh蛋白的表达,第6周开始出现Shh蛋白的表达,此时表达较弱,从第8周至第20周表达增强,第16周、第18周和第20周时表达的条带均有增宽(图4中A1,Shh 45kDa)。诱癌组中Ptch蛋白在第4周和第6周均未检测出,到第8周时出现较弱的表达,第10周到第14周表达量有所增加,至第16~20周时出现强表达(图4中B1,Ptch 160kDa)。而诱癌组Smo蛋白到第10周时方检测出蛋白的表达,随着诱癌时间的递增,Smo蛋白的表达量逐渐增多,第20周表达最显著,条带明显增宽(图4中C1,Smo 86kDa)。以对照组中GAPDH(37kDa)(图4中D2)的表达条带为准,设定为强表达。对照组小鼠肝组织中未检测到Shh、Ptch和Smo蛋白的表达(图4中A2、B2、C2)。

图4 蛋白质印迹法检测Shh、Ptch和Smo蛋白在诱癌组及对照组小鼠肝癌组织中的表达情况
讨 论
Hedgehog(HH)信号通路是一条高度保守的信号转导通路,在胚胎的发育成熟、器官内环境稳定的维持、组织损伤后的修复和再生、某些肿瘤的发生发展以及肿瘤的分化与浸润中起重要作用,是维持肿瘤干细胞的重要信号通路[6]。最近越来越多的研究显示,当该通路被异常激活时能导致多种肿瘤形成,如基底细胞癌、胃癌和胰腺癌等[7~9]。HH信号通路的失调同样也参与肝脏疾病的发生与发展,从肝脏的胚胎发生上来看,肝脏来源于前肠末端的肝憩室,HH信号通路在胚胎肝细胞增殖和分化调控中起重要作用,但是随着肝脏的逐渐形成,HH信号通路相关蛋白也逐渐消失,在正常成人肝脏中,Hedgehog信号通路处于静止状态,不表达或很少表达。但不少研究者发现,该通路成分在肝癌中出现了异常高表达,在肝癌组织中可见Hedgehog信号通路的异常激活[10]。其中,Shh配体,跨膜蛋白受体Ptch和Smo是Hedgehog信号通路的核心成员。研究表明,Shh基因是编码一系列分泌蛋白的基因家族,它编码一系列分泌型信号蛋白,1980年首先在果蝇基因分析中被发现,其编码的Shh蛋白是整条信号通路的启动因子,是Hedgehog信号通路的重要组成部分[11]。Smo基因为原癌基因,编码的Smo蛋白属于G蛋白偶联受体,有7个跨膜区,在HH信号通路中发挥着桥梁作用。有研究认为Ptch可能发挥抑癌作用,是一个抑癌基因,能特异性抑制Smo的信号转导功能,避免HH信号通路过度活化引发肿瘤。在没有Shh配体信号刺激下,Ptch与Smo结合,抑制Smo的活性,该信号通路处于失活状态。过多的Shh蛋白表达使Shh蛋白与Ptch蛋白结合,解除了Ptch蛋白对Smo的抑制,Smo被激活,继而激活转录因子Gli,进而启动下游基因的表达,从而调控肝癌的发生发展。
本研究通过建立C57BL/6J小鼠原发性肝癌动物模型,并采用免疫组织化学法、实时荧光定量PCR技术和蛋白质印迹法检测Shh、Ptch和Smo三者的基因及蛋白在该模型中的定性和定量表达情况,更好地了解Hedgehog信号通路在肝癌发生发展过程中可能的机制。结果显示,免疫组织化学法、实时荧光定量PCR法和蛋白质印迹法在对照组全程均未检测到Shh、Ptch和Smo的显著性变化,主要原因是正常肝细胞中三者仅出现微量变化,实验方法的敏感度使检测受到限制。诱癌组前期Shh、Ptch和Smo三者的变化也均不明显:免疫组织化学法显示,诱癌组Shh、Ptch和Smo蛋白分别在第6周、第8周和第10周才出现弱阳性。实时荧光定量PCR法检测结果显示,与正常对照组比较,诱癌组小鼠肝组织中Shh mRNA、Ptch mRNA和Smo mRNA的表达分别至第6周、第6周和第8周开始,才明显高于正常对照组,差异有统计学意义(P <0.05,P <0.001)。
蛋白质印迹法检测结果显示,诱癌组Shh、Ptch和Smo蛋白分别从第6周、第8周和第10周起出现弱表达。这说明在诱癌前期小鼠肝组织仅为炎症反应性病变,三者的表达有所上升,但是上升的幅度并不大,由于免疫组织化学法和蛋白质印迹检测结果为定性分析,未能表述出蛋白在量上的变化趋势,因此表达差异并未检测出。只有实时荧光定量检测敏感度高,得到Shh、Ptch和Smo在此期间的变化差异。从第10周开始至第14周,各诱癌组与同一组别同一周期对照组的Shh mRNA、Ptch mRNA和Smo mRNA的表达差异均有统计学意义(P<0.05,P<0.001)。且三者的表达量在此过程中是逐渐增加的趋势,Shh诱癌组中,后一周期Shh mRNA的表达水平均显著高于前一周期的表达水平(P<0.05),Ptch mRNA和Smo mRNA两者在第14周期的表达也明显高于在第12周期的表达(P<0.05)。在第16周时,小鼠肝组织重度非典型增生。同时免疫组织化学法检测Shh、Ptch和Smo蛋白表达均呈中度阳性;实时荧光定量PCR检测Shh mRNA、Ptch mRNA和Smo mRNA的表达大幅度上升。蛋白质印迹法显示三者的目的条带较前均有所增宽。此后随着诱癌周期的递增,Shh、Ptch和Smo的表达在定量和定性方法检测中均呈上升趋势,到20时达最盛。此时免疫组织化学法检测Shh、Ptch和Smo表达均呈强阳性;实时荧光定量PCR 法(计算结果 Shh mRNA 为15.986±1.784,Ptch mRNA 为 11.272 ± 0.295,Smo mRNA 为 10.185 ±0.716)和蛋白质印迹法检测三者表达均达最大化,此时癌组织已经形成。
实验结果提示,化学诱导小鼠肝癌模型建立的过程是一个由量变转化到质变的动态变化过程,简陋的解释了Hedgehog信号通路中Shh、Smo和Ptch在分子水平的变化规律。三者的增长趋势基本上是同步的,对照组中3种分子的水平变化均不明显。在诱癌组中,诱癌初期,即第8周前Shh基因表达增加,编码过多的Shh配体,使得其与稍弱增强表达的Ptch受体结合,Smo的抑制作用被解除,整条Hedgehog信号通路被激活,随着化学诱癌剂的继续作用,三者表达量显著增加,彼此相互作用,发挥着正性调控的作用,致使诱癌达到20周时成功诱发小鼠肝癌,表达最盛。
综上所述,正常对照组小鼠肝组织中Shh、Ptch和Smo表达量低而未被检测出,而在化学诱癌组中Hedgehog信号通路在诱癌的早期就已经被激活,其成员Shh、Ptch和Smo表达量的持续增加所形成的微环境的不断变化调控着小鼠肝癌的发生、发展全过程,但确切的调控机制还有待于进一步深入研究,以及与肝癌中其他信号通路之间的共同调控作用机制也需要做进一步的探索。本研究模拟人体肝癌模型,对Shh、Ptch和Smo在小鼠肝癌的始动发生到形成肝癌的过程中的动态变化规律的阐述,为将来开展基因工程药物的研究和肝癌的靶向治疗打下良好的基础。
1 Llovet JM,Burrough A,Bruix J.Hepatocellular carcinoma[J].Lancet,2003,362(9399):1907-1917
2 Page JM,Harrison SA.NASH and HCC[J].Clin Liver Dis,2009,13(4):631-647
3 Cheng WT,Xu K,Tian DY,et al.Role of Hedgehog signaling pathway in proliferation and invasiveness of hepatocellular carcinoma cells[J].Int J Oncol,2009,34(3):829-836
4 唐超莉,匡志鹏,杨帆.β-catenin在小鼠化学肝癌形成过程中的动态变化[J].现代肿瘤医学,2013,21(6):1204-1208
5 Chen X,Horiuchi A,Kikuchi N,et al.Hedgehog signal pathway is activated in ovarian carcinomas correlating with cell proliferation:It's inhibition leads to growth suppression and apoptosis[J].Cancer Sci,2007,98(1):68-76
6 Shen Y,Cao D.Hepatocellular carcinoma stem cells:origins and roles in hepatocarcinogenesis and disease progression[J].Front Biosci:Elite Ed,2012,4:1157-1169
7 Caro I,Low JA.The role of the hedgehog signaling pathway in the development of basal cell carcinoma and opportunities for treatment[J].Clin Cancer Res,2010,16(13):3335-3339
8 Martin J,Donnelly JM,Houghton J,et al.The role of sonic hedgehog reemergence during gastric cancer[J].Dig Dis Sci,2010,55(6):1516-1524
9 Walter K,Omura N,Hong SM,et al.Overexpression of smoothened activates the sonic hedgehog signaling pathway in pancreatic cancerassociated fibroblasts[J].Clin Cancer Res,2010,16(6):1781-1789
10 Sicklick JK,Li YX,Melhem A,et al.Hedgehog signaling maintains resident hepatic progenitors throughout life[J].Am J Physiol Gastrointest Liver Physiol,2006,290(5):G859-G870
11 Tian F,Mysliwietz J,Ellwart J,et al.Effects of the Hedgehog pathway inhibitor GDC-0449 on lung cancer cell lines are mediated by side populations[J].Clin Exp Med,2012,12(1):25-30

