聚苯乙烯磺酸钙对CKD患者RAAS-I所致高钾血症的防治作用
梁建忠,姚筱,李宁
(惠州市第三人民医院肾内科 广东 惠州 516000)
慢性肾脏病(chronic kidney disease,CKD)发生率逐年上升。根据相关文献报道,我国CKD发病率为10.8%[1]。肾素-血管紧张素-醛固酮系统抑制剂(renin angiotensin aldosterone system inhibitors,RAAS-I)是临床治疗CKD的常用药物,包括血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI)和血管紧张素 II受体拮抗剂(angiotensinII receptor blockers,ARB)。大量临床研究已证实,肾素-血管紧张素-醛固酮系统抑制剂能延缓肾脏病进展,被广泛应用于CKD治疗[2]。但是,RAAS-I可导致高血钾症并发症的发生,从而限制其在CKD中的临床应用[3]。聚苯乙烯磺酸钙是钾离子结合剂,口服后不被消化吸收。在结肠附近的肠道内,本品的钙离子与肠道内的钾离子发生离子交换,聚苯乙烯磺酸树脂不发生任何变化而经粪便排出,肠道内的钾也随之被排出体外,从而使血钾水平降低。但关于聚苯乙烯磺酸钙对CKD患者服用RAAS-I所致高钾血症的防治作用和聚苯乙烯磺酸钙的药物安全性研究较少,现报道如下。
1 资料与方法
1.1 一般资料 选取本院2012年6月至2013年8月收治的73例CKD患者,均符合 CKD的诊断标准[4],且血肌酐 <265 μmmol/L,至少 2 个月内未服用RAAS-I。排除标准:①易发生便秘者;②肠道狭窄患者;③肿瘤患者;④妊娠期和哺乳期妇女;⑤慢性咳嗽患者;⑥确诊或疑诊肾血管疾病者;⑦服用利尿剂、皮质类固醇激素、非甾体类抗炎药及免疫抑制剂患者;⑧评估血压不能耐受降压药物治疗者。采用随机数字表法将患者分为观察组和对照组。观察组37例,其中男23例,女14例;年龄30~72岁,平均(46.31±5.04)岁;病程3~55个月,平均(25.33±3.04)个月;疾病类型:原发性肾小球疾病15例,高血压性肾脏疾病8例,糖尿病肾病10例,其他4例;对照组36例,其中男20例,女16例;年龄31~71岁,平均(46.44±5.21)岁;病程5~50个月,平均(26.11±3.24)个月;疾病类型:原发性肾小球疾病13例,高血压性肾脏疾病9例,糖尿病肾病11例,其他3例。两组患者在性别、年龄、病程和疾病类型等方面比较,差异无统计学意义(P>0.05),具有可比性。本研究方案经本院伦理委员会批准。
1.2 治疗方法 全部患者均给予血管紧张素转换酶抑制剂贝那普利(洛汀新)10mg,1次/d;血管紧张素Ⅱ受体拮抗剂缬沙坦(代文)80mg,1次/d。1个月后,两组患者继续上述方案给药12个月,观察组另同时给予聚苯乙烯磺酸钙散剂(可利美特)5 g,3次/d口服治疗至研究终结。
1.3 观察指标 监测RAAS-I服药前及服药1个月后血肌酐、24 h尿蛋白定量、血钾、高钾血症发生率。并比较观察组和对照组患者在第1、2、3、6、12个月血钾水平和高钾血症发生率。
1.4 高钾血症诊断标准 临床症状隐匿,血钾水平>5.5 mmol/L即可确诊;采血时避免止血带过紧导致的“假性高钾血症”[5]。
1.5 统计学处理 本研究数据采用SPSS 13.0统计软件进行分析,定量资料组间比较采用t检验,定性资料采用χ2检验,P<0.05为差异具有统计学意义。
2 结果
2.1 RAAS-I有效性和安全性 RAAS-I服药1个月后,24 h尿蛋白定量均明显改善,优于RAAS-I服药前;血钾水平明显高于RAAS-I服药前,差异具有统计学意义(P<0.05);血肌酐水平有轻度升高,但上升幅度小于30%,见表1。高钾血症发生率为8.22%(6/73)。
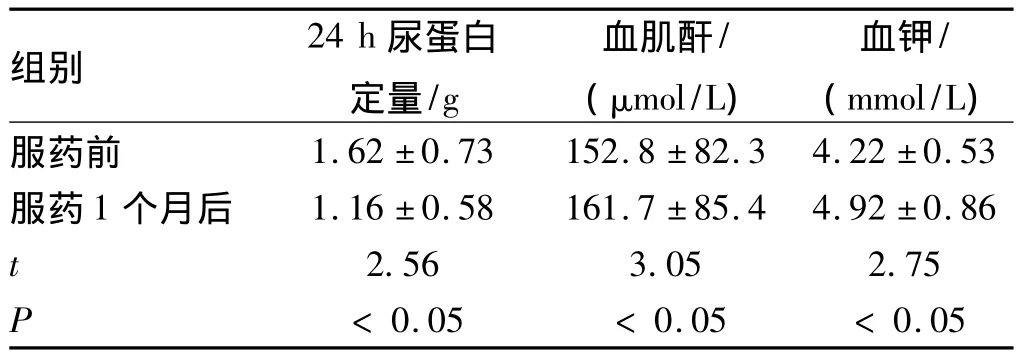
表1 RAAS-I服药前后24 h尿蛋白定量、血肌酐、血钾水平变化情况比较(n=73)
2.2 血钾水平比较 聚苯乙烯磺酸钙用药前,两组患者血钾水平比较,差异无统计学意义(P>0.05)。用药后,观察组给药后1、2、3、6、12个月血钾水平均明显低于对照组,差异均有统计学意义(P<0.05)。见表2。
表2 两组患者血钾水平比较(,mmol/L)

表2 两组患者血钾水平比较(,mmol/L)
组别 给药前给药后/月12观察组 4.94 ±0.84 4.21 ±0.70 4.22 ±0.68 4.20±0.74 4.1 1 2 3 6>0.05 < 0.05 < 0.05 < 0.05 < 0.05 < 0.05 0±0.65 4.13 ±0.62对照组 4.90±0.85 5.01 ±0.82 5.13 ±0.85 5.21 ±0.77 5.17 ±0.78 5.19 ±0.79 t 0.16 3.16 3.41 3.44 4.01 4.05 P
2.3 高钾血症发生率比较 聚苯乙烯磺酸钙用药前,两组患者高血钾发生率比较差异无显著性(P>0.05),用药后,观察组给药后1、2、3、6、12 月高血钾发生率均明显低于对照组,比较具有明显差异(P<0.05),见表3。

表3 两组患者高钾血症发生率比较[n,(%)]
3 讨论
国内外已有大量的研究证实RAAS-I除具有良好的降压作用;还有其独特的减少蛋白尿作用,其降蛋白尿作用的主要机制是通过其对肾小球出球小动脉的扩张作用大于入球小动脉的扩张作用,从而降低肾小球毛细血管内的“三高状态”(高灌注、高压力、高滤过)来实现,同时还有抗氧化、减轻肾小球基底膜损害、抑制细胞因子等非血流动力学作用,从而延缓慢性肾脏病患者肾功能恶化过程,是肾脏病的重要治疗药物。服用RAAS-I短期内虽然可能导致血肌酐升高(因其对肾小球出球小动脉的扩张作用大于入球小动脉,导致肾小球滤过率有一定程度的下降),但如果血肌酐上升幅度不超过30%,因其具备肾脏保护作用,故认为仍可继续使用以延缓慢性肾脏病的进展。国内有文献报道,即使对于血肌酐>265 μmol/L的患者应用血管紧张素转换酶抑制剂(ACEI),随访2 a,以血肌酐水平较基线值增加1倍,或需要进入透析治疗作为主要研究终点,研究结果显示两年后治疗组与非治疗组达主要终点事件的发生率分别为40.90%和51.35%[6],提示血管紧张素转换酶抑制剂(ACEI)对血肌酐即使大于265 μmol/L的慢性肾脏病(CKD)患者仍具肾脏保护作用。但应用肾素-血管紧张素-醛固酮系统抑制剂(RAAS-I)可能引发高钾血症,CKD患者肾功能减退,高钾血症的发生率往往高于普通患者,从而限制了RAAS-I在CKD患者当中的应用。
高钾血症是指血清钾浓度大于5.5 mmol/L的一种病理状态,血清钾浓度增高导致一系列心血管反应,如血压降低、心律失常,甚至心跳骤停等。研究证实,大部分高钾血症患者合并急性肾功能损伤或慢性肾功能衰竭,其病理机制是肾功能损害后,钾离子的排泄减少,血清钾浓度升高[7]。关于血清K+水平在CKD晚期(3~5期)患者中变化的横断面研究发现,531名晚期CKD患者随访至少1 a,血钾水平随CKD分期的增高而升高,提示肾功能恶化程度越高,其血钾水平越高,且CKD4、5期患者高钾血症的发生率为10%~20%[8]。对于摄入大量钾盐、使用抗醛固酮利尿剂、血管紧张素转化酶抑制剂和血管紧张素受体阻滞剂等药物患者亦多发高钾血症[9]。文献研究证实,长期服用ACEI/ARB药物患者高钾血症发生率高达20%~30%[10]。高钾血症严重威胁了 CKD患者的生命健康,在CKD任何一个分期中,血清钾浓度越高,死亡率就越高。临床治疗高钾血症的原则是控制病因,治疗原发病。降钾治疗方法包括传统静脉降钾疗法、透析治疗和口服阳离子树脂,后者在不增加体液负担和经济负担的基础上具有给药方便的优点。聚苯乙烯磺酸钙(可利美特)是常见的新型阳离子树脂,口服给药后不容易吸收,在肠道内钙钾离子交换,促使钾离子排出体外[11]。药物体外试验结果发现,1 g可利美特可置换53~71 mg钾离子,成人肾功能障碍患者1日使用15~30g本品,约使血清钾的水平下降1 mmol/L[12]。但关于聚苯乙烯磺酸钙对慢性肾脏疾病患者RAAS-I所致高钾血症的防治作用研究较少。
本研究结果发现,RAAS-I服药1个月后,24 h尿蛋白定量水平较服药前有明显下降,但血钾水平明显升高,其高血钾发生率为8.22%,提示高钾血症是RAAS-I较为严重的药物副作用。聚苯乙烯磺酸钙用药前,两组患者高血钾发生率和血钾水平比较,差异无统计学意义;经聚苯乙烯磺酸钙药物干预后,聚苯乙烯磺酸钙治疗患者给药后1、2、3、6、12个月血钾水平均明显低于常规治疗患者,明显优于对照组(P<0.05)。肾功能障碍患者往往都伴有水钠代谢紊乱、钙磷镁等电解质紊乱[13]。因此,在降钾的治疗过程中,不仅要求达到有效的降钾效果,且不应导致血清钠、钙、磷等电解质紊乱。有研究结果表明,聚苯乙烯磺酸钙在CKD合并高钾血症患者治疗中不会造成血清钠、磷、钙水平的明显波动[14]。与钠型树脂相比,聚苯乙烯磺酸钙是钙型树脂,适用于限制钠摄入量患者,不会导致高血钠性水肿、高血压或心力衰竭的发生和病情加重。
本研究中未出现与药物相关的严重不良事件,受试者对聚苯乙烯磺酸钙耐受良好,治疗过程中有6例患者出现便秘,经对症处理后症状均能缓解,无须终止治疗。2例患者发生轻度的低钾血症,血钾分别为3.45 mmol/L 和3.46 mmol/L,未做特殊处理,此后复查血钾恢复正常。
综上所述,RAAS-I具有延缓慢性肾脏病进展的作用,是肾脏病的重要治疗药物。但因其具有引发高钾血症的副作用,应用受到一定的限制,经聚苯乙烯磺酸钙的干预后,在不影响RAAS-I药物治疗的基础上能有效地降低高钾血症发生,且具有良好的安全性。故聚苯乙烯磺酸钙在RAAS-I治疗慢性肾脏疾病(CKD)所导致的高钾血症防治中具有重要作用。
[1]Zhang J,Wang F,Wang L,et al.Prevalence of chronic kidney disease in China:a cross-sectional survey[J].Lancet,2012,379(9818):815-822.
[2]刘必成,张训,林金秀,等.贝那普利降低我国糖尿病慢性肾脏疾病患者蛋白尿作用的荟萃分析[J].中国糖尿病杂志,2014,22(4):324-330.
[3]朱凌倜,周京敏.肾素-血管紧张素-醛固酮系统抑制剂的作用机制[J].上海医药,2013,23(17):3-5.
[4]陆再英,钟南山.内科学[M].第7版.北京:人民卫生出版社,2010:549.
[5]丁雄芳,陈江飞.环孢素与伏立康唑联合应用引起的高血钾症[J].中国临床药理学杂志,2012,28(2):146-147.
[6]张国华,侯凡凡,张训,等.血管紧张素转换酶抑制剂用于血清肌酐大于266 μmol/L的慢性肾脏病患者的研究[J].中华内科杂志,2005,44(8):592-596.
[7]Morishita Y, Kusano E.The effects of direct renin inhibitor,aliskiren,on arterial hypertension,chronic kidney disease and cardiovascular disease:optimal pharmacotherapy[J].Cardiovasc Hematol Agents Med Chem,2013,11(1):77-82.
[8]牛福坤,张路霞,邵凤民.蛋白尿在慢性肾脏病分期中的意义[J].中华肾脏病杂志,2011,27(6):372-375.
[9]Sayer G,Bhat G.The renin-angiotensin-aldosterone system and heart failure[J].Cardiol Clin,2014,32(1):21-32.
[10]章晓燕,於佳炜,刘春凤,等.血管紧张素转换酶抑制剂和血管紧张素Ⅱ受体拮抗剂单药治疗及联合应用对慢性肾脏病患者肾素-血管紧张素系统表达的影响[J].肾脏病与透析肾移植杂志,2012,21(3):217-223.
[11]Lizakowski S,Tylicki L,Rutkowski P,et al.Safety of enhanced renin-angiotensin-aldosteronesystem inhibition with aliskiren in nondiabetic patients with chronic kidney disease[J].Pol Arch Med Wewn,2013,123(5):221-227.
[12]Morishita Y,Kusano E.Direct renin inhibitor:aliskiren in chronic kidney disease[J].Nephrourol Mon,2013,5(1):668-672.
[13]Chen W J,Huang Y L,Shiue H S,et al.Renin-angiotensin-aldosterone system related gene polymorphisms and urinary total arsenic is related to chronic kidney disease[J].Toxicol Appl Pharmacol,2014,279(2):95-102.
[14]李晓,徐刚,林洪丽,等.聚苯乙烯磺酸钙治疗慢性肾脏病高钾血症患者的多中心临床研究[J].中华肾脏病杂志,2013,29(6):419-422.

