海洋来源真菌的抗肿瘤抗真菌活性筛选
陈修文 李长伟 贾国凯
(1. 湖南科技学院 生命科学与化学工程系,湖南 永州 425199;2. 军事医学科学院毒物药物研究所,北京 100850)
海洋来源真菌的抗肿瘤抗真菌活性筛选
陈修文1李长伟2贾国凯1
(1. 湖南科技学院 生命科学与化学工程系,湖南 永州 425199;2. 军事医学科学院毒物药物研究所,北京 100850)
目的:将深海来源的16株真菌经发酵培养与活性筛选,获取活性菌株以供筛选药源活性产物。分别经真菌普通培养基和人工海水培养基发酵获得样品,采用MTT法测试抗肿瘤活性,纸片法测试抗真菌活性。结果:菌株中有3株经过普通发酵培养基发酵和4株经过海水培养基发酵的样品在100 µg/mL浓度下对K562细胞的抑制率大于60%;抗真菌活性测试中,仅有菌株16-02-1的发酵样品对受试白色念珠菌ATCC 10231和土曲霉W-1均呈现一定的抑制活性。结论:深海来源真菌在不同培养基中发酵获得的样品,抗肿瘤活性各不相同,经过筛选获得高活性菌株为寻找药源活性产物提供了菌株。
深海来源真菌;抗肿瘤;抗真菌;MTT
海洋微生物包括海洋细菌、放线菌、真菌中发现了许多活性次级代谢物,其化学结构丰富多样、新颖独特,是陆地生物所不具有的[1]。这些活性次级代谢物大多具有很强的生理活性,包括抗肿瘤、抗病毒、抗菌、抗凝血、降压等,具有广阔的药用前景[2]。活性菌株资源是活性次级代谢产物研究的物质基础,而在生物活性筛选中大部分菌株并不表现出相应的生物活性而无法用于活性产物研究。本课题组在前期研究的基础上摸索建立了无活性野生菌株转化为活性突变株的技术方法,为拓展活性菌株资源提供了有效手段[3]。目前我们已通过相关技术手段对潮间带来源的无活性放线菌和真菌进行了相关研究[4-6],分离阐明了原始菌株不生产突变株新产的活性化合物[7],取得了较好成效。鉴于此,为了进一步证实相关技术手段的广泛适用性,我们对16株深海来源真菌进行了抗肿瘤活性筛选,一方面活性菌株可直接用于活性产物研究,而无活性菌株则可通过上述技术手段进行处理,使其转化为活性突变株进而用于活性产物研究[7-11]。
1 仪器、材料和试剂
1.1 仪器
1360 B型超净工作台(北京亚泰科隆公司),日本Sanyo公司生产的MIR-253型微生物培养箱、MLS-3750型高压灭菌器、MOV-212型干热灭菌箱、MCO175型细胞培养箱,ZHWY-2102大型恒温摇床(上海智城分析仪器制造有限公司),Labofuge 400R型离心机(德国贺力氏公司),VERSAmax-BN03152型酶标仪(美国 MD公司),AE31 EF-INV型倒置荧光显微镜(麦克奥迪公司),MILLI-Q纯水机(millipor公司)。
1.2 材料与试剂
真菌:大洋一号采集的海洋真菌包括ZBY-1(69.7386°E,24.175°S,水深200米处海水),ZBY-2(14°45'3"N,44°59'0"S,水深250米处海水),ZBY-3(174.2170°E,24.3444°S,水深800米处海水);深海 3000~4000m 采集的真菌包括3A03,3A09,3A11,3A17,3A22,3A23,3A24,3A25,海洋三所采集的深海真菌包括16-01,16-02-1,16-02-3,16-02-5,19-01。
真菌PDA培养基:葡萄糖 2%、琼脂 2%、NaCl 1.5%,20%的土豆水煮液配制。
真菌普通液体培养基(1#):葡萄糖 2%、麦芽糖 1%、甘露醇 2%、谷氨酸 1%、蛋白胨 0.5%、酵母浸粉 0.3%,蒸馏水1000 ml (pH 6.0)。
人工海水发酵培养基(2#):甘露醇 20%、麦芽糖 20%、葡萄糖 10%、味精 10%、KH2PO40.5%、MgSO4·5H2O 0.3%、酵母浸粉3%、玉米浆1%、海水素 33.4%、蒸馏水1000 ml。
细胞与细胞培养基:人白血病K562细胞(本研究所李松教授提供)、RPMI-1640培养基(美国 Gibco公司,Lot No.1403238)、胎牛血清(北京圣玛生物技术研究所)。
试剂:MTT试剂(美国Amresco公司,批号0793)、青霉素(华北制药股份有限公司产品,批号 070201))、链霉素(美国 Amresco 公司,批号0558)。其他试剂均为分析纯试剂。
2 实验方法
2.1 菌株的传代培养
16株深海真菌采用PDA培养基,挑取适量孢子在平板培养基上划线,28℃培养,每天观察菌落生长情况,待孢子生长成熟,用固体平板培养基反复划线传代3次后,接种于试管斜面培养基上,4℃冷藏并适时传代。
2.2 发酵培养与样品制备
将16株深海来源真菌在28℃活化培养3~5天后,刮取孢子适量,分别接种在两个各含200 mL普通液体培养基和200 mL海水液体培养基的500 mL三角烧瓶中,于28°C、200 rpm摇床发酵9~10天。另取各真菌孢子适量,分别接种在含25 mL普通液体培养基的80 mL试管中,于28°C、210 rpm摇床发酵11~15天。根据各菌株生长状况适时终止培养,下摇床得发酵液。发酵液中加体积比2倍量的丙酮,超声破碎菌体,离心取上清液,减压浓缩至不含丙酮,冷冻干燥,得各菌株的发酵提取样品。精密称量适量样品,用80%的甲醇配成10 mg/mL的样品溶液,供抗肿瘤活性测试。
2.3 抗肿瘤活性测试
MTT法[7,9]抗肿瘤活性测试 取对数生长期的K562细胞,用新鲜RPMI-1640培养基配成细胞密度为1×105个/mL的细胞悬液,接种于96孔板中,每孔200 µL,37℃培养1 h后每孔加样品溶液2 µL,继续培养24 h。培养结束后在光学显微镜下观察细胞形态变化,判断有无细胞凋亡或细胞坏死的形态特征,必要时拍照。各加入MTT 20 µL,37℃孵育4 h。处理结束后于4℃、2000 rpm条件下离心20 min,吸去上清液,每孔各加150 µL DMSO,置酶标仪上充分振荡使MTT紫色产物完全溶解,测量每孔570 nm处的OD值。实验中全部测试样品均设三个孔,取OD平均值,以空白对照组为100%按下式计算抑制率(IR%):IR% = (OD空白-OD样品)/OD空白×100%。
2.4 抗真菌活性测试
采用8 mm纸片法[12],以5 mg·mL-1制霉菌素为阳性对照,测定各菌株发酵物萃取样品对致病菌的抑制活性。分别吸取菌悬液100 μL均匀涂布于PDA平皿上,制备被试菌平板。再取对照和样品溶液各15 μL吸附于已经干法灭菌(170 ºC,2 h)后的滤纸片,将该滤纸片贴于涂有致病菌的PDA培养基上,28 ºC培养3~5天,若有活性则其周围不会有菌落生长,即形成抑菌圈。根据抑菌圈直径判断样品的抑菌活性强弱。
3 结果
3.1 抗肿瘤测试结果
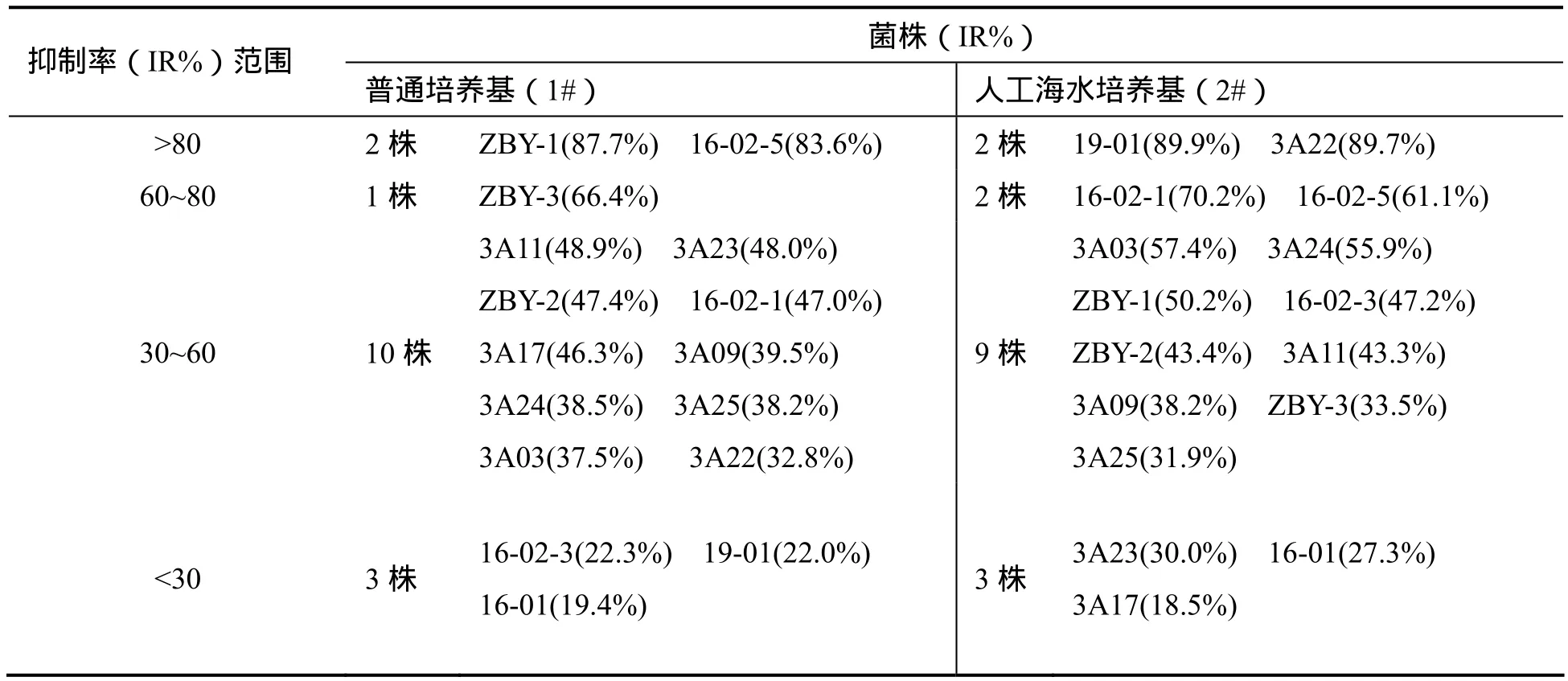
表 1 深海来源真菌野生发酵样品100 µg·mL-1对K562细胞的抑制活性测试结果
3.2 抗真菌测试结果
1#和 2#发酵样品对白色念珠菌的活性测试中,发现仅菌株16-02-1发酵样品对受试白色念珠菌ATCC 10231和土曲霉W-1呈现一定的抑制活性, 1500 µg/片普通培养基发酵样品对ATCC 10231和W-1的抑菌圈分别为21 mm(与15µg/片的制霉素相当)和14 mm,但同剂量的海水培养基发酵样品对ATCC 10231的抑菌圈直径仅为16 mm,而对W-1则未显示出明显抑制作用。
4 讨论
16株深海来源真菌的普通培养基与人工海水培养基发酵样品对K562细胞的抑制活性显示较为显著的差别(结果见表 1),其中普通培养基发酵呈现高活性的部分菌株(如ZBY-1和16-02-5,其IR%分别为87.7%和83.6%)在用海水培养发酵时只呈现中等强度抗肿瘤活性(IR%分别降至50.2%和61.1%);而用海水培养基发酵时呈现高活性的部分菌株(如19-01和3A22,其IR%分别为89.8%和89.7%)在改用普通培养基发酵时则只呈现较低抗肿瘤活性(IR%降至22.0%和32.8%)。抗真菌活性测试中,菌株16-02-1的1#和2#发酵样品对受试白色念珠菌 ATCC 10231和土曲霉 W-1均呈现一定的抑制活性,但是二者所呈现的抑菌活性强度也具有较大差别。
上述结果提示,在深海真菌菌株活性筛选过程中培养基不同会导致其发酵产物活性产生较大差别,且大多菌株在经多次传代和不同批次发酵后,所得样品生物活性波动较大,与陆地或普通海域来源真菌相比,次级代谢相关遗传稳定性比较差,但同时也筛选获得了活性测试结果比较稳定的强活性菌株和无活性菌株。其中部分无活性菌株可供开展上述次级代谢改造相关研究,而包括16-02-1在内的部分活性菌株则可用于直接开展活性产物研究。
[1]Carte B K. Biomedical potential of marine nat ural products [J].Bioscience,1996, (4) : 2712286.
[2]任虹,崔承彬.海洋微生物抗肿瘤活性产物研究进展[J].中国海洋大学学报,40 (5) :057-063.
[3]崔承彬,拓展微生物药源活性新菌株资源的新方法探索[J].国际药学研究杂志,2010(1):1-7.
[4]吴长景,崔承彬,田从魁,等.无活性真菌野生株G59的抗肿瘤活性突变株筛选与突变株新产活性产物研究 [5][C].第十届中国海洋药物学术研讨会论文集上册,青岛:2009, 210-216.
[6]卜秀嫣,崔承彬, 李长伟.产紫青霉G59的超声诱变活性突变株新产抗肿瘤活性产物[J].军事医学科学院院刊,2010, (5): 423-474.
[7]Han XX, Cui CB, Gu QQ,et al. ZHD-0501, a novel naturally accruing staurosporine analog fromActinomadurasp. 007 [J].Tetrahed Lett, 2005, (36): 6137-6140.
[8]Fang S M, Cui C B, Li C W, et al. Purpurogemutantin and purpurogemutantidin, new drimenyl cyclohexenone derivatives produced by a mutant obtained penicillium purpurogenum G59 [J]. Marine drugs, 2012, (6): 1266-1287.
[9]田从魁,崔承彬,赵卫权,等.2株无抗肿瘤活性放线菌野生株的抗生素抗性突变株及其抗肿瘤活性筛选[J].中国海洋大学学报,2010, (5) :043-046.
[10]Chai Y J, Cui C B, Li C W, et al. Activation of the dormant secondary metabolite production by introducing gentamicin-resistance in a marine-derived Penicillium purpurogenum G59 [J]. Mar Drugs, 2012, (3): 559-582.
[11]张志军,崔承彬,李长伟.对海洋来源放线菌无活性野生株HLF-43的微波诱变结合新霉素抗性与抗肿瘤活性组合筛选[J].中国海洋大学学报,2010,(5): 033-037.
[12]于志彬,朱天骄,崔承彬,等.用核糖体工程技术二次开发海洋微生物菌株资源的研究[J].高技术通讯,2006,(11): 1190-1194.
[13]Barry A L, Coyle M B, Thornsberry C, et al. Methods of measuring zones of inhibition with the Bauer-Kirby disk susceptibility test [J]. J Clin Microbiol, 1979, (6): 885.
Antitumor and antifungal activities screening of deep sea sediment derived fungi
CHEN Xiu-wen1,2, LI Chang-wei2, JIA Guo-kai1
(1.Department of Biology and Chemistry, Hunan University of Science and Engineering, Yongzhou Hunan 425199, China; 2. Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Beijing 100850, China)
Abstrat: Objective:To investigate metabolites of sixteen strains isolated from a deep sea sediment for obtaining the bioactive metabolite producing strains. Methods:Sixteen fungi were fermented with ordinary medium and artificial seawater medium. Antitumor and antifungal activities were tested by MTT and paper-disc methods, respectively. Results There are 3 fungal strains fermented by ordinary medium among them inhibited the proliferation of K562 cells with the inhibition rates over 50% at the 100 µg/mL of concentration, samples from 5 fungal strains fermented by artificial seawater inhibited the proliferation of K562 cells with the inhibition rates over 40% at the 100µg/mL of concentration, only Strain 16-02-1 revealed both antitumor and antifungal activities. Conclusions:The results indicated that the production have different inhibitive femented in different medium, and obtain strains with high activity source for finding the active drug product provides strain.
fungus from deep sea sediment; antitumor; antifungal; MTT
Q5-3
A
1673-2219(2014)05-0080-03
2014-01-05
国家自然科学基金(81172976)资助。
陈修文(1987-),男,湖南永州人,湖南科技学院助教,硕士,研究方向为天然药物开发。
(责任编校:何俊华)

