姜黄素对自发性高血压大鼠脑缺血/再灌注后海马神经元损伤及RANTES表达的影响*
俞陈陈,胡 涵,汪小丹,曹 红,姬 斌,李 军
(温州医科大学附属第二医院麻醉科,浙江温州325027)
高血压是引起缺血性脑病的主要危险因素,缺血性脑病是危害人类健康的三大疾病之一,而溶栓之后可引起严重的再灌注损伤。有研究表明,调解活化正常T细胞表达和分泌的趋化因子(regulatedupon activation normal T-cell expressed and secreted,RANTES)是介导脑缺血/再灌注损伤炎症反应的重要因素之一[1]。目前静脉用组织纤维蛋白溶酶原激活剂(tPA)是美国FDA唯一批准用于治疗急性缺血性脑卒中的药物,tPA在脑卒中发生3 h内给予发挥最佳效果,仅有4%的脑缺血患者受益于此[2]。姜黄素是由姜黄中提取的有效成分,具有抗炎、抗肿瘤、抗氧化等多种生物学作用。有研究表明,姜黄素可通过抑制RANTES表达减轻星形胶质细胞介导的急性脊髓损伤,姜黄素的抗炎效应可用于治疗各种神经炎症和神经退行性疾病,包括急性脊髓损伤后的创伤性炎症[3]。本研究探讨自发性高血压大鼠(spontaneously hypertensive rats,SHR)在全脑缺血/再灌注后海马神经元损伤和RANTES在海马CA1区的动态变化,及姜黄素对SHR缺血性神经元损伤的保护作用与抑制RANTES蛋白表达的关系。
1 材料与方法
1.1 主要试剂及仪器
HE染色盒购自北京索莱宝科技有限公司,Nissl染色盒购自碧云天生物技术研究所,大鼠趋化因子(RANTES)ELISA试剂盒购自上海西唐生物科技有限公司,姜黄素购自美国Sigma公司,用玉米油配置成20mg/ml贮存液,避光于 4℃冰箱保存,Olympus Cx21倒置显微镜购自日本Nikon公司,Multiskan Mk3酶标仪购自美国Thermo公司。
1.2 动物分组
与雄性WKY大鼠同源的 SHR 90只和雄性WKY大鼠60只,SPF级,8周龄,体重(180~200)g,由北京维通利华实验动物技术有限公司(许可证编号:SCXK(京)2012-0001)提供,在 22~25℃实验室中饲养7 d以适应实验室环境。SH标准:安静状态下尾动脉收缩压>160 mmHg。采用随机数字表法,将WKY大鼠随机分为2组(n=30):假手术组(WSham组)、缺血/再灌注组(W-I/R组),将 SHR随机分为3组(n=30):假手术组(S-Sham组)、缺血/再灌注组(S-I/R组)、姜黄素组(S-Cur组)。以上各组再根据再灌注时间,分为 3 h、12 h、1 d、3 d和 7 d五个亚组。各组处理:W-Sham组和S-Sham组仅分离双侧颈总动脉但不夹闭;S-Cur组于再灌注30min时腹腔注射姜黄素100mg/kg(本课题组前期实验结果表明,100mg/kg剂量的保护作用优于 30 mg/kg和300mg/kg):其他组别于再灌注30 min时腹腔注射等容积玉米油。
1.3 模型制备
大鼠全脑缺血/再灌注模型的制备参照文献[4]介绍的四血管阻断法制备全脑缺血/再灌注模型。腹腔注射1%戊巴比妥钠40 mg/kg麻醉下,双极电凝器电凝双侧椎动脉,并分离双侧颈总动脉,穿线备用,24 h后于清醒状态下应用无创微动脉夹夹闭双侧颈总动脉(阻断椎动脉后若即刻夹闭双侧颈动脉实施缺血/再灌注,大鼠死亡率高,模型成功率非常低),使全脑缺血10 min,然后恢复灌注。脑缺血时维持大鼠直肠温36.5~37.5℃。以缺血动物60 s内发生翻正反射消失、四肢僵直、眼球苍白、瞳孔散大等为脑缺血成功的标准,不合标准者剔除。
1.4 行为学观察
再灌注后7 d用跳台试验观察大鼠学习记忆能力。跳台装置为30 cm×30 cm×40 cm的被动回避反应箱,箱底铺直径1 mm铜栅,通36 V交流电,箱壁由黑色塑料板围成,铜栅的一角固定5 cm×5 cm×5 cm大小的塑料泡沫块作为动物回避电击反应的安全区。先将大鼠放入箱中训练5min,并记录首次找到安全区所需的时间(反应时间)和5 min内受到的电击次数(错误次数),作为学习成绩。24 h后重复上述实验,记录第1次跳下安全区的时间(潜伏期)和错误次数,作为记忆成绩。实验在安静房间内进行。整个实验过程中保持室内灯光等周围环境条件的一致。所有行为学观察由同一组实验员完成。
1.5 组织学切片
于再灌注 3 h、12 h、1 d、3 d和 7 d时将大鼠麻醉,开胸经升主动脉插管,依次灌注生理盐水150 ml和4%多聚甲醛溶液150 ml,断头取脑,在视交叉后1mm和4mm处冠状面切开,取中间脑组织置于同一多聚甲醛溶液中固定1 d,再置于10%福尔马林溶液中固定1 d,石蜡包埋。在大鼠脑冠状切面海马水平连续冠状切片,片厚4μm。
1.6 HE染色观察锥体细胞形态
切片常规脱蜡至水,苏木素初染,伊红复染,脱水、透明、中性树胶封片,观察海马CA1区锥体细胞的形态。
1.7 Nissl染色计数平均锥体细胞密度
切片常规脱蜡至水,甲苯胺蓝染色,脱水、透明、中性树胶封片,高倍镜下计数海马CAl区每mm区段内正常锥体细胞数目(胞膜皱缩、尼氏体消失者剔除),即锥体细胞密度。双侧海马锥体细胞密度取平均值为平均锥体细胞密度[5]。各组平均锥体细胞密度以均数 ±标准差(¯x±s)表示。
1.8 ELISA法测定海马RANTES蛋白表达水平
于再灌注3 h、12 h、1 d、3 d和 7 d时取 3只大鼠,断头取脑,快速分离海马,加适量细胞裂解液进行低温匀浆,提取总蛋白并根据BCA法测定样本蛋白浓度后备用。采用ELISA法测定RANTES浓度,按照RANTES-ELISA试剂盒说明书进行测定。采用酶标仪测定450 nm处吸光度值,根据标准曲线计算实际浓度。根据稀释倍数和组织的总蛋白浓度计算出单位质量海马组织中RANTES的质量,以pg/mg表示。
1.9 统计学处理
所有计量数据均以均值±标准差(¯x±s)表示,采用SPSS 19.0统计软件分析,组间比较采用单因素方差分析,组内差异采用随机区组资料设计。
2 结果
2.1 姜黄素对大鼠行为学的影响
W-Sham组和S-Sham组大鼠学习、记忆成绩无差别。S-I/R组大鼠学习成绩和记忆成绩较W-I/R组有显著下降(P<0.05)。缺血/再灌注后,S-I/R组大鼠学习成绩和记忆成绩较S-Sham组大鼠明显下降(P<0.05)。S-Cur组大鼠学习成绩和记忆成绩与 S-I/R组大鼠比较有所改善(P<0.05,表 1)。
2.2 姜黄素对海马锥体细胞形态的影响
光镜下可见W-Sham组和S-Sham组大鼠海马各区锥体细胞排列整齐、密集,胞体呈锥体形,边界清楚;细胞核大,呈圆形或椭圆形,核膜清晰,核仁明显。W-I/R组和S-I/R组大鼠海马CA1区锥体细胞排列稀疏,胞质嗜伊红染,核固缩深染,S-I/R组损伤更严重。再灌注后1 d、3 d、7 d海马CA1区锥体细胞数目减少,排列散乱,凋亡小体形成,部分细胞核呈碎片状。S-Cur各组大鼠锥体细胞轮廓尚清,核形状规则(图1见彩图页Ⅱ)。

Tab.1 Comparison of learning andmemory ability among different groups(¯x±s,n=6)
2.3 姜黄素对海马锥体细胞密度的影响
与W-Sham组大鼠比较,W-I/R组大鼠于再灌注后1 d,3 d,7 d时间点海马CA1区锥体细胞密度减少(P<0.05);与 S-Sham组大鼠比较,S-I/R组大鼠于再灌注后12 h,1 d,3 d,7 d时间点海马 CA1区锥体细胞密度减少(P<0.05);S-Sham组和 S-Cur组大鼠锥体细胞密度无差别;与S-I/R组大鼠比较,SCur组大鼠于再灌注后1 d,3 d,7d时间点海马CA1区锥体细胞密度增加(P<0.05,表 2)。
2.4 姜黄素对海马RANTES表达的影响
与W-Sham组大鼠比较,W-I/R组大鼠于再灌注后12 h,1 d时间点海马RANTES蛋白表达上调(P<0.05,表3),S-Sham组大鼠再灌注后海马 RANTES蛋白表达无统计学差异(P>0.05);与 W-I/R组和S-Sham组大鼠比较,S-I/R组大鼠分别于再灌注后3 h,12 h,1 d和 3 h,12 h,1 d,3 d,7 d时间点海马RANTES蛋白表达上调(P<0.05);与 S-I/R组大鼠比较,S-Cur组大鼠于再灌注后 12 h,1 d,3 d,7 d时间点海马 RANTES蛋白表达下调(P<0.05);S-I/R组大鼠海马RANTES蛋白在再灌注后3 h可见表达升高,于1 d达高峰,随后逐渐下降至7 d。
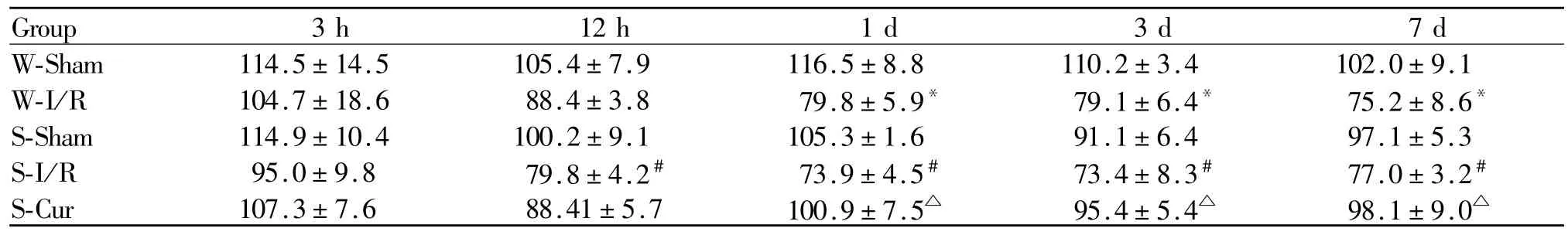
Tab.2 Comparison of density of vertebral cell in hippocampal CA1 region at different time pointafter reperfusion(cells/mm,¯x±s,n=3)
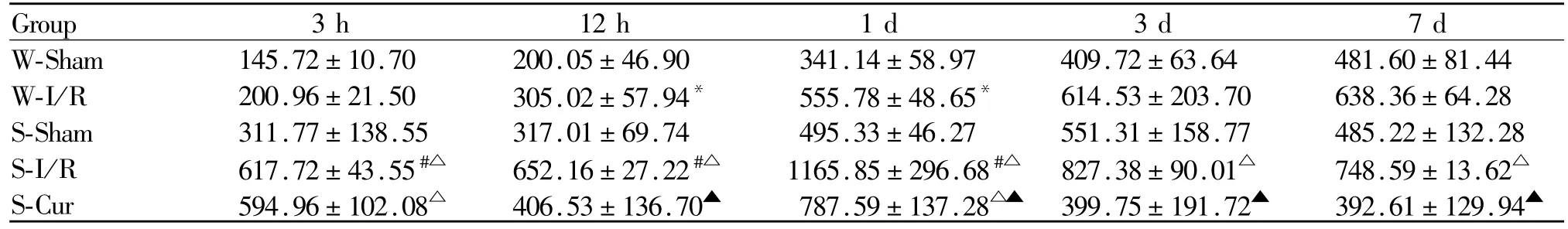
Tab.3 Comparison of expression of RANTES in hippocampal of different group at different time point after reperfusion(pg/mg,¯x±s,n=3)
3 讨论
本实验采用全脑缺血/再灌注(I/R)模型,研究各组WKY大鼠、SHR在各再灌注时间点海马CA1区神经元损伤和RANTES表达的变化及再灌注后7 d学习、记忆能力。WKY大鼠和SHR在脑I/R后海马CA1区神经元损伤加重,RANTES蛋白表达上调,再灌注后7 d学习和记忆能力下降。与WKY大鼠相比,SHR在脑I/R后海马CA1区锥体细胞损伤加重,RANTES蛋白表达上调,再灌注后7 d学习和记忆能力下降。本实验表明再灌注后30 min腹腔注射100mg/kg姜黄素能减轻I/R后SHR海马CA1区椎体细胞损伤,抑制RANTES蛋白表达,改善学习和记忆能力。但本研究结果为该课题组的初步成果,有待以后增加样品量进行深入研究。
高血压是一种慢性炎症反应[6]。在高血压的情况下,血管周围脂肪组织RANTES蛋白表达上调[7]。在长期高血压的情况下,中枢神经系统结构和功能会发生改变[8]。自发性高血压大鼠随着年龄增长,海马CA1区和齿状回区容积及神经元数目逐渐减少,星形胶质细胞逐渐增多[9]。我们前期研究表明自发性高血压大鼠脑I/R后海马CA1区损伤程度明显重于正常血压大鼠,学习和记忆能力也显著下降[10-11]。RANTES是趋化因子CC亚家族中的一员,由91个氨基酸组成,CCR5属于G蛋白偶联受体超家族,是RANTES的受体。RANTES介导的炎症反应可能是引起脑I/R神经元损伤的机制之一[1]。缺血缺氧、应激、创伤等都可引起脑缺血损伤,使小胶质细胞产生神经毒性物质氧化亚氮、自由基和各种细胞因子(IL-1、IL-6和 TNF-α等),激活星形胶质细胞表达RANTES,RANTES与炎症细胞(白细胞、巨噬细胞等)表面 CCR5结合,通过激活 PI-3K而使 Akt/PKB表达,使炎症细胞粘附并趋化,RANTES与CCR5结合还可促使细胞内钙离子释放并与DAG结合,激活ERK1/2表达引起炎症细胞增殖,加重脑损伤[12,13]。Terao等[1]研究表明,RANTES基因敲除小鼠大脑中动脉 I/R模型中,IL-6、IL-10和IL-12表达减少,脑梗死面积缩小,血脑屏障功能得到改善。本实验表明,WKY大鼠和 SHR在脑 I/R后海马 CA1区神经元损伤加重,RANTES蛋白表达上调,再灌注后7 d学习和记忆能力下降,提示RANTES可能参与脑I/R损伤。与WKY大鼠相比,SHR全脑I/R后海马CA1区神经元损伤增加,RANTES蛋白表达上调,提示高血压情况下可能更易发生RANTES介导的脑缺血性损伤。
姜黄素是从姜科姜黄属植物姜黄根茎中提取的一种酚性色素,对姜黄素的分子药理学研究表明,姜黄素具有多方面药理作用,如抗炎、抗氧化、清除自由基、抗肿瘤等作用。姜黄素可减少肾缺血损伤时RANTES蛋白的过度表达[14],也可明显抑制急性脊髓损伤时星形胶质细胞 RANTES表达[3]。曹红[15]等人研究表明,姜黄素可显著减少沙土鼠I/R后海马CA1区凋亡锥体细胞数量,诱导Fos蛋白及抑制NF-kB蛋白的表达。前期研究表明姜黄素可通过凋亡通路抑制海马c-jun、c-fos和JNK3等蛋白表达减轻 SHR脑 I/R损伤[10,16]。姜黄素是否能通过抑制SHR脑I/R损伤炎症反应影响海马RANTES的表达鲜有报道。本实验发现,给予100 mg/kg姜黄素能显著减少I/R后SHR海马CA1区损伤的神经元,同时明显抑制RANTES的表达。提示姜黄素可能通过抑制RANTES的表达,对SHR脑I/R损伤发挥神经保护效应。
综上所述,I/R更易导致SHR海马神经元损伤。姜黄素减轻SHR脑I/R海马神经元损伤,其机制可能与抑制RANTES蛋白的表达有关。
[1] Terao S,Yilmaz G,Stokes KY,et al.Blood cell-derived RANTES mediates cerebral microvascular dysfunction,inflammation,and tissue injury after focal ischemia-reperfusion[J].Stroke,2008,39(9):2560-2570.
[2] Park JS,Gamboni-Robertson F,He Q,et al.Highmobility group box 1 protein interactswithmultiple Toll-like receptors[J].Am JPhysiol Cell Physiol,2006,290(3):C917-924.
[3] Lin MS,Sun YY,ChiuWT,et al.Curcumin attenuates the expression and secretion of RANTES after spinal cord injury in vivo and lipopolysaccharide-induced astrocyte reactivation in vitro[J].JNeurotrauma,2011,28(7):1259-1269.
[4] PulsinelliWA,Brierley JB.A new model of bilateral hemispheric ischemia in the unanesthetized rat[J].Stroke,1979,10(3):267-272.
[5] Kirino T,Tamura A,Sano K.A reversible type of neuronal injury following ischemia in the gerbil hippocampus[J].Stroke,198617(3):455-45.
[6] Savoia C,Schiffrin EL.Inflammation in hypertension[J].Curr Opin Nephrol Hypertens,2006,15(2):152-158.
[7] Harrison DG,Guzik TJ,Lob HE,et al.Inflammation,immunity,and hypertension[J].Hypertension,2011,57(2):132-140.
[8] Endres M,Heuschmann PU,Laufs U,et al.Primary prevention of stroke:blood pressure,lipids,and heart failure[J].Eur Heart J,2011,32(5):545-552.
[9] Mignini F,Vitaioli L,SabbatiniM,et al.The cerebral cortex of spontaneously hypertensive rats:a quantitative microanatomical study[J].Clin Exp Hypertens,2004,26(4):287-303.
[10]陈春茹,郭慧娟,欧国昆,等.姜黄素对自发性高血压大鼠脑缺血再灌注时海马神经元凋亡及c-jun氨基末端激酶3和突触后密度蛋白95表达的影响[J].中华麻醉学杂志,2011,31(2):230-233.
[11]姬 斌,叶克平,曹 红,等.脑缺血再灌注对自发性高血压大鼠认知功能及海马神经元凋亡的影响[J].中华麻醉学杂志,2008,28(11):1029-1031.
[12] Minami M,Katayama T,Satoh M.Brain cytokines and chemokines:roles in ischemic injury and pain[J].J Pharmacol Sci,2006,100(5):461-470.
[13]Cartier L,Hartley O,Dubois-Dauphin M,et al.Chemokine receptors in the central nervous system:role in brain inflammation and neurodegenerative diseases[J].Brain Res Brain Res Rev,2005,48(1):16-42.
[14]Aggarwal BB,Harikumar KB.Potential therapeutic effects of curcumin,the anti-inflammatory agent,against neurodegenerative,cardiovascular,pulmonary,metabolic,autoimmune and neoplastic diseases[J].Int JBiochem Cell Biol,2009,41(1):40-59.
[15]曹 红,李 军,李广明,等.姜黄素对沙土鼠脑缺血/再灌注损伤的海马CAl区细胞凋亡和即早基因c-fos、c-jun、NF-κB表达变化的关系[J].中国应用生理学杂志,2007,23(2):184-188.
[16]叶克平,陈春茹,郑晋伟,等.姜黄素对自发性高血压大鼠海马缺血/再灌注损伤神经元凋亡核通路的影响[J].中国应用生理学杂志,2010,26(4):416-423.

