甲基橙碱度测定滴定终点颜色判断探讨
杨秀莲
(攀钢能动中心,四川攀枝花617062)
甲基橙碱度测定滴定终点颜色判断探讨
杨秀莲
(攀钢能动中心,四川攀枝花617062)
碱度是一种水的综合性指标,检测方法一般采用滴定分析,其方法虽然简单,但是滴定终点颜色的判断,对其测定结果至关重要。依据理论进行实验,将到达终点颜色的滴定样品测定pH值,得出判断滴定终点的颜色标准,并用于日常的检测分析,使测定结果能有效指导生产。
甲基橙碱度;颜色;滴定终点;pH值
1 前言
碱度表征的是溶液和酸反应的能力,通常用水中所含能与强酸定量作用的物质总量来表示。水中碱度的产生主要是由于碳酸盐、重碳酸盐及氢氧化物的存在,但在特殊情况下硼酸盐、磷酸盐和硅酸盐也会产生一定碱度。废水及其他复杂体系的水体中,还含有有机碱类、金属水解性盐类等,均为碱度组成部分。在这些情况下,碱度就成为一种水的综合性指标,代表能被强酸滴定的物质总和。自然水体碱度通常是由于碳酸盐、碳酸氢盐及氢氧离子造成的,因此总碱度一般可以表示成这些成分浓度的函数。碱度指标常用于评价水体的缓冲能力及金属在其中的溶解性和毒性,是对新水和废水处理过程控制的判断性指标。若碱度是由过量的碱金属盐类所形成,则碱度又是确定这种水是否适宜于灌溉的重要依据。
碱度的测定值因使用的指示剂终点pH值不同而有很大的差异,只有当试样中的化学组成已知时,才能解释为具体的物质。对于天然水和未污染的地表水,可直接以酸滴定至pH为8.3时消耗的量确定为酚酞碱度;以酸滴定至pH为3.1耀4.4时消耗的量确定为甲基橙碱度,通过计算,可求出相应的碳酸盐、重碳酸盐和氢氧根离子的含量。对于废水、以及被污染的水,则由于组分复杂,这种计算无实际意义,往往需要根据水中物质的组分确定其与酸作用达到终点时的pH值,然后,用酸滴定以便获得所需参数,并作出解释。
我公司日常所测定的水样一般为金沙江原水、新水和间接循环冷却水,就碱度项目测定而言污染较小,其水体碱度组成视为主要是重碳酸盐、碳酸盐及氢氧化物。因此,通过测定水样碱度可直接计算其组成成分,为攀钢各工序水处理提供水质基础参数。
2 碱度测定方法
用标准酸滴定水中碱度是各种方法的基础。目前常用的有两种方法,即电位滴定法和酸碱指示剂滴定法,两种方法均可根据需要和现场条件选用。以酚酞做指示剂,由红色变为无色时,溶液pH值为8.3,此时的滴定结果称为“酚酞碱度”,被测溶液中氢氧根以及一半的碳酸根已经反应;以甲基橙做指示剂,由黄色变为红色时,溶液的pH值为3.1耀4.4,此时的滴定结果称为“总碱度”或“甲基橙碱度”,这时碳酸氢根已经全部转化为碳酸或游离二氧化碳。两种碱度滴定过程的化学方程式如下:
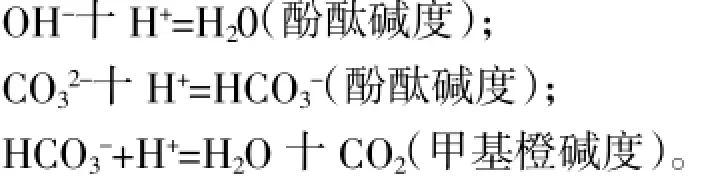
2.1 电位滴定法
电位滴定法根据电位滴定曲线在终点时的突跃,确定特定pH值下的碱度,它不受水样浊度、色度的影响,适用范围较广,但现场需要电源。
原理:用玻璃电极为指示电极,甘汞电极为参比电极,用酸标准溶液滴定其终点通过pH计或电位滴定仪指示,以pH8.3表示水样中氢氧化物被中和及碳酸盐转为重碳酸盐时的终点,与酚酞指示剂刚刚褪色时的pH值相当;以pH3.1耀4.4表示水中重碳酸盐(包括原有重碳酸盐和由碳酸盐转成的重碳酸盐)被中和的终点与甲基橙刚刚变为橙红色时的pH值相当。电位滴定法可以绘制成滴定时pH值对酸标准滴定液用量的滴定曲线,然后计算出相应组分的含量或直接滴定到指定的终点。
步骤:分取100 mL水样置于200 mL高型烧杯中,用硫酸标准溶液滴定,当滴定到pH8.3时到达第一个突跃终点,即酚酞指示的终点,记录硫酸标准溶液消耗量,继续用硫酸标准溶液滴定至pH值达3.1耀4.4时到达第二个突跃终点即甲基橙指示的终点记录硫酸标准溶液用量。
2.2 酸碱指示剂法
用酸碱指示剂判断滴定终点的方法简便快速,适用于控制性试验及例行分析,并且不受场地和电源条件限制。目前我们主要采用此方法。
原理:水样用酸标准溶液滴定至规定的pH值,其终点由加入的酸碱指示剂在该pH值时颜色的变化来判断。当滴定至酚酞指示剂由红色变为无色时,溶液pH值即为8.3,指示水中氢氧根离子已被中和,碳酸盐均被转为重碳酸盐;当滴定至甲基橙指示剂由黄色变成橙红色时,溶液的pH值为3.1耀4.4,指示水中的重碳酸盐(包括原有的和由碳酸盐转化成的)已被中和。根据上述两个终点到达时所消耗的酸标准滴定溶液的量,可以计算出水中碳酸盐、重碳酸盐及总碱度。
步骤:分取100 m L水样置于250 mL三角瓶中,加入2滴酚酞指示剂,用硫酸标准溶液滴定,当滴定到溶液由红色变为无色时到达第一个终点,即酚酞指示的终点,记录硫酸标准溶液消耗量,再加入3滴甲基橙指示剂,继续用硫酸标准溶液滴定至溶液由黄色变为橙红色时到达第二个终点,甲基橙指示的终点记录硫酸标准溶液用量。
3 指示剂法存在问题
酸碱滴定中因酚酞指示剂是无色的二元弱酸,当滴定到终点时由碱式型转变成共轭酸性,溶液由红色到无色,颜色变化较大,终点容易判断,结果误差自然就较小;而甲基橙碱度滴定终点颜色是由黄色变成红色,颜色变化范围较小,再加上人眼对颜色判断的个体差异,终点判断误差相对较大,结果偏差大。
因甲基橙理论变色点pKHIN=3.4,pH在pKHIN-1以下时,观察到的是指示剂的酸式色,即红色,pH在pKHIN+1以上时,观察到的是碱式色,即黄色,所以其理论变色范围应为2.4耀4.4,而实测变色范围是3.1耀4.4,表明甲基橙要由红色变成黄色,碱式色的浓度应是酸式色浓度的10倍;而酸式色的浓度只要大于碱式色浓度的2倍,就能观察出酸式色(红色),这是由于人眼对红色较之对黄色更为敏感的缘故。所以甲基橙的变色范围在pH值小的一端就要短一些,基于此原因我们在滴定过程中终点颜色的判断就会出现较大的偏差,所判断滴定终点颜色的pH值偏高,致使结果偏低。为此,我们进行了系列实验,将日常分析的甲基橙碱度滴定所判断的终点颜色用酸度计测定其pH值,并将比对情况统计见表1。
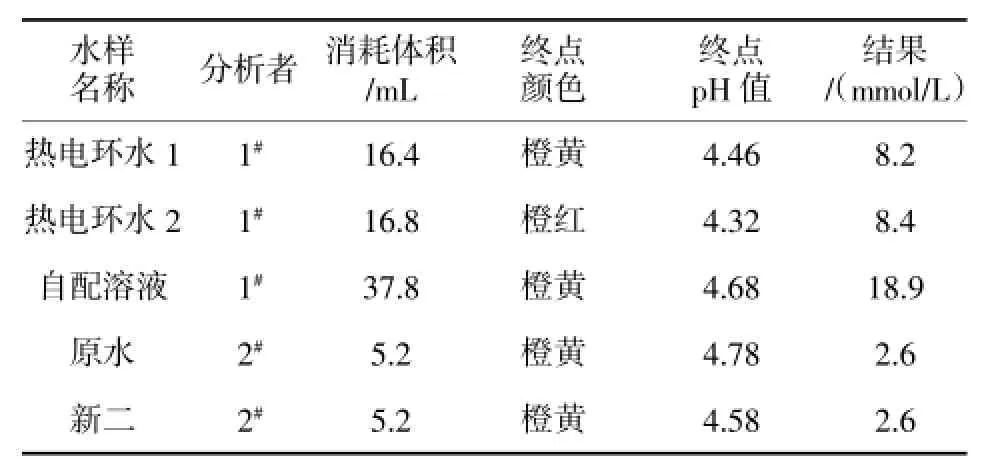
表1 终点颜色与pH值比对表
表1可以看出测定的5个水样,其中只有热电环水2的滴定终点在要求的pH范围内,即终点水样呈橙红色。而日常分析中我们判断的终点颜色均为橙黄色,即终点提前了,滴定消耗体积偏小,结果普遍偏低。
4 方法探讨
针对存在的问题,我们开展了甲基橙碱度测定终点颜色判断探讨活动,具体方案如下:
4.1 用基准试剂碳酸钠配制浓度为18.00 mmol/L的碱度标准溶液,配制0.05%的甲基橙指示剂以及浓度为0.05 mol/L的硫酸标准溶液;
4.2 分别取100 m L碳酸标准溶液6组置于250 mL三角瓶中,加入3滴甲基橙指示剂,溶液呈黄色,用硫酸标准溶液滴定,分别记录不同滴定终点颜色时的各种参数;
4.3 将标准溶液不同滴定终点颜色的溶液用酸度计分别测定其pH值,结果统计见表2。
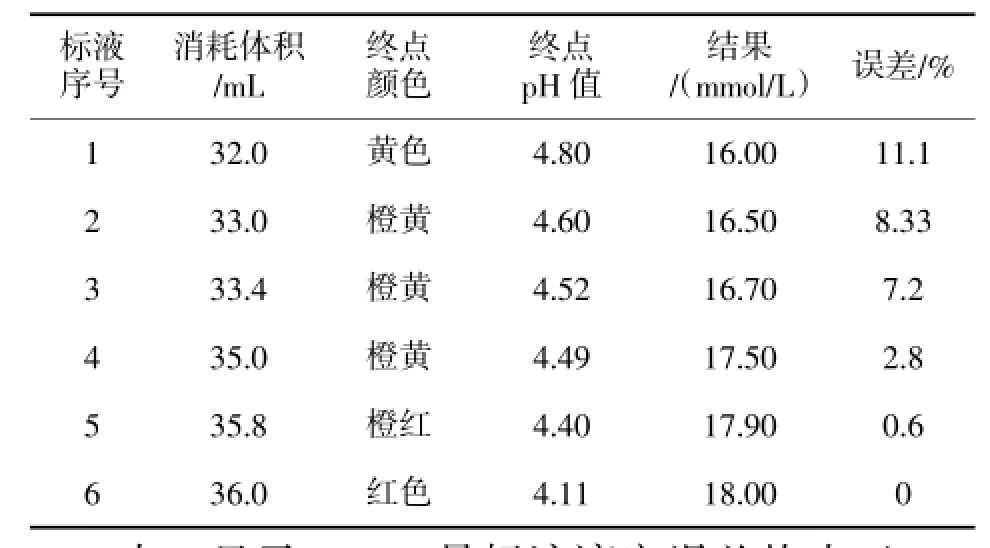
表2 标准溶液滴定终点颜色与pH值比对表
表2显示4、5、6号标液滴定误差均小于5%,已在滴定误差允许的范围内,但是4号的滴定终点pH值为4.49,仍偏高于理论范围。虽然6号没有滴定误差,但终点颜色已是红色,若要将此颜色定为终点颜色,日常分析中可能会造成终点判断滞后,结果偏高。结合表1和表2的实验结果我们认为5号结果比较符合要求,既满足误差要求,又能使终点颜色易于判断,即终点颜色为橙红色,pH值4.4左右。
根据以上实验结果我们对此条件进行校验,结果见表3。
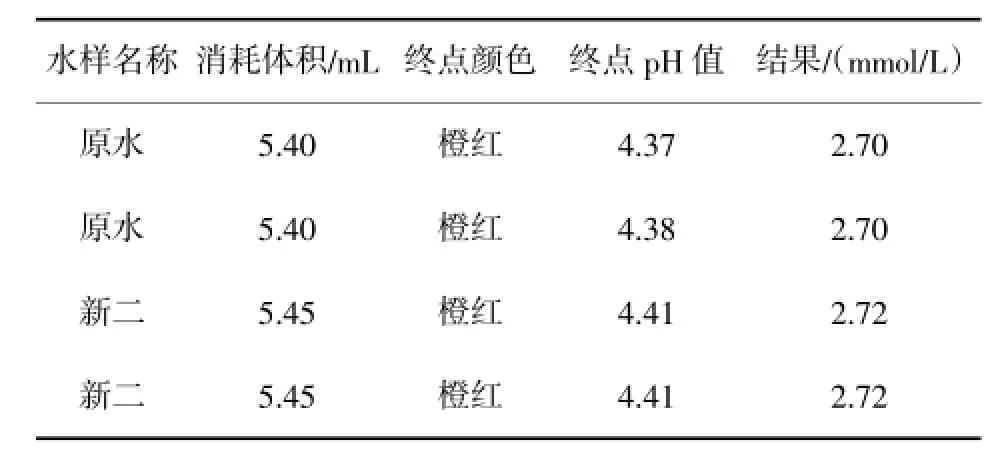
表3 水样滴定终点颜色与pH值对比表
校验结果与结论一致,当终点颜色判断为橙红色即能够满足分析误差要求,并且终点pH值控制在4.40依0.05范围内。
5 结论
通过对常规甲基橙碱度测定终点颜色判断试验,得到甲基橙碱度的滴定终点颜色应为橙红色,并且终点pH值在4.40依0.05范围的结论,按此条件控制,测定结果准确、真实可靠,能为攀钢各种水处理提供准确有效的基础参数资料。
[1]刘针主编.化验员读本(化学分析)[M].北京工业出版社.2003
Color Judgment at End Point of Titration in A lkalinity Determ ination w ith M ethyl Orange
YANG Xiulian
(The Energy and Power Center of Pangang Group V-Ti Co.,Ltd.,Panzhihua,Sichuan 617062,China)
As a composite indicator of water,alkalinity is usually measured with titration analysis.Though it is a simple method,color judgment at the end point of titration is essen原tial to measurement result.Experiment was carried out based on theory,to determine the pH value of titration sample reaching end-point color and obtain the color standard for judgment of titration end point,which was applied in everyday inspection analysis,enabling analysis re原sults to effectively guide production.
alkalinity of methyl orange;color;end point of titration;pH value
TQ085
B
1006-6764(2014)04-0055-03
2013-11-25
杨秀莲(1969-),女,1989年毕业于西南师范大学化学系应用化学专业,大学本科,工程师,现从事化学检测技术工作。

