维生素P对低温保存猪精液的影响
刘亚伟,耿果霞,李青旺*,江中良,王立强
(1.西北农林科技大学动物科技学院,陕西杨凌712100;2.西北农林科技大学动物医学院,陕西杨凌712100)
目前,猪的人工授精通常使用冷冻保存和液态保存的精液,在冷冻保存过程中,由于用于猪精液对温度变化极度敏感,导致冷冻保存后的猪精子活率低,受胎率和产仔数都比较低,所以液态保存仍然是用于人工授精猪精液的主要储存方法[1]。猪精液储存过程发生的氧化应激会导致精液品质的下降,进而影响精子的受精能力[2]。在猪精液储存方面,主要通过在猪精液稀释液中添加抗氧化剂和糖类,以此延长猪精液低温保存时间。Kaeoket等[3]对半胱氨酸、谷胱甘肽和水溶性维生素P对猪精液冷冻保存的效果进行了研究,发现了这些抗氧化剂对猪精液冷冻保存的较好的作用。Funahashi和Sano[4]对谷胱甘肽、半胱氨酸和亚牛磺酸对Mondena稀释液的精液常温储存效果进行了研究,同样作者也发现了这些抗氧化剂对精液储存的有益作用。另外,Malo等[5]对猪精液的冷冻液中加入乳糖、红景天多糖和葡萄糖,对这些糖对猪精液冷冻储存的效果进行了研究。但从当前应用的猪精液稀释液来看,精液低温保存时间通常在4~6d,还不能满足一些偏远地区的养猪生产,因此,开发一种长效的低温稀释液对促进偏远地区的养猪生产有重要作用。
维生素P是一种植物次级代谢产物,为水溶性黄色或微绿色针状结晶或粉末,又名芦丁、柠檬素、橘皮素等等[6]。维生素P具有增强其它维生素功效、防止瘀伤、抗氧化及增强机体对传染性疾病的抵抗作用,但尚未发现维生素P在猪精液低温保存中的作用研究,本试验通过在猪精液稀释液中添加不同浓度的维生素P,在保存不同时间内对猪精液品质进行检测,探索维生素P对低温保存猪精液的影响。
1 材料与方法
1.1 试验材料
本试验所用猪精液由杨凌养猪服务中心提供,采自于一头2岁大的长白种公猪。
1.2 试验方法
1.2.1 精子的采集和处理 采用手握法采集精液后,用BTS溶液按1∶1与猪精液混合,随后用保温杯于1h 内运送至实验室进行处理。进入实验室后,在400×显微镜下对精液样品进行观察,选择精子活力大于75%,精子形态异常率小于15%的样品用于后续试验。样品于离心机中1200g/min离心10min,去上清,用血细胞计数板对精子进行计数,然后用将精子用加有不同浓度维生素P的Zorlesco稀释液(按配方自备)稀释,至精子终浓度为3×107/mL,用80mL 的猪精液低温保存塑料瓶进行分装,然后用多层毛巾包裹,放于4 ℃冰箱进行储存,在保存不同时间后取出进行精液进行品质检测。
1.2.2 精子活力的测定 精子活力测定采用主观评定方法。具体方法为:吸取40μL 精液至200μL离心管中,37 ℃水浴5min。然后吸取10μL 精液滴于37 ℃预热的载玻片上,于400×光学显微镜下对精子进行观察,运动精子占总精子数的比例即为精子的活力。
1.2.3 精子活率的测定 精子的活率评定采用苯胺黑-伊红双染的方法[7]。简要描述如下:将精液于37 ℃水浴30min后,取50μL 精液与50μL 苯胺黑-伊红溶液于室温下孵育30s,接着吸取10 μL至载玻片上,制作精液涂片,在1000×油浸显微镜下进行观察计数,对伊红完全排斥的精子占总精子的比例即为该样品的精子活率。
1.2.4 精子顶体完整率的测定 精子的顶体完整率采用异硫氰酸酯荧光素标记的花生凝集素(FITC-PNA)染色的方法进行[8]。简要描述如下:取10 μL精液均匀涂抹于载玻片上并于室温下风干,用100%的酒精固定10min,然后用FITC-PNA 溶液对已经固定好的样品在37 ℃、湿润、黑暗的环境下孵育30min,最后用PBS洗涤样品两次并于黑暗中风干。将制作好的样品在荧光显微镜下进行观察,其中顶体被染为绿色的精子顶体损坏,相反,顶体无颜色或颜色非常浅的精子被认为顶体功能完整,以此计算精子的顶体完整率。
1.2.5 精子质膜完整性的测定 取50μL 低温保存的精液与1mL的低渗肿胀溶液(含0.735%果糖和1.351%柠檬酸钠)混合后于37 ℃水浴1h,取孵育好的精液10μL 滴于载玻片上并在1000×相差显微镜下精子进行观察,计算尾部弯曲的精子占总精子的比例即为精子的低渗肿胀率。
1.2.6 精子线粒体活性测定 线粒体活性检测采用罗丹明123和碘化丙啶双染的方法,其在Fraser的试验中有详细介绍[9]。其方法为:取330μL储存的精液并向其中加入2μL罗丹明123溶液于37℃下黑暗孵育15 min。然后加入10μL 碘化丙啶溶液(0.5mg/mL),37℃黑暗中继续孵育10min。完成染色后的精子用500g/min 离心5min,弃上清,将沉淀溶于1mLPBS。取10μL 精液滴于载玻片上,盖上盖玻片,在400×荧光显微镜下进行观察。其中,精子被染为红色的精子为死精子。未被染为红色且精子中段被染为较深的绿色的精子为线粒体功能完整的精子,计算线粒体功能完整的精子比例。
1.3 统计分析
数据采用SPSS18.0 软件进行单因素方差分析,以平均数±标准差表示,当P<0.05时,差异具有统计意义。
2 结果与分析
2.1 维生素P对精子活力、活率、质膜及顶体完整率的影响
从表1-2可以看出,加入不同浓度的维生素P在保存3d后,对猪精子的活率、活力和顶体完整率没有影响(P>0.05)。而在第3天时,添加160μg/mL和200μg/mL的维生素P显著地提高了精子的质膜完整性。与对照组相比,在第6天和第9天,加入维生素P 显著提高了猪精子的活力、活率、顶体完整率和低渗肿胀率(P<0.05)。
2.2 不同浓度的维生素P对精子线粒体活性的影响
从表3中可以看出,在第3天和第6天,维生素P的添加对精子线粒体活性的作用不明显(P>0.05)。在保存9d后,与对照组相比,添加维生素P显著提高了猪精子的线粒体活性(P<0.05)。
3 讨论
维生素P是一种抗氧化剂,但是有关添加维生素P 对猪精液低温稀释液Zorlesco的作用的研究尚未见诸报道,本实验中在猪精液低温稀释液中加入不同浓度的维生素P,并对储存后精子三个时期的精子的各项微观指标进行检测,发现了维生素P对精子各项指标具有提高作用。表明了维生素P对精液储存具有保护作用。
国内外对抗氧化剂在猪精液储存过程中的作用的研究较多,研究者已经发现了多种抗氧化剂如牛磺酸、半胱氨酸、生育酚、抗坏血酸等对来自绵羊、猪、牛及人的精子的储存具有保护作用。Bucak等[10]在其研究中发现,抗氧化剂谷氨酸能提高冷冻-解冻后安哥拉山羊的精液的质膜完整率。Li等[11]对抗坏血酸和过氧化氢酶对人精液储存的效果进行了研究,发现这两种抗氧化剂能够减轻精子的氧化应激,进而提高精子的活力。在绵羊的精液冷冻过程中,Maia等[12]研究表明,向Tris-卵黄冷冻稀释液中加入过氧化氢酶能够提高冷冻-解冻后精子的活力和活率。Peña等[13]研究显示,抗氧化剂生育酚的加入对于提高猪精液冷冻-解冻后精子的线粒体活性。在本试验中,虽然采用的保存方式不同,但抗氧化剂的加入提高猪精液储存过程中猪精子的活力、活率、顶体完整率、质膜完整率和线粒体,这一结果与上述研究结果是一致的。
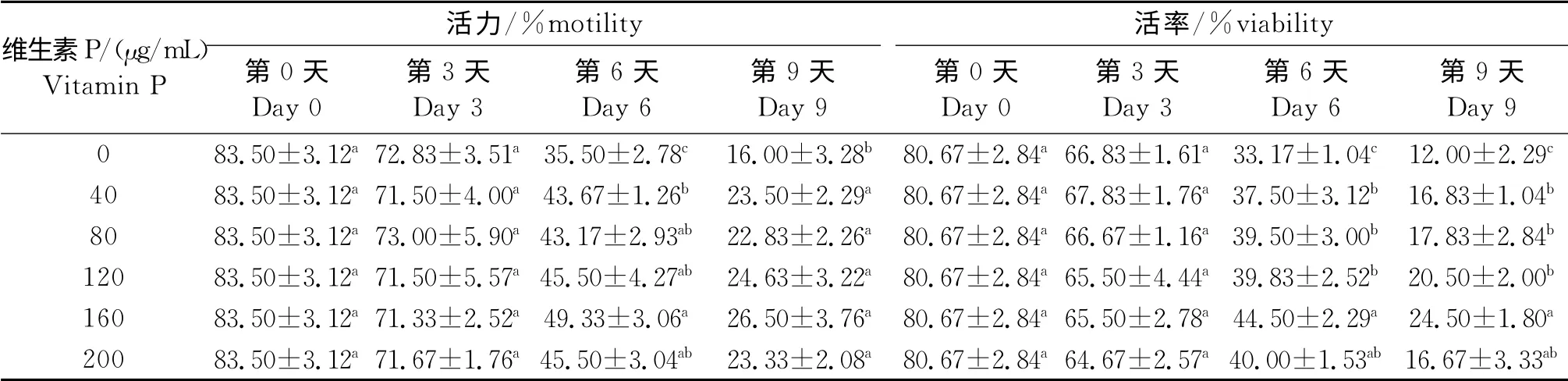
表1 维生素P 对低温条件下猪精子活力及活率的影响Table 1 Effect of vitamin P on motility and viability of boar sperm
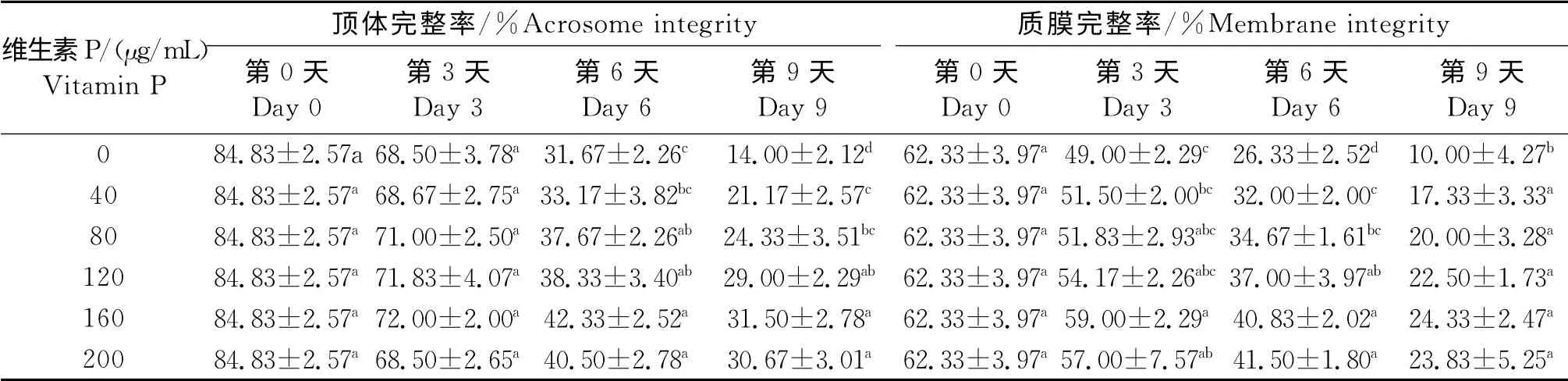
表2 维生素P 对低温条件下猪精子顶体完整率和质膜完整性的影响Table 2 Effect of vitamin P on acrosome integrity and membrane integrity of boar sperm during chilled preservation

表3 维生素P 对低温保存猪精子线粒体活性的影响Table 3 Effect of vitamin P on mitochondrial status during chilled preservation
精子的氧化应激损伤是指精子在一系列外界条件的作用下,精子中过氧化氢、过氧化物及超氧根离子等自由基的过量产生而导致的精子损伤。猪精子的质膜上含有较高的多不饱和脂肪酸,这使其容易受到氧化应激损伤。氧化应激能够导致精子活力和活率的下降、DNA 损伤,从而导致精子受精能力的下降[14]。据报道,维生素P含有的邻二羟基和双键能够帮助机体组织去除自由基并且阻止细胞质膜发生脂质过氧化[15]。本试验中,维生素P对猪精液低温保存的保护作用,可能是由于维生素P中的抗氧化基团减少了猪精子脂质过氧化反应的发生。另一方面,精子具有自身抗氧化系统,它主要由精子性腺分泌的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)及谷胱甘肽过氧化物酶(GPx)构成。此外,精子中的非酶类抗氧化物质如抗坏血酸、谷胱甘肽、尿酸、维生素E、类胡萝卜素及泛醌等也参与了抗氧化系统的构成。抗氧化系统能够减小精子储存过程产生的自由基对精子的损伤[16-17]。本试验中,维生素P所具有的对猪精子的保护作用也可能是由于维生素P在精子的储存过程中,增强了精子自身所具有的抗氧化系统的能力;当Zorlesco中维生素P 的浓度为200μg/mL 和250μg/mL时,其对猪精子的保存作用减弱,这很可能是由于高浓度的维生素P在减少氧化应激对猪精子损伤的同时,造成了稀释液本身理化性质发生了改变,对精子的储存产生了不利作用。
4 结论
本试验结果表明,维生素P对储存于4℃条件下的猪精子具有保护作用,其最适添加浓度为160μg/mL。
[1]Holt W V.Fundamental aspects of sperm cryobiology:the importance of species and individual differences[J].Theriogenology,2000,53:47-58.
[2]Bansal A K,Bilaspuri G S.Impacts of oxidative stress and antioxidants on semen functions[J].Veterinary Medicine International,Doi:10.4061/2011/686137.
[3]Li Y,Qi X,Zhang Q H,et al.Overview on the recent study of antimicrobial peptides:origins,functions,relative mechanisms and application[J].Peptides,2012,37(2):207-215.
[4]Funahashi H,Sano T.Select antioxidants improve the function of extended boar semen stored at 10℃[J].Theriogenology,2005,63(6):1605-1616.
[5]Malo C,Gil L,Gonzalez N,et al.Comparing sugar type supplementation for cryopreservation of boar semen in egg yolk based extender[J].Cryobiology,2010,61(1):17-21.
[6]农 洁.维生素P[J].中国保健食品,2012(9):26-29.
[7]Bjorndahl L,Soderlund I,Kvist U.Evaluation of one-step eosin-nigrosin technique for human sperm vitality assessment[J].Human Reproduction,2003,18(4):813-816.
[8]Terri L R,Rachael B W,Jennifer L B,et al.Heterologous in vitro fertilization and sperm capacitation in an endangered african antelope:the scimitar-horned oryx(Oryx dammah)[J].Bi-ology of Reproduction1998,58:475-482.
[9]Fraser L,Dziekonska A,Strzezek R,et al.Dialysis of boar semen prior to freezing-thawing:Its effects on post-thaw sperm characteristics[J].Theriogenology,2007,67:994-1003.
[10]Bucak M N,Sariözkan S,Tuncer P B,et al.Effect of antioxidants on microscopic peroxidation and antioxidant activities in Angora goat semen following cryopreservation[J].Small Ruminant Research,2009,81(2-3):90-95.
[11]Li Z L,Lin Q L,Liu R J,et al.Protective effects of ascorbate and catalase on human spermatozoa during cryopreservation[J].Journal of Andrology,2010,31(5):437-444.
[12]Maia M S,Bicudo S D,Azevedo H C,et al.Motility and viability of ram sperm cryopreserved in a Tris-egg yolk extender supplemented with antioxidants[J].Small Ruminant Research,2009,85(2-3):85-90.
[13]Peña F J,Johannisson A,Wallgren M,et al.Antioxidant supplementation in vitro improves boar sperm motility and mitochondrial membrane potential after cryopreservation of different fractions of the ejaculate[J].Animal Reproduction Science,2003,78(1-2):85-98.
[14]Awda B J,Mackenzie-Bell M,Buhr M M.Reactive oxygen species and boar sperm function[J].Biol Reprod,2009,81:553-561.
[15]孙 鹏,刘文文.生物类黄酮研究概况[J].中国兽医杂志,2007(4):72-74.
[16]Cerolini S,Maldjian A,Surai P,et al.Viability,susceptibility to peroxidation and fatty acid composition of boar semen during liquid storage[J].J Animal Reproduction Science,2000,58:99-111.
[17]孙 洁,周安方.精子DNA 损伤及保护[J].中华男科学杂志,2006,7(12):639-646.

