壳聚糖成膜溶液及其膜相关性质研究
刘 梅,毛致富,江小平,余 陈,牛亚军,周裔彬,*
壳聚糖成膜溶液及其膜相关性质研究
刘 梅1,毛致富1,江小平2,余 陈1,牛亚军1,周裔彬1,*
(1.安徽农业大学茶与食品科技学院,安徽 合肥 230036;2.安徽省桐城市质量技术监督局,安徽 桐城 231400)
以不同体积分数的乙酸溶液为分散剂,不同质量浓度的山梨醇为增塑剂,配制不同质量浓度的两种脱乙酰度壳聚糖溶液,探讨不同质量浓度基质对壳聚糖溶液pH值和电导率的影响,阐述壳聚糖溶液在成膜过程中各离子的聚合情况。对壳聚糖成膜溶液的流变学性质进行研究,并对其形成的膜进行表征,分析山梨醇对壳聚糖成膜溶液及其膜性质的影响。结果表明:壳聚糖成膜溶液体系中,主要是山梨醇、乙酸与壳聚糖中的各种离子结合形成黏稠的溶液。含与不含山梨醇作为增塑剂的壳聚糖成膜溶液均表现出假塑性流体,山梨醇与两种脱乙酰度的壳聚糖均有很好的相容性,能够形成均匀、连续的膜,使壳聚糖膜的吸热峰和放热峰发生 一定的迁移,对其热稳定性有一定的影响。
壳聚糖;溶液性质;壳聚糖膜;热稳定性
近年来,由塑料引起的环境恶化问题日益得到人们的关注,于是开发可再生环境友好材料代替塑料逐渐成为众多科研工作者的目标[1-2]。多糖作为可再生包装材料的主要来源之一[3],开发自然界中资源丰富的多糖作为新型包装材料逐渐得到人们的重视。我国拥有丰富的壳聚糖来源,壳聚糖是甲壳素的脱乙酰产物,是从虾、蟹等甲壳类动物的外壳以及菌、藻类低等植物的细胞壁中提取出的天然高分子材料。作为自然界中唯一的碱性多糖,壳聚糖具有无毒、无味及良好的生物相容性降解性、可再生性、抗菌防腐性、成膜性等优良性能[4-5]。由于其良好的功能性,目前人们对壳聚糖的应用已有大量的研究,尤其是在包装材料方面。为了使壳聚糖作为包装材料具有很好的性能,往往需要添加一种或几种其他物质来改善其成膜性,从而满足不同使用的需求[6]。山梨醇(C6H14O6),又名山梨糖醇,由于结构中含有大量的羟基,在食品、日化、医药等行业都有极为广泛的作用,可作为甜味剂、保湿剂、赋形剂、防腐剂等[7]。目前人们已对壳聚糖溶液的性质如流变性质、溶解性能、特性黏度及其膜的性质等进行了大量的研究[8-10],但是,利用壳聚糖溶液在成膜过程中各种基质的变化情况来阐述壳聚糖成膜机理及形成膜的热稳定性的研究还很少。
实验以山梨醇作为增塑剂,选用两种脱乙酰度85%和95%的壳聚糖为原料,配制不同种类的溶液,探讨溶液在成膜过程中各种基质的变化和成膜溶液的流变学性质,从而在一定程度上说明壳聚糖溶液在成膜过程中各离子的结合情况。然后,用扫描电镜观察山梨醇与壳聚糖形成膜的内部结构,用以说明壳聚糖与山梨醇的相容性。其次对含与不含山梨醇的壳聚糖膜进行差示热量扫描分析,分析不同种类的壳聚糖膜热力学性质的不同,阐述不同壳聚糖膜的热稳定性,为壳聚糖在包装材料方面的应用提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
脱乙酰度85%、95%壳聚糖(分子质量分别是343.75、312.5 kD) 浙江金壳生物化学有限公司;山梨醇 美国Sigma公司;冰乙酸、柠檬酸、乳酸、氢氧化钠均为分析纯 国药集团化学试剂有限公司。
1.2 仪器与设备
DK-S26型数显恒温水浴锅 上海精宏实验设备有限公司;ZD-2型pH滴定仪、DSJ-308A雷磁电导率仪上海精密科学仪器有限公司;DHG-9143135-11鼓风干燥箱 上海新苗医疗器械制造有限公司;KQ-250DE型数控超声波清洗器 昆山市超声仪器有限公司;78-1磁力加热搅拌器 江苏省金坛市金城国胜实验仪器厂;R/S+SST型流变仪(转子型号为CC40) 美国Brookfield公司;Sirion 200场扫描电子显微镜(scanning electron microscope,SEM) 荷兰 FEI公司;DSC 8000差示扫描量热仪(differential scanning calorimeter,DSC) 美国Perkin Elmer公司。
1.3 方法
1.3.1 壳聚糖溶液的配制
[11-12],选取乙酸、山梨醇和壳聚糖配制不同体积分数或质量浓度的壳聚糖溶液,研究乙酸、山梨醇对壳聚糖溶液性质的影响以及溶液在成膜过程中各种基质的变化。用电导率和pH值的变化来表征溶液中各种离子的变化[13-14]。
1.3.2 不同类型的壳聚糖溶液pH值和电导率的变化
以乙酸作为分散剂,山梨醇作为增塑剂,配制不同脱乙酰度的壳聚糖溶液,通过测定pH值和电导率的变化来反映溶液在成膜的过程中各基质的变化。
1.3.2.1 不同质量浓度的山梨醇对壳聚糖溶液性质的影响
参照文献[15-16]的方法并稍加修改。称取3 份4.0 g脱乙酰度85%壳聚糖,分别加入200 mL体积分数为2%的乙酸溶液中,3 份溶液中分别加入1、2、3 g/100 mL的山梨醇,编号为样1、2、3。同样的方法配制脱乙酰度95%壳聚糖溶液,样品编号为样4、5、6,在60 ℃磁力搅拌器上搅拌2 h。待溶液冷却至25 ℃,于该温下每隔1.5 h测溶液的pH值和电导率。
1.3.2.2 不同体积分数的乙酸对壳聚糖溶液性质的影响
称取3 份4.0 g的脱乙酰度85%壳聚糖,分别配制体积分数1%、2%、3%的乙酸溶液各200 mL,加入2 g/100 mL山梨醇,样品编号为样1、2、3。同样的方法配制脱乙酰度95%壳聚糖溶液,样品编号为样4、5、6,处理及测试方法同1.3.2.1节。
1.3.2.3 不同质量浓度的壳聚糖对其溶液性质的影响
配制3 份2%的乙酸溶液200 mL,分别加入1、2、3 g/100 mL脱乙酰度85%壳聚糖和2 g/100 mL山梨醇,样品编号为样1、2、3。同样的方法配制脱乙酰度95%的壳聚糖溶液,样品编号为样4、5、6,处理及测试方法同1.3.2.1节。
1.3.3 不同类型壳聚糖溶液的流变性
经筛选发现以2%乙酸作为分散剂,2 g/100 mL的壳聚糖作为分散质,2 g/100 mL的山梨醇作为增塑剂的壳聚糖溶液具有较好的成膜性,3 g/100 mL壳聚糖溶液过于黏稠而使溶液的流延性能较差,1 g/100 mL的壳聚糖溶液较稀,形成的膜较薄。实验用不含山梨醇的溶液作对比,研究山梨醇作为增塑剂对溶液性质的影响。以脱乙酰度85%和95%的壳聚糖分别加与不加山梨醇配成的4种溶液作为研究对象,分析4种溶液的流变学性质及山梨醇对溶液流变学性质的影响。剪切速率为0~500 s-1范围内,测试时间120 s,测试4 个样品在25 ℃条件下表观黏度随剪切速率的变化[17]。
1.3.4 不同种类壳聚糖膜的制备
选取2%的乙酸作为壳聚糖溶液的分散剂。
2 g/100 mL脱乙酰度85%、95%壳聚糖粉末→分别加与不加2 g/100 mL山梨醇→溶于100 mL 2%乙酸溶液磁力搅拌器60 ℃条件下搅拌2 h→超声波脱气10 min玻璃板上流延(60 cm × 20 cm×0.5 cm)→60 ℃的烘箱中烘干6 h→自然条件下干燥48 h→用2 g/100 mL NaOH溶液中和膜表面残余的酸进行揭膜→纯水清洗膜表面至中性→自然干燥成膜
1.3.5 不同脱乙酰度的壳聚糖膜微观结构
参照文献[18-19]的方法。用扫描电镜对含有山梨醇两种脱乙酰度的壳聚糖膜表面和断面进行观察。样品经真空喷金后置于样品台上观察壳聚糖膜的内部结构,加速电压为5.00 kV,表面和断面的放大倍数分别为10 000、20 000倍。
1.3.6 不同脱乙酰度的壳聚糖膜热力学性质
参照文献[20-21]的方法。先将含与不含山梨醇两种脱乙酰度的壳聚糖膜在干燥皿中平衡24 h,然后称取5~10 mg的样品放人坩埚中,再用压盖机密封,以空皿作参照样。在DSC8000上进行热力学性质的测试,测量前用铟校正DSC仪,采用10 ℃/min的升温程序,扫描温度范围为30~350 ℃。使用Pyris Manager软件分析每个样品所测的热焓、起始温度、峰温和终温。
1.4 数据分析
实验采用Origin 8.0分析软件对所测的数据进行处理分析。
2 结果与分析
2.1 不同基质对壳聚糖溶液性质的影响
2.1.1 山梨醇对壳聚糖溶液性质的影响
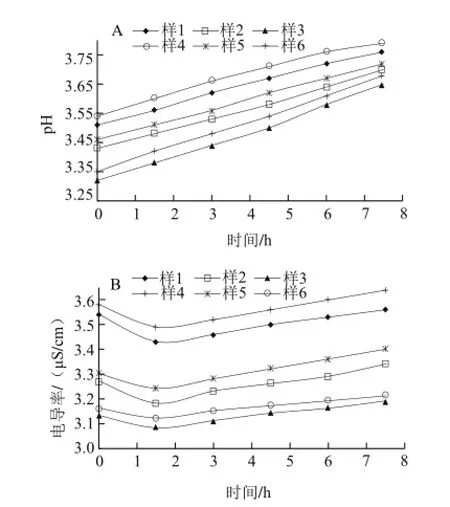
图1 不同质量浓度的山梨醇对壳聚糖溶液pH值和电导率的影响Fig.1 Influence of different sorbitol concentrations on the pH and conductivity of chitosan solutions
由图1可知,两种脱乙酰度的壳聚糖溶液pH值均随着山梨醇质量浓度的增加而降低,随着时间的增加pH值呈现缓慢增加的趋势,且在相同的体系环境下(乙酸、山梨醇含量相同)脱乙酰度95%的壳聚糖溶液pH值大于脱乙酰度 85%的壳聚糖溶液。分析原因可能是由于山梨醇中含有羟基,羟基在酸性条件下会电离出一部分氢离子,使溶液的pH值下降。随着溶液体系反应的进行,会有部分氢离子与氨基发生反应,乙酸在空气中部分挥发使得溶液pH值增大。
两种脱乙酰度的壳聚糖溶液电导率均随着山梨醇质量浓度的增加而减小,随着时间的增加,电导率先下降后缓慢上升,且在相同的体系环境下(乙酸、山梨醇含量相同)脱乙酰度95%的壳聚糖溶液电导率大于脱乙酰度85%壳聚糖溶液。分析原因可能是由于山梨醇起到增塑剂的作用,具有键合各种离子的能力,随着其质量浓度的增大,溶液中各种离子发生聚合的能力越强,其电导率也就越小。开始壳聚糖的氨基和乙酸的羧基发生反应,溶液中游离的离子数目减少,从而电导率下降,随着反应的进行,乙酸使壳聚糖分子链发生断裂,如β-1,4糖苷键裂解等,使电导率增大,这一点与邵伟等[12]报道结果相符。
壳聚糖作为一种碱性多糖,随着脱乙酰度增大,壳聚糖溶液中的铵根离子数目也就越多,从而使溶液的pH值和电导率增大。
2.1.2 乙酸对壳聚糖溶液性质的影响
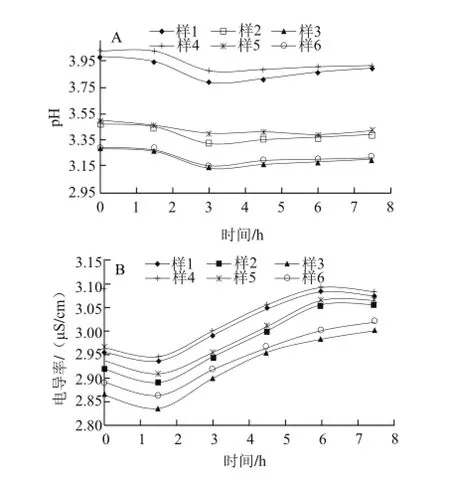
图2 不同体积分数乙酸对壳聚糖溶液pH值和电导率的影响Fig.2 Influence of different acetic acid solution concentrations on the pH and conductivity of chitosan solutions
由图2可知,两种脱乙酰度的壳聚糖溶液pH值均随着乙酸体积分数的增大而降低,随着时间的增加,pH值先下降后缓慢上升趋于平稳,可能是壳聚糖作为一种碱性多糖,在溶 液中表现出碱性使溶液中的pH值增大,随后铵根离子与羧基发生一部分中和,又使溶液的pH值下降。在相同体系环境下(山梨醇、乙酸含量相同),脱乙酰度95%的壳聚糖溶液pH值大于脱乙酰度85%的壳聚糖溶液,这一点与2.1.1节结果相符。
两种脱乙酰度的壳聚糖溶液电导率均随着乙酸体积分数的增大而降低,乙酸作为一种弱电解质,体积分数增大抑制了溶液中酸根离子的电离,使溶液中的电导率降低。随着时间的增加,电导率呈现先下降后上升的趋势。刚开始溶液中的羧基与壳聚糖分子中的氨基发生反应,溶液中游离的离子数目减少,使电导率降低,反应一段时间后,壳聚糖分子在酸性环境下充分降解,使溶
液中游离的离子数目增多,电导率又增大。在相同体系环境下(山梨醇、乙酸含量相同),脱乙酰度95%的壳聚糖溶液电导率大于脱乙酰度85%的壳聚糖溶液,这一点与2.1.1节结果相符。
2.1.3 壳聚糖质量浓度对壳聚糖溶液性质的影响
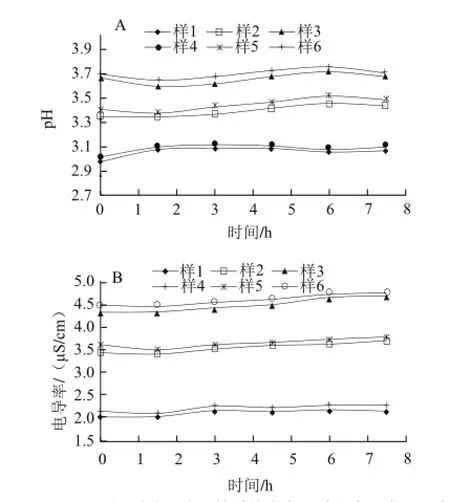
图3 不同质量浓度的壳聚糖对其溶液pH值和电导率的影响Fig.3 Influence of different chitosan concentrations on the pH and conductivity of chitosan solutions
由图3可知,两种脱乙酰度的壳聚糖溶液,其pH值和电导率总体变化不大,几乎是平稳的直线,说明壳聚糖质量浓度对溶液的pH值和电导率影响很小,可以忽略不计,分散剂(乙酸)和增塑剂(山梨醇)含量的变化对溶液中pH值和电导率的变化起到主导作用。
两种脱乙酰度的壳聚糖溶液,其pH值和电导率均随着壳聚糖质量浓度的增加而增加,且在相同的体系条件下,脱乙酰度95%的壳聚糖溶液其pH值和电导率均大于对应的脱乙酰度85%的溶液,这一点与2.1.1、2.1.2节的结果都相符。壳聚糖的质量浓度越大,溶液中的氨基也就越多,溶液的pH值和电导率也相应增大。
2.2 4种类型的壳聚糖溶液流变学性质表征
由图4可知,4种溶液的黏度均随着剪切率的增加而下降,当剪切率增大到一定值时,各种溶液的黏度值相差很小,脱乙酰度85%的壳聚糖溶液表观黏度大于脱乙酰度95%的壳聚糖溶液,且含山梨醇的溶液其表观黏度值大于不含山梨醇的溶液。
此结果与文献[9]报道的结果相符,在剪切速率相同的条件下,分子质量越大,样品溶液的黏度越大, 脱乙酰度的增大,溶液的黏度降低。两图中曲线的变化均表示溶液呈现假塑性流体的性质,且山梨醇的加入除了使其溶液的剪切力和黏度值增加外并没有改变溶液流变学的性质。可能是由于山梨醇中大量的羟基与壳聚糖中的氨基、羧基结合后有利于分子间链的伸展,可能对形成膜的机械性能有一定的影响。
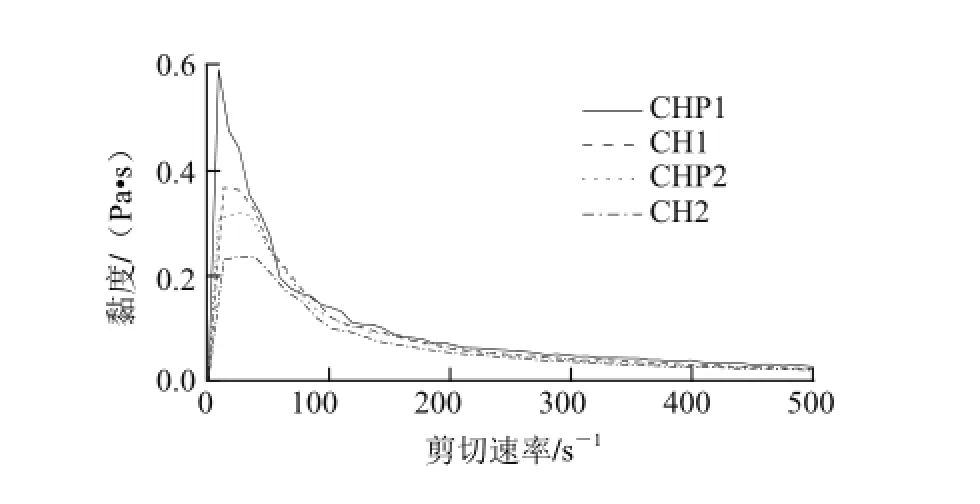
图4 4种壳聚糖溶液表观黏度随着剪切速率变化的曲线Fig.4 Apparent viscosity against shear rate for four types of chitosan solution
2.3 壳聚糖膜超微结构观察

图5 含有山梨醇的不同脱乙酰度壳聚糖膜表面和断面的电镜扫描图谱Fig.5 SEM micrographs of the surface and cross section of chitosan films with different degrees of deacetylation with sorbitol
由图5可知,两种脱乙酰度的壳聚糖和山梨醇共混形成的膜,表面经放大10 000倍,观察其表面均比较光滑致密,说明山梨醇与这两种壳聚糖有很好的相容性,都可以形成均一、连续的膜。同时在膜表面分散着少量的颗粒,这可能是球晶颗粒被破坏后留下的结晶碎片,这些结晶碎片在不同的放大倍数下变化不大[19]。两种脱乙酰度的膜在切割的断面处经过高倍数大可以清晰地看出其断裂口,且脱乙酰度95%的壳聚糖断裂处更为致密[12]。
2.4 壳聚糖成膜后热特性变化
由图6可知,当加热温度从30 ℃升至350 ℃时,脱乙酰度8 5%的壳聚糖含与不含山梨醇的膜分别在73.52~140.97 ℃、252.4~306.91 ℃和76.82~136.25 ℃、267.9~311.34 ℃出现一个吸热峰和一个放热峰,脱乙酰度95%的壳聚糖含与不含山梨醇的膜分别在 74 ~129.72 ℃、258.43~311.98 ℃和78.09~116.87 ℃、272.55~302.55 ℃出现一个吸热峰和一个放热峰。Martínez-Camacho[21]、Feng[22]等认为70~110 ℃范围内的吸热峰是由聚合物中吸附水、结合水和挥发性成分蒸发及挥发的结果,250~350 ℃范围内的放热峰是由聚合物热降解所引起的。
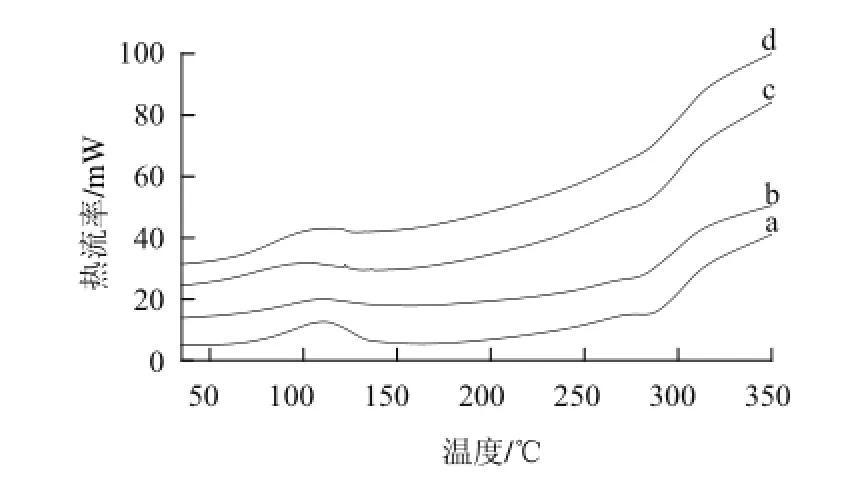
图6 不同脱乙酰度的壳聚糖粉末及其膜的示差量热扫描图Fig.6 Differential scanning calorimetry thermograms of differently deacetylated degrees chitosan powders and their films
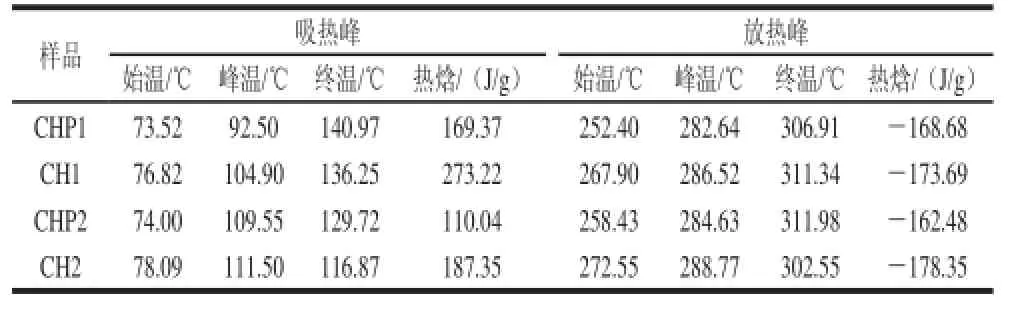
表1 不同脱乙酰度的壳聚糖膜含与不含山梨醇热特性的变化Table 1 Changes in thermal properties of chitosan films with different degrees of deacetylation with and without sorbitol
由表1可知,对于两种脱乙酰度的壳聚糖,含有山梨醇的壳聚糖膜,其吸热峰和放热峰的始温和峰温及热焓值均小于不含山梨醇的壳聚糖膜,这说明山梨醇使壳聚糖膜的热稳定性降低。含与不含山梨醇的壳聚糖膜,脱乙酰度95%的膜,其吸热峰和放热峰的始温和峰温基本高于对应的脱乙酰度95%的壳聚糖膜,从而说明脱乙酰度95%壳聚糖膜的热稳定性高于脱乙酰度85%的壳聚糖膜,随着脱乙酰度的增大,壳聚糖分子中含有较多的铵根离子,有助于形成更多的氢键和更稳定的分子结构[22]。
3 结 论
壳聚糖在成膜过程中溶液性质的探讨结果表明,壳聚糖的含量对其溶液的pH值和电导率影响很小,在整个溶液体系中主要是乙酸和山梨醇中的离子与壳聚糖中的氨基结合以及壳聚糖中糖苷键断裂,从而形成黏稠的溶液。流变性质的测试结果表明,不同种类的壳聚糖成膜溶液均表现出假塑性流体的性质,表观黏度随着剪切速率的增大而降低最后趋于平缓,说明当剪切速率增大到一定值时溶液的性质变化很小。山梨醇的加入使溶液的表观黏度增加,表明山梨醇有利于壳聚糖分子间链的伸展。SEM结果表明山梨醇与脱乙酰度85%、95%的壳聚糖均具有很好的相容性,能够形成结构致密、光滑的膜,观察断面结果显示脱乙酰度95%壳聚糖形成的膜结构更为致密。DSC结果表明与不含山梨醇的壳聚糖膜相比,含有山梨醇的两种脱乙酰度的壳聚糖膜其吸热、放热峰的峰温及热焓值均降低,这说明壳聚糖成膜溶液的共混体系中,各种离子之间的键合使分子内结构重排,山梨醇的加入使壳聚糖分子间的柔顺性增加,从而影响膜的热稳定性。
参考文献:
[1] CAMPOS C A, GERSCHENSON L N, FLORES S K. Development of edible films and coatings with antimicrobial activity[J]. Food and Bioprocess Technology, 2010, 4(6): 849-875.
[2] 张俐娜, 陈国强, 蔡杰, 等. 基于生物质的环境友好材料[M]. 北京:化学工业出版社, 2011: 178-186.
[3] ZIANI K, OSES J, COMA V, et al. Effect of the presence of glycerol and Tween 20 on the chemical and physical properties of films based on chitosan with different degree of deacetylation[J]. LWT - Food Science and Technology, 2008, 41(10): 2159-2165.
[4] HAM K S. Characteristics of chitosan films as affected by the type of solvent acid[J]. Food Science and Biotechnology, 1998, 7(4): 35-40.
[5] JAYAKUMAR R, MENON D, MANZOOR K, et al. Biomedical applications of chitin and chitosan based nanomaterials: a short review[J]. Carbohydrate Poly mers, 2010, 82(2): 227-232.
[6] EPURE V, GRIFFON M, POLLET E, et al. Structure and properties of gly cerol-plasticized chitosan obtained by mechanical kneading[J]. Carbohydrate Polymers, 2011, 83(2): 947-952.
[7] JONAS R, SILVEIRA M M. Sorbitol can be produced not only chemically but also biotechnologically[J]. Applied Biochemistry and Biotechnology, 2004, 118(1): 321-336.
[8] 陈雄. 壳聚糖溶液行为研究[D]. 北京: 北京服装学院, 2008.
[9] 邵伟. 壳聚糖的物化性质及基础应用研究[D]. 上海: 东华大学, 2007.
[10] 李星科, 姜启兴, 夏文水. 壳聚糖溶液的流变学性质及应用研究[J].食品工业科技, 2011, 32(2): 65-68.
[11] 苑静. 改性纤维素和壳聚糖共混膜的制备及性能研究[J]. 塑料科技, 2009, 37(6): 42-45.
[12] 王秀娟, 张坤生. 增塑剂对壳聚糖膜性能的影响[J]. 食品研究与开发, 2008, 29(9): 7-11.
[13] 邵伟, 沈青. 壳聚糖在醋酸溶液中的溶解行为及动力学模型[J]. 纤维素科学与技术, 2007, 15(2): 30-38.
[14] 李维艳, 黄林, 杨朋, 等. 壳聚糖在柠檬酸溶液中溶解行为研究[J].化工新型材料, 2011, 39(11): 121-123.
[15] 朱华跃, 肖玲. 壳聚糖-明胶共混膜湿热处理及FT-IR和XRD谱图分析[J]. 浙江海洋学院学报: 自然科学版, 2006, 25(3): 301-304.
[16] EPURE V, GRIFFON M, POLLET E, et al. Structure and properties of glycerol-plasticized chitosan obtained by mechanical kneading[J]. Carbohydrate Polymers, 2011, 83(2): 947-952.
[17] RIVERO S, GARC¸A M A, PINOTTI A. Composite and bi-layer films based on gelatin and chitosan[J]. Journal of Food Engineering, 2009, 90(4): 531-539.
[18] 喻胜飞. 多孔N-乙酰化壳聚糖超滤膜的制备及表征[J]. 合成材料老化与应用, 2007, 36(1): 13-15.
[19] 应国清, 卢霞, 易喻. 壳聚糖吸附剂的制备及性能[J]. 化工进展, 2007, 26(2): 230-233.
[20] KUREK M, BRACHAIS C H, NGUIMJEU C M, et al. Structure and thermal properties of a chitosan coated polyethylene bilayer film[J]. Polymer Degradation and Stability, 2012, 97(8): 1232-1240.
[21] MART¸NEZ-CAMACHO A P, CORTEZ-ROCHA M O, EZQUERRA-BRAUER J M, et al. Chitosan composite films: thermal, structural, mechanical and antifungal properties[J]. Carbohydrate Polymers, 2010, 82(2): 305-315.
[22] FENG F, LIU Y, ZHAO B, et al. Characterization of half N-acetylated chitosan powders and films[J]. Procedia Engineering, 2012, 27: 718-732.
Properties of Chitosan Film-Forming Solution and Its Films
LIU Mei1, MAO Zhi-fu1, JIANG Xiao-ping2, YU Chen1, NIU Ya-jun1, ZHOU Yi-bin1,*
(1. College of Tea and Food Science and Technology, Anhui Agricultural University, Hefei 230036, China; 2. Tongcheng Quality and Technical Supervision, Tongcheng 231400, China)
Chitosans with two different degrees of deacetylation (DD) were used separately prepare different concentrations of chitosan solutions by using different concentrations (V/V) of acetic acid solutions as dispersing agent and different concentrations (m/V) of sorbitol as plasticizer. We examined the effect of acetic acid, sorbitol and chitosan concentration on the pH and conductivity of chitosan solutions, and illustrated the roles of ionic polymerizations in chitosan film formation. The rheological properties of chitosan film-forming solutions were studied and the effect of sorbitol on the properties of chitosan film-forming solutions and the formed films was analyzed. Results showed that sticky solution was formed by combination of ions from sorbitol, acetic acid and chitosan. Chitosan film-forming solutions with and without sorbitol as plasticizer were both pseudoplastic fluid, and sorbitol presented a good compatibility with the two kinds of deacetylated chitosan that could form uniform and continuous films, resulting in a shift in the endothermic and exothermic peak temperatures of chitosan films and presenting certain influence on their thermal stability.
chitosan; solution properties; chitosan film; thermal stability
Q929.2
A
1002-6630(2014)09-0011-05
10.7506/spkx1002-6630-201409003
2013-06-13
国家自然科学基金面上项目(31271960)
刘梅(1988—),女,硕士研究生,研究方向为食品化学。E-mail:liumei8804@163.com
*通信作者:周裔彬(1965—),男,教授,博士,研究方向为食品化学。E-mail:zhouyibin@ahau.edu.cn

