苹果黄酮的分离纯化及抗油脂氧化研究
姚红娟,唐浩国*,郭介之,张艳梅
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
苹果黄酮的分离纯化及抗油脂氧化研究
姚红娟,唐浩国*,郭介之,张艳梅
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
采用葡聚糖凝胶Sephadex LH-20柱对大孔树脂分离后的黄酮进行纯化,不同体积分数的甲醇溶液进行洗脱,洗脱流速为0.8 mL/min,得到两种化合物单体A和B。高效液相色谱法检测(流动相甲醇和水,DAD检测器,检测波长280、358 nm),化合物A为绿原酸,B是黄酮类物质,通过颜色反应和紫外光谱进行初步结构鉴定,B为黄酮醇类物质,在7位和4’ 位有邻二酚结构。以过氧化值为指标,采用烘箱法对比化合物B、芦丁、2,6-二叔丁基-4-甲基苯酚(2,6-di-tert-butyl-4-methylphenol,BHT)的抗油脂氧化的能力,3 种物质对芝麻油的自动氧化影响不大,BHT与化合物B可以阻止猪油氧化酸败,抗氧化效果BHT>化合物B>芦丁。
苹果;黄酮;分离;纯化;油脂抗氧化
2010年中国苹果年产量3326.52万t,占世界总产量47.8%(联合国粮食及农业组织数据),且以每两年300万t的速度持续增加[1],己基本满足我国国民对苹果鲜果的消费需求[2],苹果市场依然停留在鲜果及初加工阶段,为提高苹果产业价值,必须在深加工领域寻求突破。
苹果中含有丰富的类黄酮物质[3]对苹果总抗氧化能力(total anti-oxidant capacity,TAC)的贡献率可达45%~48%[4]。研究表明类黄酮可作为超氧阴离子自由基和羟自由基的清除剂在起始阶段抑制脂质过氧化[5],有很强的抗活性氧自由基功能,同时对动物的脂质代谢有调节作用,可降血脂,降血压,保护心脑血管,抗癌抗突变[6],具有很强的保健功能。
本实验将提取苹果中的黄酮进行抗油脂氧化方面的研究,与传统的有安全隐患的油脂抗氧化剂BHT[7-8]及黄酮代表物质芦丁抗油脂氧化能力做比较,为找到新型抗油脂氧化剂及提高苹果附加价值提供可实际运用的思路。
1 材料与方法
1.1 材料与试剂
市售新鲜灵宝红富士,洗净,均匀切成5mm薄片,去核,在沸水中加热10 s,以破坏多酚氧化酶,防止褐变;将苹果片表面的水分用滤纸吸干,放入打浆机中打浆,用75%乙醇溶液在80 ℃条件下浸提两次[9],旋转蒸发浓缩,醇沉,取上清液,干燥得醇提物,过AB-8大孔树脂[10],得黄酮粗产物,干燥后在冰箱中冷藏备用;市售肥猪肉炼制的猪板油,市售石磨香油。
芦丁标准品 上海晶纯生化科技股份有限公司;2,6-二叔丁基-4-甲基苯酚(2,6-di-tert-butyl-4-methylphenol,BHT)标准品 美国Sigma公司;二氢查尔酮标准品 上海晶纯生化科技股份有限公司;Sephadex LH-20 郑州勤实科技有限公司;高效液相色谱所用甲醇为色谱级 成都市科龙化工有限公司。
1.2 仪器与设备
Agilent 1260型高效液相色谱仪(Agilent ZORBAX SB-C18(4.6 mm×250 mm,5 μm)) 美国安捷伦公司;722S紫外分光光度计 上海精密仪器仪表有限公司;UV-2800型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;玻璃中压分离凝胶层析柱(16 mm×300 mm)、兰格蠕动泵 保定兰格恒流泵有限公司;BS-100自动部分收集器 上海精科实业有限公司。
1.3 方法
1.3.1 苹果黄酮的纯化
1.3.1.1 芦丁标准曲线的绘制
采用铝盐络合显色法,通过文献[11]方法操作,得芦丁标准曲线的回归方程:y=1.196x+0.005 98,式中:x为芦丁质量浓度/(mg/mL),y为吸光度A510nm,线性范围为0~0.5 mg/mL,相关系数R2=0.999。
1.3.1.2 利用Sephadex LH-20纯化分离苹果黄酮
过葡聚凝胶柱的甲醇、水均要求通过0.45 μm的微孔滤膜过滤,上样液过0.22 μm有机滤膜。
1)Sephadex LH-20的预处理
取23g干燥的Sephadex LH-20,用150 mL甲醇充分溶胀,湿法装柱(中压分离凝胶层析柱16 mm×300 mm),为防止溶解热效应,使葡聚糖凝胶柱产生气泡,采用甲醇体积分数逐渐降低的方式进行柱平衡,最终达到20%甲醇平衡。
2)黄酮的分离纯化
取151.2 mg粗黄酮,硝酸铝法检测黄酮纯度[12]为93.29%,用20 mL甲醇溶解,过0.22 μm有机滤膜,取1 mL滤液注射到层析柱中,以0.8 mL/min的流速进行梯度洗脱,用体积分数为20%、30%、40%、50%、60%、70%、80%、90%的甲醇溶液分别洗脱60 min,然后用纯甲醇洗脱至高效液相色谱法(high performance liquid chromatography,HPLC)检测为直线时停止,自动部分收集器以每管10min的频率收集。
3)绘制Sephadex LH-20动态洗脱曲线
每管均用NaNO2→Al(NO2)3→NaOH法检测总黄酮含量,获得Sephadex LH-20的动态洗脱曲线,根据其数据变化,选择进高效液相的样品。
4)色谱条件
色谱柱:Agilent ZORBAX SB-C18分析柱(4.6 mm×250 mm,5 μm)。流动相:A为甲醇,B为去离子水,梯度洗脱,起始流动相为纯水,线性递增10 min,使甲醇体积分数从0增至100% A,后运行5 min,使甲醇体积分数由100%线性递减至0。流速为1 mL/min,柱温30 ℃,进样量20 μL,检测器DAD,检测波长358 nm和280 nm。
5)用高效液相色谱检测洗脱产物
根据洗脱曲线选择吸光度变化处的洗脱液进行HPLC检测,观察各个洗脱液的HPLC图谱,若图谱中有若干个较大的峰,说明此阶段的洗脱液为混合物,各物质没有得到很好的分离;若HPLC图谱中只有一个峰,说明所检测的洗脱液中只有一种物质,得到了单体化合物,可进行接下来的结构鉴定。本实验仅选用单体化合物的HPLC图谱,化合物分离不成功的洗脱液HPLC图谱不再展示。
1.3.2 苹果黄酮的结构鉴定
1.3.2.1 颜色鉴定
取适量的样品溶液,分别与浓硫酸、醋酸镁、三氯化铝、三氯化铁、盐酸-锌粉、氢氧化钠和硼氢化钠溶液反应,观察颜色变化,并照射紫外灯,观察荧光反应。
1.3.2.2 紫外光谱扫描
取适量样液,加入位移剂:甲醇钠、乙酸钠、乙酸钠和硼酸、三氯化铝和三氯化铝与盐酸,在200~450nm区间进行扫描。
1.3.3 苹果黄酮的抗油脂氧化性实验
抗油脂氧化实验设计两组,一组为动物油新炼制猪油,一组为植物油芝麻油。准确称取50.0g油脂数份,置于100mL的烧杯中,分别以油质量0.02%的量添加黄酮样品、芦丁、BHT,并设置空白对照。放置在(60±1)℃烘箱中,每12h振荡1次,并交换在烘箱中的位置。定期测定过氧化值(peroxide value,POV),测定方法采用GB/T 5538—2005/ISO 3960:2001《动植物油脂过氧化值测定》。
2 结果与分析
2.1 Sephadex LH-20葡聚糖凝胶柱纯化
由图1可知,主要出峰点集中30%甲醇部分(6~13管)和洗脱体积分数从60%变化至100%的部分(27~54管),根据其吸光度A510nm的变化,选择第5、8、13、15、17、20、23、29、33、36、39、42、45、49、53、57、61、65、70、72管进高效液相,检测分离情况。

图1 Sephadex LH-20的动态洗脱曲线Fig.1 Dynamic elution curves on Sephadex LH-20
2.2 HPLC检测结果

图2 标准样品的HPLC色谱Fig.2 HPLC chromatogram of standard samples at 280 and 358 nm
图2 是芦丁标品和二氢查尔酮标品的色谱图,通过扫描得到芦丁的最大吸收峰在256 nm和358 nm,二氢查尔酮的最大吸收峰在280 nm,因此选择280 nm和358 nm为HPLC的检测波长。二氢查尔酮的保留时间为8.982 min,上样液的高效液相色谱图显示粗黄酮中仅含有微量的二氢查尔酮;芦丁标品的保留时间是8.335 min,上样液HPLC色谱图(图3)显示在保留时间8.333 min处有芦丁的吸收峰,说明苹果粗黄酮中含有一定量的芦丁。

图3 上样液在检测波长280nm(a)和358nm(b)的HPLC色谱Fig.3 HPLC chromatogram of flavonoid extract at 280 (a) and 358 nm (b)

图4 洗脱产物A在检测波长280nm(a)和358nm(b)的HPLC色谱Fig.4 HPLC chromatogram of flavonoid extract A at 280 (a) and 358 nm (b)
根据Sephadex LH-20的动态洗脱曲线的筛选结果进行HPLC检测,成功分离两种单品,化合物A(保留时间5.033min,图4)与化合物B(保留时间7.890min,图5)。结合图1可知,化合物A主要集中在8~13管,化合物B集中在33~36管。本实验采用的是甲醇-水体系,进行反相洗脱,利用Sephadex LH-20葡聚糖凝胶的反相分配作用[13],根据极性大小对混合物进行分离,极性越小洗脱下来的时间越长,化合物A在Sephadex LH-20葡聚糖凝胶柱中保留性弱最先被洗脱出来,以此可推测化合物A的极性更大。

图5 洗脱产物B在检测波长280nm(a)和358nm(b)的HPLC色谱Fig.5 HPLC chromatogram of extract B at 280 nm (a) and 358nm(b)

图6 化合物A的紫外光谱Fig.6 UV spectrum of compound A
分析图6化合物A的紫外光谱图可知化合物A有两个较强吸收峰,其中一个出现在210~220 nm,一个出现在330 nm,在250 nm和300 nm有两个肩峰,与黄酮的特征吸收峰不符,但与绿原酸[14]紫外光谱图完全相同,可基本判断化合物A为绿原酸,属于酚类物质,不属于黄酮类物质,接下来将不在对化合物A做具体的结构分析与抗氧化实验。
图7为化合物B的紫外光谱图,化合物B的紫外图谱在250 nm和360 nm处有强吸收峰,是黄酮类化合物图谱的特点[15],可以基本判定化合物B为黄酮类化合物。重复1.3.2.1节操作,收集33~36 管洗脱液,进行HPLC检测,减压浓缩,冷冻干燥,得23.6 mg黄酮类化合物B,利用高效液相面积归一法测其纯度为88.448%。
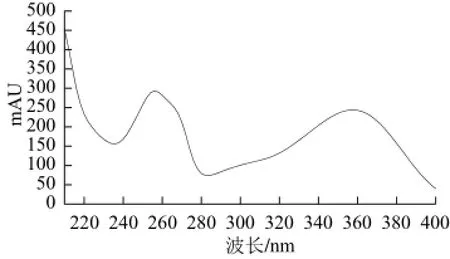
图7 化合物B的紫外光谱Fig.7 UV spectrum of compound B
Sephadex LH-20的动态洗脱曲线显示在5~15管,用硝酸铝法检测黄酮含量很高,HPLC检测结果却表明5~15管中含有的主要物质不是黄酮而是多酚类物质绿原酸。硝酸铝法检测黄酮的原理:在碱性条件下,Al3+与黄酮母核中无取代的邻二酚羟基发生络合反应。但绿原酸为多酚酸含有邻二酚羟基,亦可与Al3+形成稳定的结构;本实验硝酸铝法测黄酮选用的标准品为芦丁,其相对分子质量为610.52,绿原酸的相对分子质量354.31,即同样质量的两种物质,绿原酸提供邻二酚羟基的量几乎是芦丁的1.72倍,绿原酸对测定结果产生大于50%的正性干扰[16]。粗黄酮的检测纯度高达93.29%也是由于绿原酸的干扰。在应用硝酸铝法测黄酮时必须排除邻二酚羟基化合物对结果的影响。
2.3 化合物B结构鉴定
2.3.1 颜色鉴定

表1 颜色反应实验结果Table1 Results of color reaction
由表1可以初步判定化合物B为黄酮醇类化合物[17]。
2.3.2 紫外光谱鉴定
分析表2化合物B加入位移剂的紫外扫描结果,可知化合物B在甲醇中的紫外光谱吸收峰为351 nm和273 nm,属于黄酮醇的典型吸收峰;甲醇钠属于强碱,可以使黄酮类化合物母核上所有的羟基均离子化,带Ⅰ红移51 nm,吸收带随时间延长没有发生变化,应有4’-OH或7-OH;乙酸钠为弱碱性,只有较强的酚羟基会被离子化[18],带Ⅱ红移5 nm,应含有7-OH;乙酸钠-硼酸使带Ⅰ红移10 nm,可推测B环上有邻二酚羟基,带Ⅱ红移5 nm,应有6,7-2OH或7,8-2OH;氯化铝可与黄酮母核上的羟基形成不稳定的络合物,使带Ⅰ红移49 nm,加盐酸后解离,红移消失,则说明A、B环上同时有邻二酚羟基[19]。综合以上分析,化合物B为黄酮醇,确定在黄酮母核的3位置上有羟基取代,围绕4’和7位置有邻二酚羟基。

表2 化合物B的紫外扫描结果Table2 UV-Visible spectral data of compound B
2.4 化合物B油脂抗氧化性
在猪油和芝麻油中按油质量的0.02%添加各种各种抗氧化剂(芦丁、BHT、化合物B),混合均匀后按GB/T 5538—2005《动植物油脂过氧化值测定》测定油脂的过氧化值,空白组、芦丁组和BHT组设有3组平行实验,化合物B由于提取的含量极少,只有一组数据,未设平行组,结果见图8。

图8 不同抗氧化剂对油脂抗氧化活性的比较Fig.8 Comparison of inhibitory activity of different antioxidants on lipid oxidation
由图8可知,对于猪油组,各抗氧化剂表现出不同的抗氧化活性,BHT干扰游离基反应,可以有效清除自由基[20],对猪油的氧化酸败有强烈的抑制作用,25d时过氧化值基本保持不变;黄酮类化合物是作为金属离子络合物来抑制油脂的自动氧化,芦丁不能与金属离子络合,因此并不能抑制猪油的氧化酸败,在油脂氧化酸败的诱导期,与空白组差别不大,到传播期,过氧化值迅速增加,超过空白组;从苹果中提取的黄酮单体化合物B对猪油的氧化酸败有明显的抑制作用但效果不如BHT,化合物B与油脂中的金属离子结合,降低了油脂中过氧化物的产生速率。对于芝麻油组,抗氧化剂与空白对照组的POV值差别很小,体现出的抗氧化作用BHT>化合物B>芦丁。在相同的条件下芝麻油的氧化酸败速率明显低于猪油油脂,在芝麻油中添加油脂抗氧化剂没有实际意义,这应与芝麻油中含有较多天然抗氧化剂VE、芝麻酚、芝麻素[21]有关。
从苹果中提取的黄酮单体化合物B与芦丁的抗油脂氧化性有显著的差异,从结构上分析,两者在B环上均有一个邻二酚结构,但芦丁的A环为间二酚结构,化合物B为邻二酚结构。在羟基数相同的情况下,邻二酚结构的抗氧化能力强于间二酚结构[22],且A环邻二酚羟基结构可以降低C环对A环的钝化作用,使得化合物B仅就A环的抗氧化能力高于芦丁;同时C环芦丁的3-OH被芸香糖取代,黄酮类化合物在阻止油脂自动氧化时,3-OH起决定性作用[23],可联合4位羧基与金属离子形成稳定的螯合物,芦丁没有3-OH结构,表现出较差的抗油脂氧化能力。化合物B作为黄酮醇类物质,3-OH与油脂中的金属离子形成稳定的络合物,使金属离子失去对油脂氧化的催化作用,但不能消耗自由基,可以延长油脂自动氧化的诱导期,并不能有效抑制油脂氧化。
3 结 论
粗黄酮提取物中含有一定量的绿原酸,用硝酸铝法测其黄酮纯度并不准确,利用Sephadex LH-20可以成功的把绿原酸与苹果黄酮分离,并得到一个黄酮单体。利用不同浓度的甲醇溶液进行梯度洗脱的方法,不能将提取物中所有的黄酮单体都进行分离,如果要得到更多种类的黄酮单体,必须调整洗脱条件,利用不同的洗脱剂,做进一步的探索。
通过6个黄酮颜色鉴定反应,初步确定得到的黄酮单体为黄酮醇,利用5种位移剂对黄酮单体紫外光谱图的影响,推测化合物B为黄酮醇,确定在黄酮母核的3位置上有羟基取代,围绕4’和7位置有邻二酚羟基。
从苹果黄酮中分离得到的单体化合物B抗油脂氧化能力远不如BHT,提取成本高,但安全性高,对人体也有一定的保健功能,在没有改善提纯工艺时并不适宜作普通油脂的抗氧化剂,可考虑在某些特殊保健品中添加;粗提物中含有较多绿原酸,绿原酸的抗油脂氧化能力强于BHT,可考虑利用苹果黄酮的粗提物,进行油脂天然抗氧化剂的研究。
[1] 张洪胜, 王凤娟. 基于FAO最新数据分析看我国苹果产业的发展态势[J]. 山东林业科技, 2012, 42(4): 98-99; 97.
[2] 杨杰. 2011年中国苹果产销形势分析[J]. 烟台果树, 2011(4): 11-12.
[3] RONG T, YANG R, YOUNG J C, et al. Polyphenolic profiles in eight apple cultivars using high-performance liquid chromatography (HPLC)[J]. Journal of Agricultural and Food Chemistry, 2003, 51(21): 6347-6353.
[4] MILLER N J, DIPLOCK A T, RICE-EVANS C A. Evaluation of the total antioxidant activity as a marker of the deterioration of applejuice on storage[J]. Journal of Agricultural and Food Chemistry, 1995, 43(7): 1794-1801.
[5] TOREL J, CILLARD P. Antioxidant activity of f avonoids and reactivity with peroxy radical[J]. Phytochemistry, 1986, 25(2): 383-385.
[6] CASSIDY C E, SETZER W N. Cancer-relevant biochemical targets of cytotoxic Lonchocarpus f avonoids: a molecular docking analysis[J]. Journal of Molecular Modeling, 2010, 16(2): 311-326.
[7] GRICE H C. Safety evaluation of butylated hydroxyanisole from the perspective of effects on forestomach and oesophageal squamous epithelium[J]. Food and Chemical Toxicology, 1988, 26(8): 717-723.
[8] CHEN Chihoung, PEARSON A M, GRAY J I. Effects of synthetic antioxidants (BHA, BHT and PG) on the mutagenicity of IQ-like compounds[J]. Food Chemistry, 1992, 43(3): 177-183.
[9] 王英, 张玉刚, 戴洪义. 苹果果皮中类黄酮的超声波辅助提取及稳定性研究[J]. 食品科学, 2011, 32(16): 178-181.
[10] 李超, 王乃馨, 郑义, 等. AB-8型大孔吸附树脂分离纯化大叶金花草总黄酮[J]. 食品科学, 2011, 32(16): 31-35.
[11] 冉靓, 武子敬, 冉阳, 等. 大孔吸附树脂纯化板栗壳总黄酮的研究[J].安徽农业科学, 2013, 41(2): 827-829.
[12] 王英, 张玉刚, 戴洪义. 大孔树脂提纯苹果类黄酮的研究[J]. 食品与发酵工业, 2010, 36(11): 166-170.
[13] YANG Changjun, LI Daxiang, WAN Xiaochun. Combination of HSCCC and Sephadex LH-20 methods an approach to isolation of the main individual thesflavins from black tea[J]. Journal of Chromatography B-analytical Technologies in the Biomedical and Life Sciences, 2008, 861(1): 140-144.
[14] 李娜, 高晓燕, 范强, 等. 金银花提取液中绿原酸的快速定量[J]. 中国中药杂志, 2007, 32(4): 312-314.
[15] 田燕. 紫外-可见光谱在黄酮类鉴定中的应用[J]. 大连医科大学学报, 2002, 24(3): 213-214.
[16] 尉芹, 王冬梅, 马希汉, 等. 杜仲叶总黄酮含量测定方法研究[J]. 西北农林科技大学学报: 自然科学版, 2001, 29(5): 119-123.
[17] 唐浩国, 李市场, 李叶. 黄酮类化合物研究[M]. 北京: 科学出版社, 2009: 172-173.
[18] HARBOME J B, KEN M R, TOM M J, et al. 黄酮类化合物[M]. 戴伦凯, 谢玉如. 译. 北京: 科学出版社, 1983: 51-70.
[19] 郭珍. 紫外光谱在天然产物结构鉴定中的应用[J]. 光谱实验室, 2006, 23(3): 594-597.
[20] 李银聪, 阚建全, 柳中. 食品抗氧化剂作用机理及天然抗氧化剂[J].中国食物与营养, 2011, 17(2): 24-26.
[21] 刘玉兰, 陈刘杨, 汪学德, 等. 芝麻品种和制油工艺对芝麻油品质的影响[J]. 中国油脂, 2010, 35(2): 6-10.
[22] 张红雨. 黄酮类抗氧化剂结构活性关系的理论解释[J]. 中国科学: B辑, 1999, 29(1): 91-96.
[23] 冯涛, 庄海宁. 黄酮类化合物结构特征与抗氧化性关系研究进展[J].粮食与油脂, 2008(10): 8-11.
Purification and Antioxidant Activities of Flavonoids from Apple
YAO Hong-juan, TANG Hao-guo*, GUO Jie-zhi, ZHANG Yan-mei
(College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471023, China)
Two monomer compounds, namely A and B, respectively, were purified on Sephadex LH-20 column by gradient elution with aqueous methanol at a flow rate of 0.8 mL/min from crude flavonoids extracted from apple and chromatographed on a macroporous resin column. High performance liquid chromatograph (HPLC) was employed to identify the monomers with a mobile phase consisting of methanol-water using diode array detector. The detection wavelengths were 280 and 358 nm. The results showed that compound A was chlorogenic acid and compound B was another flavonoid. The structure of compound B was identified by color reaction and UV spectroscopy as a flavonol with 7-bit and 4’o-diphenol structure. Based on peroxide value (POV), the antioxidant capacity of compound B, rutin and BHT were measured by oven-storage method. The effects of these three substances on sesame oil auto-oxidation were not obvious. The oxidative rancidity of lard could be prevented in the presence of either butylated hydroxy toluene or compound B. The decreasing order of the antioxidant capacit y of these three substances was BHT > compound B > rutin.
apple; flavonoids; isolation; purification; inhibition of lipid oxidation
TS201.2
A
1002-6630(2014)11-0083-06
10.7506/spkx1002-6 630-201411017
2013-10-30
姚红娟(1988—),女,硕士研究生,研究方向为食品科学。E-mail:347513986@qq.com
*通信作者:唐浩国(1968—),男,教授,博士,研究方向为食品化学与营养学、食品生物技术和天然产物开发等。E-mail:tanghaoguo@126.com

