丹皮酚对结肠癌细胞系LoVo细胞增殖、凋亡的影响及其机制
李 明 谭诗云
武汉大学人民医院消化内科,湖北武汉 430060
研究表明,非甾体类消炎药(non-steroid anti-in-flammatory drugs,NSAIDs)能降低结肠癌的发生,减少家族性结肠息肉患者息肉数量和大小,并能预防结肠腺瘤的复发[1]。本室前期研究显示[2]乙酰水杨酸能抑制结肠癌细胞系环氧合酶-2(COX-2)表达而抑制生长,并诱导细胞凋亡。 但临床研究表明长期应用NSAIDs可引起胃溃疡甚至胃出血及一系列心血管不良反应,限制了其在临床上的广泛应用。 因此寻找毒性小,而又能有效的抑制COX-2 的抑制剂, 是大肠癌化学预防的重要课题。
丹皮酚具有与非甾体类抗炎药相似的药理作用,包括解热镇痛、抗炎、免疫调节、抑制血小板聚集、抗血栓形成和中枢抑制作用等,且其副作用小。 课题组前期[3-5]观察了丹皮酚对大肠癌HT-29 细胞凋亡及凋亡相关基因的影响,发现丹皮酚可抑制大肠癌细胞的增殖生长, 调节凋亡相关基因如Bcl-2、Bax、Fas 及p53 等的表达,且丹皮酚能够影响肿瘤细胞的生长周期,并与5-Fu 具有协同作用。丹皮酚与非甾体类抗炎药均能有效下调COX-2 的表达量, 从而发挥抗肿瘤作用。本研究在此基础上进一步探讨了丹皮酚对人结肠癌LoVo 细胞内Ca2+含量及RUNX-3 基因的影响。
1 资料与方法
1.1 细胞及试剂
人结肠癌细胞系LoVo 细胞购于中国科学院上海细胞库; 丹皮酚注射液购于宁波天真制药有限公司,纯度≥99.9%;AnnexinV/PI 试剂盒购于BENDER 公司;CCK-8 试剂盒购自碧云天生物技术研究所;胎牛血清、DMEM/F12 培养基、DEPC 购于杭州四季青生物材料研究所;Fluo-3/AM 购于日本同仁化学研究所;Trizol 试剂、DEPC、异丙醇、氯仿、RT-PCR 试剂盒等购于武汉谷歌生物技术有限公司;RUNX-3 单克隆抗体购自Cell Signaling Technology 公司;辣根酶标记兔抗山羊IgG 购自武汉博士德生物科技有限公司。
1.2 细胞培养
LoVo 细胞培养于含10%小牛血清的DMEM/F12培养液中,置于37℃,饱和湿度,5%CO2培养箱培养,每2~3 天传代1 次,取对数生长期细胞用于实验。
1.3 CCK-8 比色法检测丹皮酚对LoVo 细胞活力的影响
取对数生长期的LoVo 细胞,以5×104/mL 的浓度接种于96 孔板,每孔200 μL,待细胞贴壁后分组,丹皮酚组加入丹皮酚终浓度分别为15.63、31.25、62.50、125、250 mg/L 的培养液,对照组加入等量的培养液。 每组设5 个复孔,分别培养24、48、72、96 h,实验终止前2 h 每孔加入CKK-8 试剂20 μL,孵育2 h,酶标仪测定450 nm 处的吸光值,即A 值,细胞存活率=处理组A 值/对照组A 值×100%。
1.4 细胞形态的观察
取对数生长期LoVo 细胞消化传代并培养24 h后,换丹皮酚终浓度为15.63~250 mg/L 的培养液连续培养24、48、72 h 后置于显微镜下观察细胞生长情况。
1.5 流式细胞仪检测丹皮酚对LoVo 细胞凋亡率的影响
取对数生长期的LoVo 细胞, 以1×106/mL 浓度接种于6 孔培养板中, 贴壁后分为实验组和对照组,实验组分别加入含丹皮酚(终浓度为31.25、62.50、125 mg/L)的培养液,对照组加入等量培养液,培养48 h后,收集细胞,离心、洗涤、固定后加入AnnexinV-FITC和PI 染色。 筛网过滤送流式细胞仪检测细胞凋亡率。
1.6 激光扫描共聚焦显微镜检测丹皮酚对LoVo 细胞内Ca2+浓度的影响
取对数生长期的LoVo 细胞,以1×106/mL 接种于特制培养皿中,分组及处理同上,培养48 h 后,HBSS液洗涤3 次, 加入浓度为5 μmol/L 的Fluo-3/AM 工作液300 μL,孵育60 min,用HBSS 液洗涤3 次,加入HBSS 液覆盖细胞,孵育30 min。 置于激光扫描共聚焦显微镜上检测,随机选取5 个视野(放大100倍),每个视野随机选取7 个细胞,利用随机软件测定其荧光强度。 其荧光强度与细胞内Ca2+浓度成正相关,可准确反映细胞内Ca2+浓度的变化。
1.7 RT-PCR 法检测丹皮酚对LoVo 细胞RUNX-3 mRNA 的影响
细胞接种及分组同上,培养48 h 后,收集细胞,按Trizol 试剂说明书一步法提取总RNA, 计算出RNA 浓度,按RT 试剂盒操作说明合成cDNA,并进行聚合酶链反应(PCR)。 PCR 反应条件:94℃4min;94℃30 s,51℃30 s,72℃25 s;30 cycles,72℃4 min。取5 μL PCR 产物进行2%琼脂糖凝胶电泳, 紫外光下观察并拍照。 RT-PCR 采用的β-actin 及RUNX3引物由南京金瑞斯合成,RUNX3 上游引物为5'-CAGAAGCTGGAGGACCAGAC-3',下游引物为5'-TCGGAGAATGGGTTCAGTTC-3',β-actin 上游引物为5'-CACGATGGAGGGGCCGGACTCATC-3', 下游引物为5'-TAAAGACCTCTATGCCAACACAGT-3', 扩增片段长度分别为179 bp 和240 bp,β-actin 为内参。
1.8 Western blot 检测丹皮酚对LoVo 细胞RUNX-3蛋白表达的影响
细胞接种及分组同上,收集细胞,用磷酸盐缓冲液(PBS)漂洗,参照细胞浆蛋白抽提试剂盒说明书进行操作,提取细胞总蛋白,并测定蛋白浓度,蛋白样品加入1/5 体积的5×上样缓冲液,沸水煮沸5 min 后离心,以每孔20 μg/孔上样,行10%SDS-聚丙烯酰胺凝胶电泳,然后电转至PVDF 膜上,用5%脱脂奶粉室温封闭1 h, 加入1∶1000 稀释的兔抗人RUNX-3 蛋白,4℃过夜,β-actin 作为内参,TBST 洗膜3 次,加入1∶1000稀释的辣根酶标记的兔抗山羊IgG,室温孵育2 h,同样洗膜3 次,ECL 显色,观察各条带深浅变化。
1.9 统计学方法
采用统计软件SPSS 17.0 对数据进行分析, 正态分布计量资料以均数±标准差(±s)表示,多组间比较采用方差分析, 两两比较采用LSD-t 检验。 以P <0.05 为差异有统计学意义。
2 结果
2.1 丹皮酚对LoVo 细胞活力的影响
丹皮酚在15.63~250 mg/L 浓度范围内均能有效降低结肠癌LoVo 细胞的生存率,在相同处理时间,随着药物浓度的增加,细胞生存率逐渐降低;同一药物浓度,随着作用时间的延长,细胞生存率也逐渐降低,即呈显著的剂量和时间依赖效应, 与对照组比较,差异均有统计学意义(P < 0. 05)。 见图1。

图1 丹皮酚对LoVo 细胞增殖的影响(n = 5)
2.2 细胞形态学观察
倒置显微镜下可见对照组细胞生长旺盛,折光率较高,胞体大,形态成梭形或多边形,胞质均匀透明,随培养时间延长变化不大。 实验组细胞增殖减慢,且随着丹皮酚浓度的增大和作用时间的延长,细胞逐渐变小、变圆,折光率减弱,核浓缩等,部分脱落漂浮于培养瓶中,但细胞膜完整,最后裂解。 丹皮酚浓度越高,作用时间越长,上述表现越明显,漂浮细胞越多。
250 mg/L 丹皮酚组可见大量悬浮的细胞碎片。
2.3 丹皮酚对LoVo 细胞凋亡率的影响
流式细胞仪检测结果显示,丹皮酚浓度为0 mg/L时,细胞凋亡率为(2.3±0.9)%;丹皮酚浓度分别为31.25、62.50、125 mg/L 作用 细胞48 h 后, 凋亡率分别为(12.3±1.3)%、(22.4±1.5)%、(36.2±2.1)%, 与对照组[(2.3±0.9)%]比较,差异有统计学意义(P < 0.05),表明丹皮酚能诱导LoVo 细胞凋亡。 见图2。
2.4 丹皮酚对LoVo 细胞内Ca2+含量的影响
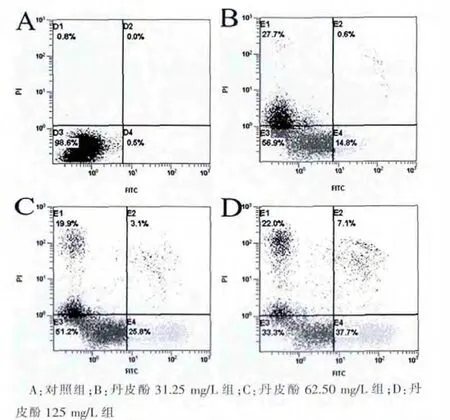
图2 丹皮酚对细胞凋亡率的影响
钙离子荧光剂Fluo-3/AM 能特异性与Ca2+结合,本研究所测的荧光强度反映的是细胞内Ca2+含量的相对水平,并不代表实际细胞内Ca2+含量。 如图3 所示, 丹皮酚作用后人结肠癌LoVo 细胞内Ca2+荧光强度明显增强,且随着浓度的升高而增强。 图像分析结果显示,对照组(丹皮酚浓度为0 mg/L)细胞内游离Ca2+荧光强度为 (24.45±3.74), 丹皮酚浓度分别为31.25、62.50、125 mg/L 时作用LoVo 细胞48 h 后,荧光强度分别为(41.36±4.62),(57.51±3.83)和(69.43±3.76);丹皮酚组与对照组比较,差异均有统计学意义(P < 0.05)。 见图3。
2.5 丹皮酚对LoVo 细胞RUNX-3 mRNA 表达的影响
琼脂糖凝胶电泳结果显示,RUNX-3 基因的扩增产物条带为179 bp, 内参β-actin 条带为240 bp,与所设计的片段大小一致, 丹皮酚处理人结肠癌LoVo细胞48 h 后,RUNX-3 基因的表达均上调,且随药物浓度的升高,LoVo 细胞RUNX-3 基因的表达量亦升高,呈明显剂量依赖效应。 见图4。
2.6 丹皮酚对RUNX-3 蛋白表达的影响
丹皮酚处理LoVo 细胞48 h 后,结果显示随着丹皮酚浓度的升高,RUNX-3 蛋白表达量也逐渐升高。见图5。
3 讨论
细胞凋亡是维持多细胞机体平衡的一个重要生理机制,细胞凋亡与细胞增殖之间的平衡在结肠癌发生发展中起重要作用[6],细胞凋亡是程序化、多基因调控的细胞死亡过程,通过诱导细胞凋亡已经成为抗肿瘤研究的热点。 有研究证实,丹皮酚在体内外均能抑制多种肿瘤细胞的增殖生长并诱导细胞凋亡[7-8]。本研究发现,丹皮酚在15.63~250 mg/L 浓度范围,对人结肠癌LoVo 细胞的增殖均有抑制作用, 随着药物浓度的升高和作用时间的延长,抑制细胞增殖的作用亦逐步增强,呈现明显的浓度效应及时间效应关系。 丹皮酚处理人结肠癌LoVo 细胞后, 在倒置显微镜下均可见到凋亡细胞的形态;流式细胞仪检测其细胞凋亡率随着药物浓度的增加而升高, 呈明显的剂量依赖效应, 表明丹皮酚可抑制结肠癌LoVo 细胞的增殖及诱导其发生凋亡。

图3 激光共聚焦显微镜检测丹皮酚对LoVo [Ca2+]i 的影响

图4 丹皮酚对LoVo 细胞RUNX3 mRNA 表达的影响

图5 Western blot 检测丹皮酚对LoVo 细胞RUNX3 蛋白表达的影响
细胞内Ca2+广泛参与细胞的增殖、分化、运动及凋亡等病理生理过程[9],钙离子在诱导细胞凋亡中的重要作用已经有大量实验证实[10],研究显示,在细胞凋亡早期和晚期阶段细胞内Ca2+均增加, 细胞内Ca2+浓度升高被认为是细胞凋亡的启动环节[11]。 本研究发现丹皮酚处理后,LoVo 细胞内Ca2+荧光强度均明显增强,且随着药物浓度的升高而增强,呈明显的剂量效应关系,与对照组比较,有显著差异性(P < 0.05)。LoVo 细胞内Ca2+含量的增加与细胞凋亡率呈平行关系, 且这种效应随着药物浓度的增加而增强。 提示LoVo 细胞内Ca2+含量增多与药物作用有关,表明Ca2+升高在丹皮酚抑制肿瘤细胞生长和诱导细胞凋亡机制中可能起重要作用,提示调节细胞内Ca2+含量从而抑制结肠癌细胞增殖及诱导其凋亡可能是其作用机制之一。 因此,增加细胞内Ca2+含量可能成为结肠癌治疗的一个作用靶点。 丹皮酚具体参与Ca2+通道运输系统的调控及丹皮酚诱导细胞凋亡的信号通路还需进一步研究。
此外,本研究还发现,丹皮酚能上调LoVo 细胞中人类相关转录因子3(human runt-related transcription factor 3,RUNX3)基因表达,且表达量随着药物浓度的升高而增加,呈明显浓度效应。大量研究证明,转录生长因子-β (transforming growth factor,TGF-β)和Wnt 信号通路在肿瘤的发生发展过程中发挥着重要作用[12-13]。 RUNX3 参与TGF-β 信号通路诱导生长抑制的过程[14]。 研究证实,RUNX3 基因在多种肿瘤如乳腺癌、胃癌、大肠癌、肝癌及肺癌等肿瘤中表达下调甚至缺失,在肿瘤的发生发展中起重要作用[15-16]。有证据表明,恢复RUNX3 基因的表达能通过诱导细胞凋亡、调节细胞周期及下调cyclin D1 的表达而显著抑制肿瘤细胞增殖及转移[17-18]。本研究发现,丹皮酚能抑制肿瘤细胞向G1期行进和G1/S 转换 (结果待发)。 并且RUNX3 基因表达上调趋势与流式细胞仪检测的凋亡率增升高趋势是一致的。 因此,推测丹皮酚能通过上调RUNX3 基因表达影响细胞周期促进细胞凋亡,进而发挥抗肿瘤作用。
本研究还发现, 经丹皮酚处理后,LoVo 细胞内Ca2+含量与RUNX3 基因表达均升高, 即丹皮酚一方面能增加细胞内Ca2+含量, 另一方面又能促进RUNX3 基因表达, 表明两者可能处于同一条信号转导通路上。 研究表明,细胞内Ca2+含量增加参与包括基因转录及细胞凋亡在内的多种生物反应过程[19-20],提示细胞内Ca2+含量与RUNX3 基因相互协调抑制结肠癌细胞增殖及诱导细胞凋亡。丹皮酚能有效抑制结肠癌细胞增殖并诱导细胞凋亡,增加细胞内Ca2+含量及上调RUNX3 基因的表达。 由此推测,丹皮酚和阿司匹林可能通过增加细胞内Ca2+含量, 上调LoVo 细胞RUNX3 基因的表达,恢复了TGF-β 信号通路生理功能,并抑制了Wnt 信号通路,抑制LoVo 细胞增殖并促进肿瘤细胞凋亡,从而发挥抗肿瘤作用。
肿瘤的凋亡是一个复杂而又精确调控的网络系统,Ca2+含量与RUNX3 基因之间相关信号通道,是下一步要进行的工作。
[1] Cooper K,Squires H,Carroll C,et al. Chemoprevention of colorectal cancer:systematic review and economic evaluation [J]. Health Technol Assess,2010,14(32):1-206.
[2] Yu HG,Huang JA,Yang YN,et al. The effect of acetylsalicylic acid on proliferation,apoptosis,and invasion of cyclooxygenase-2 negative colon cancer cells [J]. Eur J Clin Invest,2002,32(11):838-846.
[3] 计春燕,谭诗云,刘长青,等.丹皮酚对人结肠癌HT-29细胞增殖、凋亡及其分子机制[J].世界华人消化杂志,2008,16(1):33-38.
[4] 刘长青,谭诗云,计春燕.丹皮酚对大肠癌HT-29 细胞增殖抑制作用及其机制的探讨[J].中国药理学通报,2005,21(10):1251-1254.
[5] 叶俊梅,谭诗云,刘长青.丹皮酚和塞来昔布对大肠癌环氧合酶-2 和p27 蛋白表达的影响[J].中华消化杂志,2006,26(10):707-708.
[6] LaCasse EC,Mahoney DJ,Cheung HH,et al. IAP-targeted therapies for cancer [J]. Oncogene,2008,27(28):6252-6275.
[7] Chen B,Ning M,Yang G. Effect of paeonol on antioxidant and immune regulatory activity in hepatocellular carcinoma rats [J]. Molecules,2012,17(4):4672-4683.
[8] Lee HJ,Kim SA,Lee HJ,et al.Paeonol oxime inhibits bFGFinduced angiogenesis and reduces VEGF levels in fibrosarcoma cells [J]. PLoS One,2010,5(8):12358.
[9] Yi M,Zhao Q,Tang J,et al.A theoretical modeling for frequency modulation of Ca2+signal on activation of MAPK cascade[J].Biophysical Chemistry,2011,157(1-3):33-42.
[10] 黄雪雪,刘延一,谢虹,等.细胞外钙离子选择性诱导肝癌HepG2 死亡[J].中华疾病控制杂志,2012,16(7):633-635.
[11] Andrea R,Paolo B. Mitochondrial permeability transition in Ca2+-dependent apoptosis and necrosis [J]. Cell Calcium,2011,50(3):222-233.
[12] Calone I,Souchelnytskyi S. Inhibition of TGF-β Signaling and its implications in anticancer treatments [J]. Exp Oncol,2012,34(1):9-16.
[13] Liu LC,Tsao TC,Hsu SR,et al.EGCG inhibits Transforming Growth Factor-β-mediated Epithelial-to-Mesenchymal Transition via inhibition of Smads and Erk1/2 Signaling Pathways in Non-small Cell Lung Cancer Cells[J]. J Agric Food Chem,2012,60(39):9863-9873.
[14] Watanabe K,Sugai M,Nambu Y,et al. Requirement for RUNX proteins in IgA class awitching acting downstream of TGF-beta 1 and retinoic acid signaling [J]. J Immunol,2010,184(6):2785-2792.
[15] Jeong P,Min BD,Ha YS,et al. Runx3 methylation in normal surrounding urothelium of patients with non-muscle-invasive bladder cancer:Potential role in the prediction of tumor progression [J]. Eur J Surg Oncol,2012,38(11):1095-1100.
[16] Shiraha H,Nishina S,Yamamoto K. Loss of runt-related transcription factor 3 causes development and progression of hepatocellular carcinoma[J].J Cell Biochem,2011,112(3):745-749.
[17] Chi XZ,Yang JO,Lee KY,et al.RUNX3 suppresses gastric epithelial cell growth by inducing p21(WAF1/Cip1)expression in cooperation with transforming growth factor{beta}-activated SMAD [J]. Mol. Cell Biol,2005,25(18):8097-8107.
[18] Li M,Tan SY,Zhang J,et al.Effects of paeonol on intracellular calcium concentration and expression of RUNX3 in LoVo human colon cancer cells[J]. Mol Med Rep,2013,7(5):1425-1430.
[19] 王建杰,闫冬梅,董航,等.丹皮酚抑制小鼠乳腺癌细胞生长作用及机制的研究[J].中国免疫学杂志,2013,29(1):48-51.
[20] Mullera I,Lipp P,Thiel G. Ca2+signaling and gene transcription in glucose-stimulated insulinoma cells [J]. Cell Calcium,2012,52(2):137-151.

