金樱子对阿霉素心肌损伤大鼠的抗氧化和抗凋亡保护作用
罗卫民 刘越峰 罗湘玉 张 军▲
1.湖北医药学院附属十堰市太和医院心胸外科,湖北十堰 442000;2.湖北医药学院附属十堰市人民医院眼科,湖北十堰 442000
阿霉素 (Doxorubicin,DOX) 是一种广泛应用于肿瘤治疗的蒽环类抗生素。尽管其对包括白血病在内的多种恶性肿瘤具有抑制作用,但其蓄积性不可逆性心肌病以及充血性心衰限制了其使用[1]。 DOX 导致的毒性心肌病原因很多, 其中活性氧 (reactive oxygen species,ROS) 介导的心肌细胞凋亡是其重要机制之一[2]。 因此,在DOX 治疗的同时预防性使用抗氧化药物干预,有望降低其副作用[3]。 近年来,某些药用植物在心血管疾病的预防过程中具有一定的预防作用[4],金樱子为蔷薇科金樱子(Rosa Laevigata Michx.,RLM)的果实,研究发现它具有强大的抗氧化和清除自由基能力[5-6]。本研究旨在观察RLM 对DOX 诱发的心脏毒性的保护作用。
1 材料与方法
1.1 主要实验试剂
DOX 购自意大利Pharmacia 公司(批号:8NB002-A), 血清天冬氨酸转氨酶 (aspartate transaminase,AST)检测试剂盒购自Quimica Clinica Aplicada。 血清总胆固醇(total cholesterol,TC)、乳酸脱氢酶(lactate dehydrogenase,LDH)和肌酸激酶(creatine kinase,CKMB)试剂盒为Stanbio 产品。还原型谷胱甘肽(glutathione,GSH)及丙二醛(myocardial lipid peroxide,MDA)检测试剂盒购自南京建成生物技术研究所。心肌肿瘤坏死因子α(tumour necrosis factor-alpha,TNF-α)ELISA 试剂盒和caspase-3 的比色测定试剂盒购自Quantikine。 分析纯试剂主要购自Sigma-Aldrich 公司。
金樱子购于十堰市中草药材公司,经去籽后用煎药机进行熬煎。金樱子的鉴定由湖北医药学院肖胜全教授完成,其提取液浓度为2.0 g/mL。
1.2 实验分组
成年雄性Wistar 大鼠由湖北医药学院实验动物部提供,体重(250±5)g,在SPF 环境下给予标准实验室的水和食物饲养2 周。 大鼠随机分成5 组:空白对照组(8 只),大鼠接受等体积的生理盐水作为阴性对照;DOX 模型组(15 只), 大鼠连续两周每间隔48 h注射DOX(2.5 mg/kg,ip)共6 次,使其累积剂量达15 mg/kg。RLM 高、中、低剂量组(每组各30 只):在DOX模型组的基础上,大鼠每日给予RLM(1、2、5 g/kg)灌胃,DOX 停止后,持续RLM 灌胃4 周。
1.3 血清及心肌组织的获取
大鼠处理结束后, 获取血液标本,8000×g 离心10 min 获取血清用于测定TC、AST、LDH 和CK-MB。随后解剖大鼠,分离心脏,生理盐水漂洗2 次。 将心脏组织剪切,制备成20%的匀浆后,二喹啉甲酸法测定其总蛋白浓度及AST、LDH、CK-MB 活性、TC 水平(mg/dL)。
1.4 心肌MDA 测定
心脏匀浆与等体积2.3%的KCl 混合,600×g,4℃离心15 min,获取上清用于测定MDA。其原理基于脂质过氧化产物与硫代巴比妥酸发生过氧化反应,生成粉红色的有色络合物,从而用分光光度计以四甲氧基丙烷为标准品,532 nm 和520 nm 波长处测量其OD值。 结果用nmol/mg 表示。
1.5 心肌GSH 测定
将等体积的心脏匀浆和预冷7.5%5-磺酸基水杨酸缓冲液以沉淀蛋白。随后4℃,600×g 离心10 min,获取上清用于测量还原型GSH。 其原理基于还原型GSH能与5,5-二硫代双(2-硝基苯甲酸)反应,产物在421 nm波长处能形成最大吸收峰。 含量用mg/g 组织表示。
1.6 TNF-α 和caspase-3 测定
50 mg 心肌组织加入0.8 mL pH 7.4 的裂解缓冲液中制成匀浆,10 000×g,4℃离心15 min。 获取上清用于TNF-α 和caspase-3 测定。 其中TNF-α 根据试剂盒提供的步骤进行,采用固相夹心ELISA 法,四甲基联苯胺(TMB)法显色并于450 nm 波长处测量其吸光度,用pg/mg 蛋白表示。 采用间接法测定caspase-3活性,基于caspase-3 切除底物分子DEVD-pNA 中的发光基团pNA,随后在405 nm 处用测量其吸光度,用OD 值表示,从而间接反应其活性。
1.7 统计学方法
应用SPSS 17.0 软件进行统计学分析, 计量资料数据以均数±标准差(±s)表示,并采用单因素方差分析数据,行t 检验,以P < 0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠血生化指标情况
心脏功能和血脂参数显示,DOX 注射后, 血清AST、LDH、CK-MB、TC 水平显著增高。 而同时给予RLM 干预后,这些参数随着RLM 浓度的增高而不断改善,见表1。
表1 不同浓度金樱子处理对阿霉素心肌损伤大鼠血生化指标的影响(±s)

表1 不同浓度金樱子处理对阿霉素心肌损伤大鼠血生化指标的影响(±s)
注:与空白对照组比较,*P<0.05,**P<0.01;与DOX 模型组比较,#P <0.05;AST:血清天冬氨酸转氨酶;LDH:乳酸脱氢酶;TC:血清总胆固醇;CK-MB:肌酸激酶;RLM:金樱子;DOX:阿霉素
?
2.2 不同浓度RLM 对心肌DOX 处理后MDA 含量的影响
与空白对照组相比,DOX 处理组能诱导心肌MDA明显增加(P<0.01),给予不同浓度RLM 处理后,心肌MDA 含量随之降低,其中DOX+5 g/kg RLM 处理后,MDA 含量降低最多[(0.82±0.14) nmol/mg]。 见图1。

图1 RLM 对血清丙二醛含量的影响
2.3 不同浓度RLM 对DOX 心肌毒性大鼠GSH 含量的影响
与空白对照组相比,DOX 组大鼠血清总GSH 含量显著降低(P < 0.01)。而同时给予不同浓度RLM 处理后,GSH 含量随之升高。 5 g/kg RLM 处理大鼠后,GSH 含量[(1.06±0.11) pg/g]接近对照组水平(图2)。

图2 RLM 对血清还原型谷胱甘肽含量的影响
2.4 RLM 干预对大鼠血清TNF-α 含量的影响
空白对照组大鼠血清中TNF-α 含量较低,DOX处理后TNF-α 显著增高(P <0.01)。 RLM 干预能以剂量依赖性方式降低血清中TNF-α 的含量, 其中DOX+5 g/kg RLM 处 理 后,TNF-α 含 量 降 低 最 多[(3.49±0.05) pg/mg],见图3。
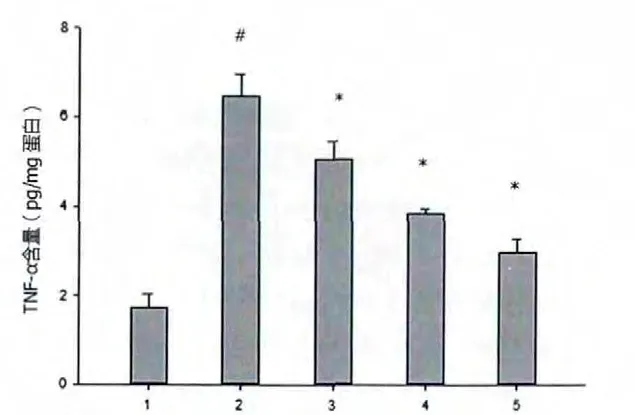
图3 RLM 对血清TNF-α 含量的影响
2.5 RLM 抑制caspase-3 活性
DOX 处理后,caspase-3 活性增加了近50%。 同时经1~5 g/kg RLM 处理后,caspase-3 活性逐渐降至正常水平, 其中DOX+5 g/kg RLM 处理后,caspase-3活性降低最多(0.83±0.02)。 见图4。
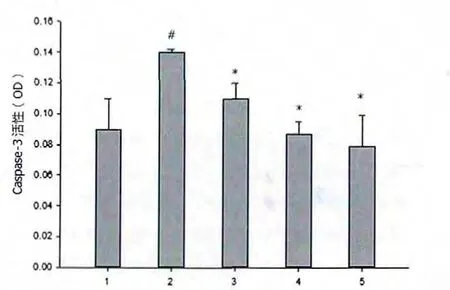
图4 RLM 对caspase-3 活性的影响
3 讨论
DOX 是一种抗肿瘤抗生素,可抑制RNA 和DNA的合成,对RNA 的抑制作用最强,抗瘤谱较广,对多种肿瘤均有作用,属周期非特异性药物,对各种生长周期的肿瘤细胞都有杀灭作用。主要适用于急性白血病, 对急性淋巴细胞白血病及粒细胞白血病均有效,一般作为第二线药物,即在首选药物耐药时可考虑应用此药。 恶性淋巴瘤, 可作为交替使用的首选药物。DOX 和其他奎宁蒽环类药物一样, 主要的毒性反应有: 白细胞和血小板减少,60%~80%的患者可发生;100%的患者有不同程度的毛发脱落, 停药后可以恢复生长;心脏毒性,表现为心律失常,ST-T 改变,多出现在停药后的1~6 个月[7]。本研究通过DOX 建立心肌毒性模型发现,血清AST、LDH 和CK-MB 显著增加,这可能是由于DOX 损伤心肌细胞膜后,AST、LDH 和CK-MB 漏出所致。 本研究还发现,DOX 还可以导致TC 含量增高,这可能是由于DOX 导致肾病综合征所致[8]。 RLM 属蔷薇科蔷薇属常绿蔓性灌木野生果树,其果实中总糖含量达24%,其中多糖含量约为金樱子果实的8.73%。 研究显示,RLM 的抗氧化能力与丁基羟基甲苯相当, 并能显著清除超氧阴离子自由基、抑制羟自由基对细胞膜的破坏而引起的溶血和脂质过氧化产物的形成,从而具有显著的抗氧化作用[9]。 此外,RLM 金樱子能减轻糖尿病肾病大鼠的氧化损伤,减少过氧化质,升高抗氧化酶活性,机制可能与干预氧化应激、抑制核因子-κB、TNF-α 表达有关。 本研究显示通过RLM 灌胃后, 大鼠的血清指标得到了显著的改善[10-13]。 同时,本研究还观察了RLM 对氧化应激的影响。 结果发现,DOX 能显著增加心肌中MDA 含量,同时显著降低GSH 水平。 这可能是DOX 导致氧化应激,大量氧自由基的产生导致GSH 减少。 脂质过氧化导致心肌细胞损伤后引起AST、LDH 和CK-MB漏出至循环系统是由于心脏损伤[14]。 口服RLM 能明显降低脂蛋白过氧化物酶而提高GSH,这表明这些药物能清除自由基和减少细胞损伤。 另一方面,氧化应激可激活p38 丝裂原激活的蛋白激酶和核因子-κB,从导致TNF-α 大量合成, 反过来加重氧化应激状态而使线粒体膜通透性发生改变,随后导致自由基和细胞色素C 从线粒体中释放到细胞质, 激活caspase-3而引起凋亡发生[15-17]。 RLM 可能通过抑制组织中的应激反应而降低心肌中TNF-α 和caspase-3 含量。
总之,本研究证实RLM 对DOX 导致的心肌损伤有保护作用,其机制可能与抗氧化、抗炎和抗凋亡有关。 在下一步研究中,笔者将对其分子机制进行进一步探讨。
[1] Gandhi H,Patel VB,Mistry N,et al. Doxorubicin mediated cardiotoxicity in rats: Protective role of felodipine on cardiac indices [J]. Environ Toxicol Pharmacol,2013,36(3):787-795.
[2] Gilliam LA,Moylan JS,Patterson EW,et al. Doxorubicin acts via mitochondrial ROS to stimulate catabolism in C2C12 myotubes [J]. Am J Physiol Cell Physiol,2012,302(1):195-202.
[3] Basu S,Ganguly A,Chakraborty P,et al. Targeting the mitochondrial pathway to induce apoptosis/necrosis through ROS by a newly developed Schiff's base to overcome MDR in cancer [J]. Biochimie,2012,94(1):166-183.
[4] Uma MB,Shrivastava S,Kuncha M,et al. Ethanolic extract of Boswellia ovalifoliolata bark and leaf attenuates Doxorubicin-induced cardiotoxicity in mice [J]. Environ Toxicol Pharmacol,2013,36(3):840-849.
[5] Jia Y,Ji L,Zhang S,et al. Total flavonoids from Rosa Laevigata Michx fruit attenuates hydrogen peroxide induced injury in human umbilical vein endothelial cells[J].Food Chem Toxicol,2012,50(9):3133-3141.
[6] 赵云涛, 国兴明,李付振. 金樱子多糖的抗氧化作用[J].云南中医中药杂志,2003,24(4):35-37.
[7] Fu Z,Guo J,Jing L,et al. Enhanced toxicity and ROS generation by Doxorubicin in primary cultures of cardiomyocytes from neonatal metallothionein-I/II null mice [J].Toxicol in Vitro,2010,24(6):1584-1591.
[8] Ai S,Zheng J,Lin Q,et al. Proteomic analysis indicates altered expression of plasma proteins in a rat nephropathy model [J]. Clin Exp Nephrol,2013,17(1):24-31.
[9] Zhang S,Zheng L,Dong D,et al. Effects of flavonoids from Rosa laevigata Michx fruit against high-fat diet-induced non-alcoholic fatty liver disease in rats [J]. Food Chem,2013,141(3):2108-2116.
[10] Zhou Y,Liao Q,Luo Y,et al. Renal protective effect of Rosa laevigata Michx. by the inhibition of oxidative stress in streptozotocin-induced diabetic rats [J].Mol Med Rep,2012,5(6):1548-1554.
[11] 赵海山,赵成建,张欢,等.甘脯酰阿霉素对斑马鱼胚胎的毒性评估[J].中国药房,2012,23(41):3882-3884.
[12] 刘焕龙,康宁,李军霞,等.戊地昔布联合阿霉素对人乳腺癌细胞增殖的抑制作用及其机制研究[J].中国药房,2012,23(29):2705-2707.
[13] 张祥林,郑石磊,董福仁,等.盐酸多西环素联合碘油对兔VX2 肝瘤凋亡、增殖及肝功能的影响研究[J].中国药房,2012,23(33):3092-3094.
[14] FirdousAP,KuttanR.Chemoprotectiveactivityofcarotenoid meso -zeaxanthin against Doxorubicin -induced cardio toxicity [J]. J Exp Ther Oncol,2012,10(2):101-106.
[15] Alkreathy HM,Damanhouri ZA,Ahmed N,et al.Mechanisms of cardioprotective effect of aged garlic extract against Doxorubicin-induced cardiotoxicity[J].Integr Cancer Ther,2012,11(4):364-370.
[16] 阿迪拉·阿扎提,赵龙,张玲,等.心肌细胞/胶原复合体移植心梗大鼠梗死周边区的电偶联网络变化[J].中国实验动物学报,2013,21(1):75-79.
[17] 仇普斌,刘超,李伟,等.诱导人脐带间充质干细胞向心肌细胞分化及对小鼠心肌梗死的治疗作用[J].中国实验动物学报,2012,20(5):9-14.

