牛血清白蛋白与花青素纳米颗粒的特性及稳定性研究
姚惠芳,董学艳,景 浩
(中国农业大学食品科学与营养工程学院,植物源功能食品北京市重点实验室,北京 100083)
牛血清白蛋白与花青素纳米颗粒的特性及稳定性研究
姚惠芳,董学艳,景 浩*
(中国农业大学食品科学与营养工程学院,植物源功能食品北京市重点实验室,北京 100083)
目的:研究牛血清白蛋白(bovine serum albumin,BSA)与花青素相互作用形成的纳米颗粒的特性,及其对花青素的氧化 稳定性的影响。方法:采用扫描透射电子 显微镜和纳米粒度仪,研究BSA与笃斯越橘花青素形成纳米颗粒的表观形态及 粒径大小,用盐析法测定BSA对花青素的结合量,并用自由基(DPPH自由基、ABTS+·)清除方法和胃肠模拟体系分别研究BSA对花青素氧化稳定性的影响。结果:BSA-花青素在磷酸盐缓冲液(pH 7.4)中能通过自组装形成纳米颗粒,其纳米颗粒较BSA的粒径变小,由30~35 nm减小到15~20 nm。BSA对花青素的结合量是每摩尔BSA分子上结合的花青素为10 mol。BSA-花青素纳米颗粒较花青素的DPPH自由基、ABTS+·清除能力明显增强。在胃模拟体系中,BSA与花青素结合对花青素稳定性没有显著性影响;在肠模拟体系中,BSA与花青素结合对花青素稳定性有显著性影响,未结合的花青素在6 h后含量降低70%左右,而有BSA结合的花青素含量几乎保持不变,表明BSA与花青素结合对花青素的氧化稳定性有明显的保护作用。
牛血清白蛋白;花青素;纳米颗粒;结合量;氧化稳定性
花青素(anthocyanin,ACN)广泛分布于蔬菜水果中,是 以2-苯基-苯并吡喃阳离子为基本结构的糖基衍生物,具有和天然类黄酮化合物一样的C6—C3—C6碳骨架和生化合成来源[1]。研究结果表明:花青素具有抗氧化[2]、抗肿瘤[3]、抗动脉粥样硬化[4]等生物学活性。但花青素的氧化稳定性较差,其活泼的酚羟基容易被氧化成醌类物质[5],降低了其生物学活性。为了克服此缺点,通过花青素与大分子物质如糖类、蛋白质等结合,可以实现增加花青素稳定性的目的。Jiménez-Aguilar等[6]报道,花青素与多糖结合,可以明显延长花青素降解时间,增加花青素的稳定性。Zheng Nan等[7]报道,在pH 8.0和80℃加热60 min的条件下,笃斯越橘中花青素提取物的吸光度及其对ABTS+·清除率明显降低,而乳清 蛋白与笃斯越橘中花青素提取物相互作用后可以有效阻止花青素的吸光度及其ABTS+·清除率的降低。
牛血清白蛋白(bovine serum albumin,BSA)是人们最早发现并对其进行研究的蛋白质载体之一,主要在牛肝细胞合成释放到血液,是血浆中含量最高的 载体蛋白。BSA蛋白样品纯度高,廉价易得;BSA能与许多内源及外源性化合物进行可逆的、特异性的非共价结合,从而起到重要的存储和转运作用[8]。所以,已被广泛应用于制备与具有生物活性小分子相互作用的模型蛋白。已有报道,蛋白类大分子可以提高小分子的稳定性[9]。Zhang Liangke等[10]研究表明BSA与叶 酸结合形成纳米颗粒,可以减少叶酸的降解。Fang Ru等[11]研究发 现BSA与槲皮素相互作用形成纳米颗粒,可以提高槲皮素的稳定性。姚惠芳等[12]研究发现BSA可以与花青素相互作用,主要是与BSA中的色氨酸残基发生相互作用,静电引力是其主要作用力,但是BSA与花青素相互作用后的物理形态及其对花青素稳定性的影响还有待进一步研究。
本实验主要研究BSA与花青素相互作用形成的纳米颗粒的特性,及其对花青素的氧化稳定性的影响。首先运用扫描透射电子显微镜和纳米粒度仪研究BSA与花青素形成纳米颗粒的表观形态及粒径大小,然后采 用盐析法测定BSA对花青素的结合量,最后用自由基(DPPH自由基、ABTS+·)清除方法和胃肠模拟体系分别研究BSA对花青素氧化稳定性的影响。
1 材料与方法
1.1 材料与试剂
牛血清白蛋白(第5组分,纯度大于98%,分子质量67 200D,Cat.: A-0332) 美国Amresco公司进口分装;笃斯越橘花青素(花青素含量为25%;进一步经过XAD-7树脂柱分离纯化,除去蛋白质和多糖,得到的笃斯越橘花青素纯化物,花青素含量为35%,其中矢车菊素-3-葡萄糖苷占总花青素含量的78.1%) 大兴安岭华野生物工程有限公司。
P7000-25G胃蛋白酶 美国Sigma公司;胰酶粉(生物纯) 北京鸿润宝顺科技有限公司;2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis(3-ethylbenzothi azoline-6-sulfonic acid) ammonium salt,ABTS)(纯度98%)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(纯度97%)美国Sigma-Aldrich公司;醋酸铀 中镜科仪(北京)膜科技有限公司;无水乙醇溶液 北京化工厂;其他试剂均为国产分析纯,所用水为去离子水。
1.2 仪器与设备
S-5500型扫描透射电子显微镜 日本Hitachi公司;铜网 中镜科仪(北京)膜科技有限公司;Nano-ZS90纳米粒度仪 英国马尔文仪器公司;培英THZ-C型恒温振荡器 太仓市实验设备厂;680型酶标仪 美国Bio-Rad公司;pHS-3C+型酸度计 成都市纪方舟科技有限公司;XB 220A型电子天平 德国Precisa Gravimetrics AG公司;QL-901型涡流振荡器 海门市其林贝尔仪器制造有限公司。
1.3 方法
1.3.1 溶液配制
牛血清白蛋白用0.1 mol/L的磷酸盐缓冲液(pH 7.4)配成1.5×10-4mol/L的储备液,将制备好的储备液保存于4℃的冰箱中备用;花青素用去离子水(pH 6.3)配成1.5×10-3mol/L的储备液(此处为了计算方便,统一使用笃斯越橘中含量最高的矢车菊素-3-葡萄糖苷的相对分子质量449.2作为花青素的近似相对分子质量进行处理)。实验中所用的花青素溶液是现用现配的。
1.3.2 扫描透射电子显微镜下纳米颗粒的测定
在1.5 mL离心管中,加入10 μL BSA储备溶液,再加入不同量的花青素储备液,配制不含花青素的溶液和花青素与BSA的浓度比值是10的溶液,加0.1 mol/L的磷酸盐缓冲液(pH 7.4)定容至1 mL。用涡流振荡器混匀,最终BSA的浓度为1.5×10-6mol/L,室温下静置待用。取20 μL样品,使铜网浮在样品上6 min,滤纸吸干,待晾干后,使铜网浮在10 μL醋酸铀染液上,染色10 min,滤纸吸干多余的染液自然晾干,放在干燥器中保存待用。扫描透射电子显微镜观察在30 kV条件下进行,放大倍数为350 000。
1.3.3 BSA-花青素纳米颗粒粒径及Zeta电势的测定
在15 mL离心管中,加入1 mL BSA储备溶液,再加入不同量的花青素储备液,配制花青素与BSA的浓度比值是0、2、4、6、8、10的溶液,加0.1 mol/L的磷酸盐缓冲液(pH 7.4)定容至10 mL。用涡流振荡器混匀,最终BSA的浓度为1.5×10-5mol/L。粒径和Zeta电势测量在25℃条件下进行,重复3次,平衡时间2 min,累积次数100次。
1.3.4 BSA纳米载体对花青素结合量的测定
在15 mL离心管中,加入1 mL BSA储备溶液,再加入不同量的花青素储备液,配制花青素与BSA的浓度比值分别为0、2、4、6、8、10、12、14、16、18、20、22、24的溶液,加0.1mol/L的磷酸盐缓冲液(pH 7.4)定容至10mL,用涡流振荡器混匀。BSA的浓度为1.5×10-5mol/L。花青素的浓度分别为0、3、6、9、12、15、18、21、24、27、30、33、36×10-5mol/L。
通过盐析法使体系中的BSA纳米颗粒形成沉淀,从而将结合在纳米颗粒中的花青素和未结合的花青素分开。取制备好的各种纳米颗粒溶液10 mL,缓慢加入过量硫酸铵粉末,均匀搅拌,直至体系中有未溶解的硫酸铵,再搅拌10 min,仍有未溶解的硫酸铵,静置20 min后,取出上清液,放入离心管中,4℃、10 000×g离心30 min。取上清,用UV-Vis分光光度计检测上清液中花青素的含量,即游离花青素的含量(cf),而结合的花青素的量(cb)即:

式中:c即体系中加入的花青素的总量。
用UV-Vis分光光度计检测所有样品上清液在528 nm波长处的吸光度,即游离未结合的花青素的吸光度,然后根据花青素的标准曲线来计算cf,并根据公式计算cb。重复3个样品。
1.3.5 BSA纳米载体对花青素抗氧化活性的测定
先将花青素储备液用去离子水稀释成1.5×10-5mol/L的工作液。所有待测样品中花青素终浓度为1.5×10-5mol/L,BSA与花青素的浓度比值分别为0、0.2、0.4、0.6、0.8、1.0,用涡流振荡器混匀。室温静置,待用。BSA的浓度分别为0、0.3、0.6、0.9、1.2、1.5×10-5mol/L。
1.3.5.1 DPPH 自由基清除率的测定
DPPH自由基清除能力的测定采用孙蕾等[13]的方法,稍作改进。简述如下,在96孔板中,每孔加入15 μL样品溶液和60 μL 0.05 mmol/L Tris-HCl(pH 7.4)以及150 μL 0.15 mmol/L DPPH溶液混合反应,室温避光放置30 min。用无水乙醇溶液作为样品颜色空白参比;磷酸盐缓冲溶液为空白对照,在酶标仪上于520 nm波长处检测。依据公式(2)计算清除率。

式中:A对照表示无水乙醇溶液的吸光度;A样品表示样品的吸光度;A空白表示磷 酸盐缓冲溶液的吸光度。
1.3.5.2 ABTS+·清除率的测定
ABTS+·在波长630 nm处有最大吸收,根据吸收值的变化判断被测样品抗氧化能力的大小。实验方法参照Fang Ru等[14]的方法。简述如下:配制140 mmol/L ABTS储存液-20℃保存备用,使用时稀释至14 mmol/L,并与4.9 mmol/L的过硫酸钾溶液充分混匀,在室温下放置黑暗中反应13 h,即生成ABTS原液。将ABTS原液稀释至吸光度为0.50±0.02,在90 μL ABTS稀释液中加入10 μL的样品,放置4 min后用UV-Vis分光光度计检测630 nm波长处的吸光度。所有操作避光进行,重复3个样品。样品对ABTS+·的清除率按照公式(2)进行。
1.3.6 BSA对花青素稳定性及释放的测定
体外消化模型包括胃模型和肠模型,模型的设置参照美国药典(United States Pharmacopoeia,USP)并稍作调整[15],具体如下:1)体外胃模型(有酶)、0.32%胃蛋白酶、0.2% NaCl,用HCl调至pH 1.2;2)体外胃模型(无酶),0.2% NaCl,用HCl调至pH 1.2;3)体外肠模型(有酶),1%胰酶制剂、0.68% K2HPO4,用NaOH调至pH 7.4;4)体外肠模型(无酶),0.68% K2HPO4,用NaOH调至pH 7.4。体系中BSA浓度为1.5×10-5mol/L,花青素的浓度为0 mol/L或1.5×10-4mol/L。在恒温摇床中37℃、100r/min孵育6h,取样时间为0、1、2、3、4、5、6h,取样后立即于528nm波长处测量样品的吸光度。实验重复3次。
2 结果与分析
2.1 BSA-花青素自组装纳米颗粒的形态

图1 BSA-花青素自组装纳米颗粒的扫描透射电子显微镜图像(×350 0000 000)Fig.1 STEM image of BSA-ACN self-assembled nanoparticles (× 350 000)
由图1A可知,在水溶液中,自然的BSA分子之间相互交错呈现松散的聚集状态。水溶液中的蛋白质分子倾向于将亲水基团暴露在外部,疏水基团埋藏在内部,从而当蛋白质中的疏水性氨基酸超过30%时,无法将所有疏水基团埋藏,暴露在表面的疏水基团将促进分子之间形成聚集[16]。由于BSA分子疏水性氨基酸的比例大于30%,因此,在疏水相互作用和氢键共同作用下,水溶液中天然的BSA分子之间形成聚集,呈现松散的状态[17],暴露的疏水性基团不足以形成紧密的聚集。当加入磷酸盐缓冲液后,可见BSA分子聚集,形成球形颗粒,粒径约为30~35 nm(图1B),且颗粒呈现良好的分散性。加入花青素以后颗粒与B图相比明显减小,从30~35 nm减小到15~20 nm(图1C)。添加花青素后粒径减小,则说明BSA发生紧密的聚合。
2.2 BSA-花青素自组装纳米颗粒的粒径和电势分布
2.2.1 BSA-花青素自组装纳米颗粒的粒径分布
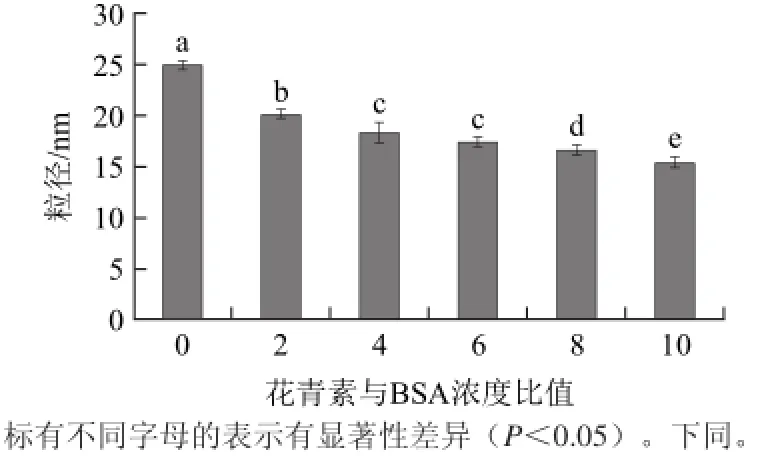
图2 BSA-花青素自组装纳米颗粒的粒径分布Fig.2 Size distribution of BSA-ACN self-assembled nanoparticles
由图2可知,BSA结合不同量的花青素后纳米粒径大小不同,呈现一定的变化趋势,未结合花青素的BSA颗粒粒径约为25 nm,这与电镜结果略有不同。马鑫等[18]研究多肽自组装的颗粒粒径,电镜和粒径仪的测定的结果分别约为50~100 nm和45~270 nm。这两种方法的结果差异可能由于不同的样品处理方法所致,由于电镜制样期间即铜网与样品接触时间内,样品可能发生聚合,使颗粒粒径变大;而粒径仪制样期间要涡旋充分振荡,样品发生聚合的机率小。与结合花青素的BSA颗粒粒径呈现显著性差异,且随着花青素浓度的增大,BSA-花青素自组装形成的纳米颗粒逐渐减小,当加入的花青素与BSA浓度比值为10时,粒径小于15 nm(图2),说明结合花青素以后BSA发生了紧密的缩合。
2.2.2 BSA-花青素自组装纳米颗粒的电势分布

图3 BSA-花青素自组装纳米颗粒的电势Fig.3 Zeta potential of BSA-ACN self-assembled nanoparticles
Peters[19]报道在pH值约为7的条件下,BSA分子表面电势为-18 mV。由图3可知,在磷酸盐缓冲体系中没有结合花青素的BSA的电势为-15 mV,本实验结果与Peters[19]的结果基本一致。加入少量的花青素以后,BSA-花青素自组装后的电势没有明显的变化,而是基本保持不变,当加入的花青素与BSA的浓度比值为6时,电势值(负)开始缓慢升高。BSA由于拥有较多的酸性氨基酸其净电荷为负,因此自然状态的BSA电势为负值,当加入花青素量较高时,电势值出现升高,这可能是由于花青素带负电荷[20],与BSA表面的正电基团结合,使得BSA表面的负电荷相对增加,BSA分子之间的静电斥力增加,从而阻止了BSA分子之间的聚集,造成结合花青素的BSA的纳米颗粒粒径逐渐减小。这与粒径分布和电镜扫描的结果一致。
2.3 BSA纳米载体对花青素的结合量
BSA纳米载体对花青素的结合趋势是:随着花青素的增加,被结合的花青素也在增加,当加入的花青素的浓度为3.0×10-4mol/L时(即花青素与BSA的浓度比值为20时),结合的花青素的量不再增加(图4),这说明BSA纳米载体对花青素的结合达到了饱和。每摩尔BSA分子上结合的花青素为10 mol,这可能与BSA的分子质量较大有关,故BSA与花青素结合的量较高[21]。但比Fang Ru等[22]报告的每摩尔BSA可以结合11 mol槲皮素略低,根据相似相容性原理,可能由于BSA疏水性结合位点多余亲水性结合位点,导致结合的疏水性的槲皮素多于亲水性的花青素。本研究中运用的硫酸铵是中性盐,在水中解离可形成硫酸根离子和铵根离子。因此,盐浓度对疏水相互作用和静电引力有一定的影响。由于BSA和花青素相互作用 是发生在磷酸盐缓冲溶液中的,磷酸盐缓冲溶液可能会对溶液中离子变化有一定缓冲作用,但不可能完全排除盐浓度对结合量的影响。Fang Ru等[22]报道,1mol BSA可以结合11mol槲皮素,而在本实验条件下,1mol BSA可以结合10mol花青素,这应该是相对稳定的结合量。

图4 BSA纳米载体对花青素的结合量Fig.4 Binding capacity of BSA nanocarrier to Ant
2.4 BSA纳米载体对花青素抗氧化活性的影响
为了考察与BSA纳米载体结合的花青素的抗氧化活性是否受到影响,进一步研究了不同浓度的BSA和与花青素结合的BSA的DPPH自由基和ABTS+·清除率,然后后者减去前者即为花青素的DPPH自由基和ABTS+·清除率。结果表明,在DPPH自由基体系中,被BSA载体结合的花青素清除DPPH自由基的能力有影响,当BSA与花青素的浓度比值小于0.4时,对DPPH自由基清除率约为30%,清除DPPH自由基的能力基本没有受到影响;当BSA与花青素的浓度比大于0.6时影响逐渐增大,对DPPH自由基清除率约为23%(图5A)。但总体上,BSA纳米载体对花青素的DPPH自由基清除能力的影响较小。在ABTS体系中,情况基本一致,未结合的花青素对ABTS+·清除率为56%,当BSA与花青素的浓度比大于0.4时,对ABTS+·清除率约为45%(图5B),BSA纳米载体对花青素的清除ABTS+·能力有影响,但影响较小。可以看出被BSA结合后的花青素的自由基 清除率有所下降,推测这可能与5-OH形成氢键有关。花青素的酚羟基是起抗氧化作用的重要基团,A环上的5-OH是重要的抗氧化基团[23],因此,5-OH的屏蔽必然会导致抗氧化作用的降低,因而导致花青素的自由基清除率降低。

图5 BSA纳米载体结合的花青素的抗氧化活性(nn== 33)Fig.5 DPPH radical and ABTS+· scavenging activities of unboundAnt and Ant bound to BSA nanocarrier (n= 3)
2.5 BSA纳米载体对花青素稳定性及释放的影响
González-Barrio等[24]报道花青素在回肠内分解后的含量降为40%,从而失去其特征吸收[10]。花青素在肠道体系很不稳定,易氧化形成醌类。因此,可根据吸光度的变化分析花青素稳定性的变化。
无论是结合的还是未结合的花青素,在胃模型pH 1.2中很稳定,在6 h内花青素的量几乎未发生变化,同样的有没有胃蛋白酶的存在对花青素的稳定性也没有什么影响(图6A)。这与文献[25]报道的花青素在酸性条件下稳定相一致。在肠模型pH 7.4中花青素很不稳定,未结合的花青素在pH 7.4(无酶)的条下很不稳定,其含量在6 h已经降低70%左右(图6B),这种含量降低是由于花青素被溶在水中的O2氧化,并生成了一种醌类物质,醌不再具备花青素的各种性质,如抗氧化性以及各种光谱特征,因此,在同样的测试条件下无法被检测[26]。同样是pH 7.4(无酶)的条件,被BSA结合的花青素在经过6 h后,含量基本没什么变化。可见BSA纳米载体对花青素有较好的保护作用。同样,未结合和结合的花青素在有胰酶的体系中,呈现出与不含胰酶的体系不同的变化趋势。未结合的花青素在有胰酶的体系中,经过6 h后含量有降低,但是减少量小于20%,这说明可能是体系中的胰酶对花青素也有保护作用,但通过比较发现,胰酶对花青素的保护作用没有BSA纳米载体的保护作用完全,仍有近20%的减少量。例如,无胰酶有BSA载体的体系的花青素的保留量要明显高于同时具有胰酶和BSA载体的体系和有胰酶无BSA载体的体系的花青素保留量。这可能是由于体系中胰酶的量很大,BSA的量较少,BSA可以很快被胰酶酶解从而不存在,对花青素的保护作用减弱。因此,有胰酶有BSA载体的体系中的花青素和有胰酶无BSA载体的体系中的花青素呈现基本相同的变化趋势。由此可见,在肠模拟体系中,花青素被载体结合后氧化速率可以明显的降低。由于只有游离状态的花青素才易于被氧化,因此,这个趋势也是BSA载体对结合的花青素的释放趋势,也就是说,BSA纳米载体对花青素在中性条件下有很好的缓释作用。

图6 BSA纳米载体包埋花青素在体外消化模型中的稳定性Fig.6 Stability of anthocyanin with or without BSA in SGF and SIF models
3 结 论
笃斯越橘花青素与BSA在磷酸盐缓冲液中自组装相互作用可形成纳米颗粒,粒径约为15~20 nm。每摩尔BSA分子可以结合10 mol花青素分子,BSA纳米载体能够显著提高花青素的抗氧化活性,在中性条件下,BSA纳米载体可以提高花青素的稳定性,并且有很好的缓释作用。
[1] HE J, GIUSTI M M. Anthocyanins: natural colorants with healthpromoting properties[J]. Annual Review of Food Science and Technology, 2010, 1: 163-187.
[2] HE Rui, LI Zhimin. The stability and antioxidant activity of anthocyanins from blueberry[J]. Food Technology and Biotechnology, 2010, 48: 42-49.
[3] JING P, BOMSER J A, SCHWARTZ S J, et al. Structure-function relationships of anthocyanins from various anthocyanin-rich extracts on the inhibition of colon cancer cell growth[J]. Journal of Agricultural and Food Chemistry, 2008, 56(20): 9391-9398.
[4] VALLS J, MILL˘N S, MART¸ M, et al. Advanced separation methods of food anthocyanins, isoflavones and flavanols[J]. Journal of Chromatography A, 2009, 1216: 7143.
[5] 方茹, 冷小京, 吴夏, 等. 三种蛋白和黄酮结合物中氢键与黄酮稳定性相关性分析研究[J]. 光谱学与光谱分析, 2012, 32(1): 108-112.
[6] JIMÉNEZ-AGUILAR D M, ORTEGA-REGRLES A E, LOZADARAM¸REZ J D, et al. Color and chemical stability of spray-dried blueberry extract using mesquite gum as wall material[J]. Journal of Food Composition and Analysis, 2011, 24(6): 889-894.
[7] ZHENG Nan, BUCHELI P, JING Hao. Effects of casein-and whey protein-dextran conjugat es on the stability of bog bilberry anthocyanin extract[J]. International Journal of Food Science and Technology, 2009, 44: 1452-1458.
[8] JAYABHARATHI J, THANIKACHALAM V, PERUMAL M V. A study on the binding interaction between the imidazole derivative and bovine serum albumin by fluorescence spectroscopy[J]. Journal of Luminescence, 2012, 132(3): 707-712.
[9] MUSTHABA S, BABOOTA S, AHMED S, et al. Status of novel drug delivery technology for phytotherapeutics[J]. Expert Opinion on Drug Delivery, 2009, 6: 625-637.
[10] ZHANG Liangke, HOU Shixiang, MAO Shengjun, et al. Uptake of folate-conjugated albumin nanoparticles to the SKOV3 cells[J]. International Journal of Pharmaceutics, 2004, 287: 155-162.
[11] FANG Ru, HAO Ruifang, WU Xia, et al. Bovine serum albumin nanoparticle promotes the stability of quercetin in simulated intestinal fl uid[J]. Journal of Agricultural and Food Chemistry, 2011, 59(11): 6292-6298.
[12] 姚惠芳, 景浩. 笃斯越桔花青素与牛血清白蛋白相互作用的光谱学研究[J]. 食品科学, 2013, 34(23): 6-10.
[13] 孙蕾, 刘晓瑞, 景浩. 三种有机酸对红豆越橘花青素的热稳定性研究[J]. 食品科技, 2011, 36(11): 230-236.
[14] FANG Ru, JING Hao, CHAI Zhi, et al. Study of the physicochemical properties of the BSA: flavonoid nanoparticle[J]. European Food Research and Technology, 2011, 233(2): 275-283.
[15] ADENUGBA A A, MCMARTIN D W, BEC A J. in vitro approaches to assess bioavailability and human gastrointestinal mobilization of foodborne polychlorinated biphenyls (PCBs)[J]. Journal of Environmenta l Science and Health Part B: Pesticides Food Contaminants, and Agricultural Wastes, 2008, 43: 410- 421.
[16] SEMENOV N, SUBBOTIN A V. Theory of self-assembling structures of model oligopeptides[J]. Macromolecules, 2010, 43: 3487-3501.
[17] GIOVAMBATTISTA N, LOPEZ C, ROSSKY P, et al. Hydrophobicity of protein surfaces: separating geometry from chemistry[J]. Proceedings of the National Academy of Science, 2008, 105: 2274-2287.
[18] 马鑫. 表面活性剂类多肽自组装材料的研究[D]. 无锡: 江南大学, 2011: 36-37.
[19] PETERS T. Serum albumin[J]. Advances in Protein Chemistry, 1985, 37: 161-245.
[20] 孙利娜, 王璋. 草莓汁色泽和悬浮稳定性的研究[J]. 冷饮与速冻食品工业, 2006, 12(3): 11-14.
[21] LI Fengqian, SU Hua, WANG Jing, et al. Preparation and characterization of sodium ferulate entrapped bovine serum albumin nanoparticles for liver targeting[J]. International Journal of Pharmaceutics, 2008, 349: 274-282.
[22] FANG Ru, JING Hao, CHAI Zhi, et al. Design and characterization of protein-Quercetin bioactive nanoparticles[J]. Journal of Nanobiotechnology, 2011, 9(1): 19.
[23] MUSIALIK M, KUZMICZ R, PAWLOWSKI T S, et al. Acidity of hydroxyl groups: an overlooked influence on antiradical properties of flavonoids[J]. Journal of Organic Chemistry, 2009, 74: 2699-2709.
[24] GONZ˘LEZ-BARRIO R, BORGES G, MULLEN W, et al. Bioavailability of anthocyanins and ellagitannins following consumption of raspberries by healthy humans and subjects with an Ileostomy[J]. Journal of Agricultural and Food Chemistry, 2 010, 58: 3933-3939.
[25] REYES L F, CISNEROS-ZEVALLOS L. Degradation kinetics and colour of anthocyanins in aqueous extracts of purple-and red-flesh potatoes (Solanum tuberosum L.)[J]. Food Chemistry, 2007, 100(3): 885-894.
[26] BERMÐDEZ-SOTO M, TOM˘S-BARBER˘N F, GARC¸ACONESA M. Stability of polyphenols in chokeberry(Aronia melanocarpa) subjected to in vitro gastric and pancreatic digestion[J]. Food Chemistry, 2007, 102: 865-874.
Characteristics of Bovine Serum Albumin-Anthocyanin Bioactive Nanoparticles
YAO Hui-fang, DONG Xue-yan, JING Hao*
(Beijing Key Laboratory of Functional Food from Plant Resources, College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
The nanoparticle formation between bovine serum albumin (BSA) and anthocyanin (ACN) was characterized using scanning transmission electron microscope (STEM) and nanoparticles size analyzer. The anthocyanin-binding capacity of BSA was studied by ammonium sulfate salting-out method. DPPH and ABTS radical scavenging capacities and release characteristics in both simulated intestinal fluid (SIF) and simulated gastric fluid (SGF) systems were investigated for oxidation stability of BSA-bound anthocyanin system. The results showed that both BSA and anthocyanin-bound BSA could be self-assemble and form nanoparticles in phosphate buffer (pH 7.4), and the particle size (15–20 nm) of the anthocyaninbound BSA was smaller than that of the BSA (30–35 nm). The molar binding ratio between BSA and antocyanin was 1:10. The DPPH radical and ABTS+· scavenging abilities of BSA-bound anthocyanin were significantly stronger than those of unbound anthocyanin. There was no significant difference in stability between unbound anthocyanin and BSA-bound anthocyanin in SGF system, while significant difference in SIF system was observed. The content of unbound anthocyanin decreased by approximately 70% after 6 hours; however, no significant change was observed for BSA-bound anthocyanin. BSA revealed remarkable stabilizing effect on anthocyanin oxidation.
bovine serum albumin; anthocyanin; nanoparticles; binding capacity; oxidation stability
TS201.4
A
1002-6630(2014)01-0001-06
10.7506/spkx1002-6630-201401001
2013-01-24
国家自然科学基金项目(31171676)
姚惠芳(1987—),女,硕士研究生,研究方向为蛋白与天然活性小分子物质的相互作用的制备和应用。E-mail:yaohuifang_1987@163.com
*通信作者:景浩(1957—),男,教授,博士,研究方向为分子营养与食品安全。E-mail:haojing@cau.edu.cn

