黑灵芝多糖对S-180荷瘤小鼠腹腔巨噬细胞cAMP/PKA、IP3/Ca2+及DAG/PKC信号通路的影响
黄建琴,聂少平*,张莘莘,黄丹菲,朱科学,谢明勇
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
灵芝(Ganoderma lucidum)为担子菌纲多孔菌科灵芝菌属的药食两用高等真菌,是我国最具有研究价值的著名药用真菌之一,也是一种新资源食品[1]。灵芝多糖是灵芝的主要活性成分,大量实验证明,灵芝多糖具有免疫增强和抗肿瘤作用[2-4]。黑灵芝又为灵芝中的极品,对人体保健具有的药用疗效远高于其他种类的灵芝[5]。
众所周知,肿瘤的发生发展与免疫密切相关。目前,国内外大量研究表明灵芝多糖具有显著的免疫调节活性[6-7]。实验证明,黑灵芝多糖(polysaccharides fromGanoderma atrum,PSG-1)对体外培养的肿瘤细胞无直接抑制作用,也不能诱导肿瘤细胞凋亡,但对体内肿瘤有明显的抑制作用[8]。但黑灵芝多糖抗肿瘤作用的确切机制,尤其是对巨噬细胞、NK细胞等的信号转导过程有何影响尚不清楚[9]。本实验利用腹水瘤S-180细胞建立荷瘤小鼠模型,收集S-180荷瘤小鼠腹腔巨噬细胞,探讨黑灵芝多糖对S-180荷瘤小鼠腹腔巨噬细胞环磷酸腺苷(cyclic adenosine monophosphate,cAMP)/细胞蛋白激酶A(protein kinase A,PKA)、三磷酸肌醇(inositol triphosphate,IP3)/Ca2+及甘油二酯(diacylglycerol,DAG)/蛋白激酶C(protein kinase C,PKC)信号通路的影响,进而确定PSG-1对荷瘤小鼠巨噬细胞的激活作用,为研究PSG-1抗肿瘤分子机制提供一定参考。
1 材料与方法
1.1 材料、试剂与仪器
黑灵芝(Ganoderma atrum)采自江西赣南灵芝生产基地,PSG-1由本实验制备,其纯度>99.8%。采用红外光谱法、气相色谱法、分子大小排阻色谱法、氨基酸分析仪以及高效液相色谱法测得该多糖主要由甘露糖、半乳糖以及葡萄糖组成,其物质的量的比为1∶1.28∶4.91,平均分子质量为1013kD[10]。
RPMI-1640培养基 北京索莱宝科技有限公司;胎牛血清 美国HyClone公司;脂多糖 美国Sigma公司;小鼠IP3、DAG和cAMP ELISA试剂盒 上海西唐有限公司;钙离子荧光探针试剂盒 碧云天生物技术研究所;Anti-PKA、Anti-PKC抗体 美国Abcam公司;Antiβ-actin辣根酶标记山羊抗小鼠IgG、辣根酶标记山羊抗兔IgG 北京中杉金桥生物技术有限公司。
电泳仪、凝胶成像系统 美国Bio-Rad公司;CO2培养箱、VARIOSKAN FLASH酶标仪 美国Thermo公司;超净工作台 吴江市净化设备总厂;3K15-高速冷冻离心机 美国Sigma公司;高压灭菌装备 上海医疗器械厂。
1.2 细胞及动物
腹水瘤S-180细胞株,购于中国科学院上海细胞库。
BALB/c清洁级小鼠30只,雌性,体质量(22±2)g,购自南昌大学医学院动物房。
1.3 方法
1.3.1 动物的造模
用PBS将无菌收集的S-180细胞悬液浓度调节至1×106个/mL,用1mL一次性无菌注射器每只0.2mL接种于小鼠右肢腹沟处。静养约1周后小鼠右肢处出现肿瘤块,造模成功。
1.3.2 腹腔巨噬细胞的分离纯化
造模成功后继续静养1周,待肿瘤块如黄豆大小,取S-180荷瘤小鼠颈椎脱臼处死,放入碘伏3min,75%酒精中浸泡3min脱碘,用无菌注射器向腹腔注入5mL预冷的PBS缓冲液,用棉球轻柔腹部1~2min后吸取腹腔液于离心管中,重复冲洗腹腔3次,收集以上PBS,于1000r/min离心5min,弃上清沉淀物。再用含10%胎牛血清的RPMI-1640培养液重悬沉淀物并转移至培养瓶中,置CO2培养箱(5% CO2、37℃)培养4h后,轻轻吸弃培养液,用PBS洗去未贴壁细胞,重复洗涤3次,即可得到纯化的腹腔巨噬细胞[11-13]。
1.3.3 荷瘤小鼠腹腔巨噬细胞上清液中IP3、DAG和cAMP含量的测定
按上述方法制备的S-180荷瘤小鼠腹腔巨噬细胞悬液,台盼蓝拒染检测其活性(>95%),分别按每孔4×105个细胞接种于96孔细胞培养板中,补充培养液至200μL,在细胞中加入PSG-1使其终质量浓度为20、40、80、160μg/mL,每组设5个复孔。置CO2培养箱中培养24h,收集上清。采用夹心ELISA法测定IP3、DAG和cAMP含量,具体操作方法按照相应的试剂盒说明进行。
1.3.4 荷瘤小鼠腹腔巨噬细胞内Ca2+含量测定
取腹腔巨噬细胞悬液按1×105个/mL细胞浓度接种于6孔板中,不同质量浓度PSG-1刺激24h后,收集细胞,参照Fluo-3 AM(钙离子荧光探针)试剂盒说明处理收集的巨噬细胞,室温下用PBS清洗细胞,再100μL PBS重悬细胞后避光保存,在流式细胞仪上检测胞内钙离子含量。
1.3.5 荷瘤小鼠腹腔巨噬细胞PKA及PKC表达水平的测定
取不同质量浓度的PSG-1作用荷瘤小鼠巨噬细胞24h后,收集细胞,参照总蛋白提取试剂盒说明收集各组的蛋白,并用BCA法检测蛋白含量。用Western blotting法测定PKA及PKC的表达量。在上样缓冲液中煮沸5min进行变性,然后将每个样品装载到10%的SDS-PAGE,转移到硝酸纤维素膜上,用5%奶粉在室温下封闭1h,用一抗即抗PKA及抗PKC于4℃孵育过夜。TBST缓冲液洗涤后,在室温下用适当的辣根过氧化物酶标记的羊抗兔抗体将膜孵育1h,再次洗涤后,用化学发光试剂覆盖膜表面,ChemiDocXRS+凝胶成像系统检测PKA及PKC表达水平。实验重复3次。
1.4 统计学分析
2 结果与分析
2.1 PSG-1对S-180荷瘤小鼠腹腔巨噬细胞产生IP3、DAG和cAMP的影响
由表1可见,PSG-1在终质量浓度20~160μg/mL范围内作用24h后可促进S-180荷瘤小鼠腹腔巨噬细胞生成IP3、DAG和cAMP,并显著高于模型对照组,呈一定的剂量相关性。
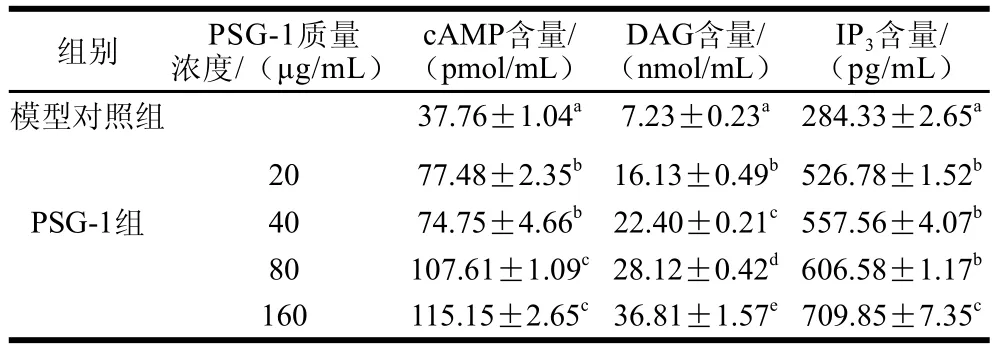
表1 PSG-1对荷瘤小鼠脾腹腔巨噬细胞产生cAMP、DAG及IP3的影响lTable 1 Effects of PSG-1 on cAMP, DAG and IP production in peritoneal macrophages of tumor-bearing mice
2.2 PSG-1对S-180荷瘤小鼠腹腔巨噬细胞内Ca2+含量的影响
细胞内游离Ca2+是细胞内重要的信使,其主要贮存于胞内钙库(如肌细胞的肌浆网)和线粒体中。为了检测PSG-1是否影响巨噬细胞内Ca2+浓度,用PSG-1作用荷瘤小鼠巨噬细胞24h后,流式细胞仪测定细胞内Ca2+含量。由图1可知,与模型对照组相比PSG-1刺激后S-180荷瘤小鼠巨噬细胞内Ca2+浓度显著增加,并呈剂量依赖性增强。其浓度依赖性关系如图2所示。

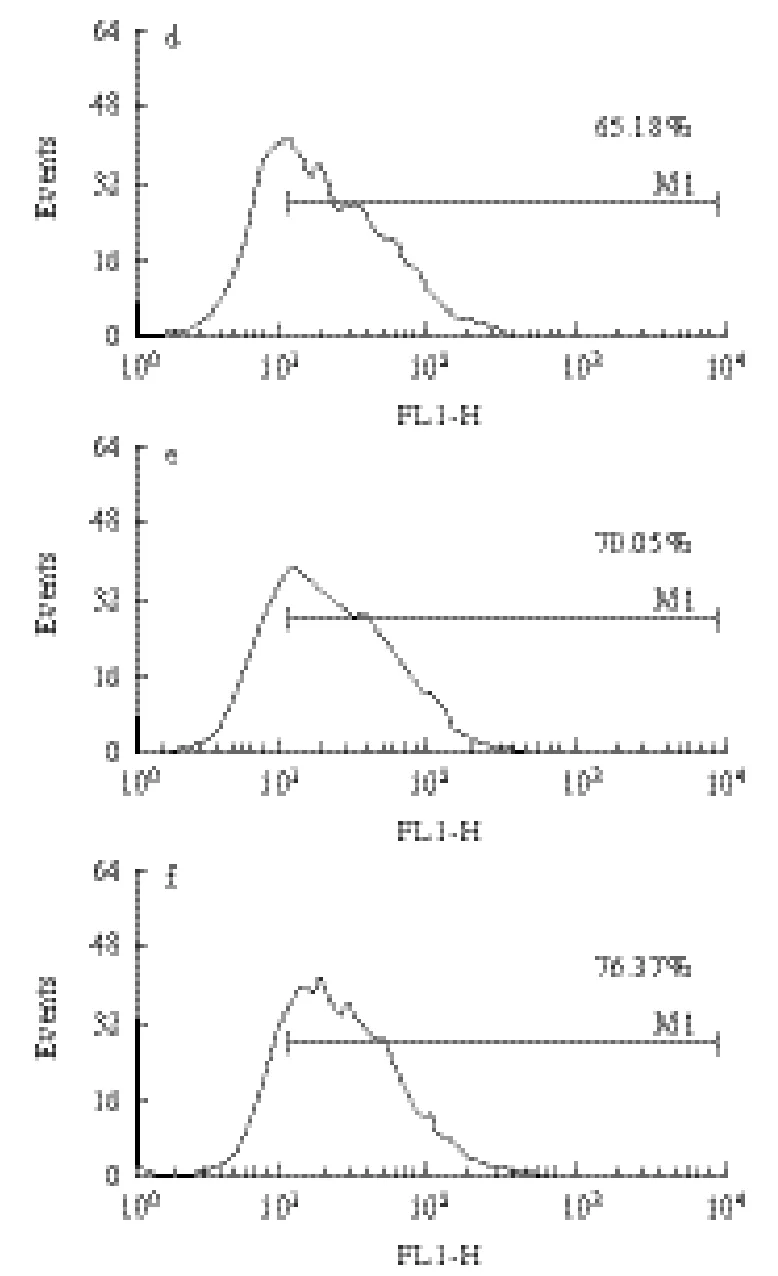
图1 PSG-1对荷瘤小鼠腹腔巨噬细胞Ca2+浓度的影响Fig.1 Effects of PSG-1 on Ca2+ flux in peritoneal macrophages of tumorbearing mice

图2 荷瘤小鼠腹腔巨噬细胞Ca2+浓度对应的比例Fig.2 The corresponding proportion of Ca2+ flux in peritoneal macrophages of tumor-bearing mice
2.3 PSG-1对S-180荷瘤小鼠腹腔巨噬细胞内PKA及PKC表达水平的影响
PKA和PKC在受体介导的信号传递过程中起着重要作用。PKA又称依赖于cAMP的蛋白激酶A,是一种结构最简单、生化特性最清楚的蛋白激酶。一般认为,真核细胞内几乎所有的cAMP的作用都是通过活化PKA,从而使其底物蛋白发生磷酸化而实现的。PKC也是一种常见激酶,一般以非活性状态存在于细胞质中。由图3、4可知,随着PSG-1质量浓度的增加,PKA及PKC表达水平增强,与模型对照组比较均有显著增加。

图3 PSG-1对荷瘤小鼠脾腹腔巨噬细胞PKA及PKC表达水平的影响Fig.3 Effect of PSG-1 on the protein expression levels of PKA and PKC in peritoneal macrophages of tumor-bearing mice
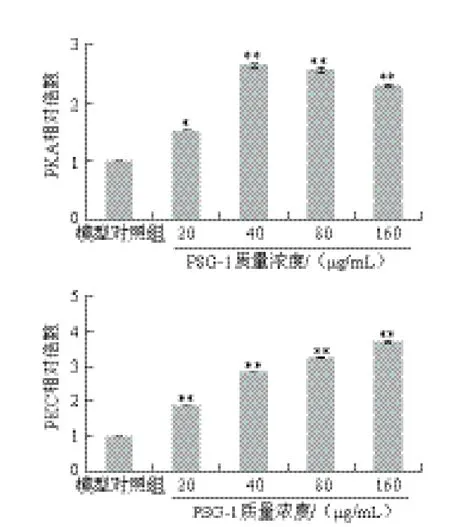
图4 PKA及PKC表达量对应的灰度值(n=33)Fig.4 The corresponding gray values of the protein expression levels of PKA and PKC (n = 3)
3 讨 论
目前肿瘤是严重危害人类生命的疾病之一,对人类的健康有很大危害,其死亡率居高不下,寻找有效的预防和高效抗肿瘤药物,仍然是科研工作者面临的重要挑战。大量研究表明,机体的免疫功能与肿瘤的发生发展有密切的关系[14]。巨噬细胞是免疫效应细胞,具有多种免疫功能,包括免疫防御、免疫监视、免疫调节以及抗原呈递等,在机体的免疫系统中起着重要作用。
早期研究表明,丝裂原活化蛋白激酶(mitogenactivated proteinkinases,MAPKs)区主要受酪氨酸激酶(tyrosine kinase,PKT)、PKC和PKA等激酶刺激活化[15],而MAPK又参与多糖激活巨噬细胞免疫应答[16]。所以,PKA及PKC参与多糖巨噬细胞免疫应答。PKA被cAMP活化后,在ATP的存在下调节细胞的物质代谢和基因表达,从而影响细胞的增殖和分化。PKC也在调节细胞增殖和改变细胞的离子通道方面发挥着重要的作用。研究表明,PKA和PKC介导的信号转导途径涉及到多种细胞的存活和增殖[17]。那么,PSG-1是否通过cAMP/PKA、IP3/Ca2+及DAG/PKC信号通路的活化作用于患病小鼠的腹腔巨噬细胞,从而改善患病小鼠的免疫能力,目前尚无报道,本实验对此进行了探讨。
cAMP是由腺苷酸环化酶催化ATP生成的;IP3和DAG由G-蛋白偶联受体激活磷脂酶C生成IP3及DAG。DAG、IP3和cAMP是细胞内常见的第二信使,参与激活细胞内多个信号通路,引起级联反应,进行细胞的应答。cAMP主要是通过蛋白脂磷酸化作用继续传递信息,将代谢途径中的一些靶蛋白中的丝氨酸或苏氨酸残基磷酸化,将其激活或钝化[18-19]。这些被共价修饰的靶蛋白往往是一些关键调节酶或重要功能蛋白,因而可以介导胞外信号,调节细胞反应。实验结果表明,荷瘤小鼠腹腔巨噬细胞经PSG-1处理后cAMP浓度显著升高,同时PKA表达量也显著增加。由此可以推断,PSG-1可以激活荷瘤小鼠巨噬细胞内cAMP/PKA信号通路。
IP3和DAG功能分别是开放胞内钙库、激活Ca2+途径和在Ca2+和磷脂酰丝氨酸存在下激活PKC。以肌醇磷脂代谢为基础的细胞信号系统,最大的特点是胞外信号被膜受体接受后,同时产生两个胞内信使,分别激动两个信号传递途径即IP3/Ca2+和DAG/PKC途径[20-21]。细胞信号转导理论认为:IP3通过作用于内质网膜上特异的受体使其内部Ca2+释放,引起胞内Ca2+水平的增加,从而启动胞内Ca2+信号系统,即通过依赖Ca2+、钙结合蛋白的酶类活性变化来调节和控制一系列的生理过程。DAG通过激活PKC,以磷酸化的形式对许 多蛋白质和酶类进行修饰,从而调节和控制另外一系列的生理过程。两条途径相辅相成,又互相约束。 同时两条通路信号的强弱又可根据原始信号的不同特征在细胞内加以调节,而使细胞对这些外界 信号作出不同的反应。实验结果发现,在PSG-1刺激下,荷瘤小鼠巨噬细胞产生IP3和DAG量增加,且细胞内Ca2+浓度及PKC表达量也显著升高。由此可以说明,PSG-1可以启动荷瘤小鼠巨噬细胞内IP3/Ca2+和D AG/PKC途径。该两条途径在信号转导的过程中可能共同协作,进而激活荷瘤小鼠的腹腔巨噬细 胞,但需要进一步深入研究。
综上所述,在相关研究表明PSG-1具有体内抗肿瘤作用[8,22]及多糖对巨噬细胞 免疫应答作用的研究基础上[16],本实验通过接种S-180于小鼠右腹股沟处建立荷瘤小鼠模型,无菌分离荷瘤小鼠腹腔巨噬细胞用于研究PSG-1对细胞内的信号通路的影响,为进一步研究PSG-1抗肿瘤机制提供参考。结果显示,PSG-1可以激活荷瘤小鼠腹腔巨噬细胞内cAMP/PKA、IP3/Ca2+及DAG/PKC信号通路,从而使患病小鼠免疫细胞发生一系列抵抗肿瘤的反应。由此可以猜测,PSG-1通过作用于荷瘤小鼠巨噬细胞,激发细胞内不同的信号通路,提高机体免疫能力从而实现抗肿瘤作用。针对得出的实验结果,本实验室将进一步研究细胞内其他信号通路,最终确定PSG-1激活巨噬细胞的一系列通路。
[1]陈亚非, 陈金显. 灵芝多糖免疫调节及抗肿瘤作用综述[J]. 中国食品添加剂, 2002(4): 36-40.
[2]邓海林, 吴佩颖, 王建新. 灵芝的研究进展[J]. 时珍国医国药, 2005,16(2): 141-143.
[3]赵世华, 姚文兵, 庞秀炳, 等. 灵芝多糖分离鉴定及抗肿瘤活性的研究[J]. 中国生化药物杂志, 2003, 24(4): 173-176.
[4]李松, 吴青华, 陈畅, 等. 多糖抗肿瘤活性的最新研究进展[J]. 中国生化药物杂志, 2007, 28(3): 213-215.
[5]弓晓峰. 黑灵芝元素形态 , 活性成分及其保健功能研究[D]. 南昌: 南昌大学, 2006: 13-162.
[6]李文娟, 聂少平, 余强, 等. 黑灵芝多糖对免疫抑制小鼠的免疫调节作用[J]. 食品科学, 2009, 30(19): 297-299.
[7]朱科学, 聂少平, 李文 娟, 等. 黑灵芝多糖对小鼠脾淋巴细胞增殖及诱生细胞因子的影响[J]. 食品科学, 2010, 31(19): 351-354.
[8]ZHANG Shenshen, NIE Shaoping, HUANG Danfei, et al.Immunomodulatory effect ofGanoderma atrumpolysaccharide on CT26 tumor-bearing mice[J]. Food Chemistry, 2013, 136: 1213-1219.
[9]LIU Gaoqiang, ZHANG Kechang. Mechanisms of the anticancer action ofGanoderma lucidum(Leyss. ex Fr.) Karst.: a new understanding[J].Journal of Integrative Plant Biology, 2005, 47(2): 129-135.
[10]CHEN Yi, XIE Mingyong, NIE Shaoping, et al. Purification,compo sition analysis and antioxidant activity of a polysaccharide from the fruiting bodies ofGanoderma atrum[J]. Food Chemistry, 2008,107(1): 231-241.
[11]ZHANG Jingsong, TANG Qingjiu, ZHOU Changyan, et al. GLIS, a bioactive proteoglycan fraction fromGanoderma lucidum, displays anti-tumour activity by increasing both humoral and cellular immune response[J]. Life Sciences, 2010, 87(19): 628-637.
[12]尹美珍, 李世普, 袁琳, 等. 小鼠腹腔巨噬细胞的分离培养与鉴定[J].武汉大学学报: 医学版, 2006, 27(2): 203-205.
[13]李海涛, 肖丹, 屈学民, 等. 小鼠腹腔巨噬细胞的分离与培养[J]. 现代生物医学进展, 2008, 8(4): 638-639.
[14]王统一, 赵兵, 王玉春. 多糖免疫调节和抗肿瘤研究进展[J]. 过程工程学报, 2006, 6(4): 674-682.
[15]YAMASHITA Y M, NAKASEKO Y, SAMEJIMA I, et al. 20S cyclosome complex formation and proteolytic activity inhibited by the cAMP/PKA pathway[J]. Nature, 1996, 384: 276-279.
[16]易阳, 曹银, 张名位. 多糖调控巨噬细胞免疫应答机制的研究进展[J].中国细胞生物学学报, 2011, 33(11): 1267-1277.
[17]TANG Xinyan, ZHANG Caiqiao. Activation of protein kinases A and C promoted proliferation of chicken primordial germ cells[J]. Animal Reproduction Science, 2007, 101(3): 295-303.
[18]KOVO M, KANDI-COHEN M, BEN-HAIM M, et al. An active protein kinase A (PKA) is involved in meiotic arrest of rat growing oocytes[J]. Reproduction, 2006, 132(1): 33-43.
[19]SAZONOVA O V, BLISHCHENKO E Y, TOLMAZOVA A G, et al.Stimulation of fi broblast proliferation by neokyotorphin requires Ca2+influx and activation of PKA, CaMK II and MAPK/ERK[J]. FEBS Journal, 2007, 274(2): 474-484.
[20]VILLA I, dal FIUME C, MAESTRONI A, et al. Human osteoblastlike cell proliferation induced by calcitonin-related peptides involves PKC activity[J]. American Journal of Physiology-Endocrinology and Metabolism, 2003, 284(3): E627-E633.
[21]付志华, 李素平. TNF-α诱导心肌成纤维细胞增殖的信号转导机制研究[J]. 中国医疗前沿, 2013, 8(2): 1-3.
[22]梁军, 李予蓉, 孙纪元, 等. 灵芝-912 对小鼠移植性肿瘤的抑制作用[J]. 中国现代医学杂志, 2003, 13(9): 11-13.

